非小细胞肺癌组织中CRT、BAP31表达变化及其意义
周金林,邓述恺,张仕国
(1巴中市中心医院,四川巴中 636000;2西南医科大学附院第一医院)
肺癌是最常见的肺部原发性恶性肿瘤,起源于支气管黏膜或腺体。全球肺癌的发病率和病死率均呈上升态势,而在我国尤其明显;目前,我国肺癌的发病率及病死率已居所有恶性肿瘤之首,其中男性发病率和病死率居第一位,女性发病率居第二位(低于乳腺癌),而病死率居第一位[1]。肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中NSCLC大约占肺癌的85%,通过传统的治疗手段,肺癌患者的5年生存率也只有15%左右,使用新的化疗药物和重组人血管内皮抑制素以及分子靶向药物治疗后,患者中位生存时间有一定延长,不过晚期肺癌患者的生存率仍然没有大幅度提高[2]。近年来,医学分子生物学和基因检测技术得到了很大的发展,肺癌的免疫治疗已逐渐成为肺癌治疗领域研究的热点,目前已经研究发现了PD1、PD-L1等免疫检测点抑制剂,临床试验表明免疫治疗可以使NSCLC的病死率得到一定程度的改善。新近研究[3]发现,在肺癌组织中CRT的表达较正常肺组织明显升高,并且与肺癌的发生发展以及肿瘤免疫关系密切。BAP31在结直肠癌、宫颈癌及恶性黑色素瘤中明显升高,可能与肿瘤的发生、发展有一定关系,并且与CRT关系密切;二者均有可能成为NSCLC诊断和治疗的新靶点,以及预测预后的重要指标。本研究通过免疫组化法检测NSCLC组织、正常肺组织、癌旁组织中CRT与BAP31的表达,分析其表达的差异性,探索NSCLC组织中CRT和BAP31的表达与患者年龄、性别、吸烟、病理分型、淋巴结转移及临床分期的关系,并且研究CRT与BAP31在NSCLC组织的表达水平有无相关性,为进一步寻找新的NSCLC生物标记物以及免疫检测和治疗靶点提供科学依据。
1 资料与方法
1.1 临床资料 选取2015年1~12月西南医科大学附属第一医院收治的NSCLC患者60例(肿瘤组),男42例,女18例;年龄35~76(57.3±9.6)岁,其中≥60岁25例,<60岁35例。纳入标准:①所选病例均经病理学诊断确诊为NSCLC患者;②具备完整的临床诊断和治疗资料;③排除其他肺部疾病以及严重的心、肝、肾和代谢性疾病,取得待测标本前均未进行放疗、化疗、分子靶向治疗及其他针对恶性肿瘤的治疗。依据WHO肺癌的组织病理学分类方法,腺癌30例,鳞癌30例;依据2014年NSCLC美国国立综合癌症网络(NCCN)指南,其中将既往有吸烟史且吸烟指数(每天吸烟支数×吸烟年数)≥400支年者列为肺癌的高危人群,以此标准将吸烟指数≥400支年者的重度吸烟患者归入吸烟者(28例),将吸烟指数<400支年者的轻中度吸烟患者、不吸烟者以及被动吸烟者归入非吸烟者(32例);有淋巴结转移26例,无淋巴结转移34例;按照国际抗癌联盟(UICC)2015年第八版肺癌分期标准,Ⅰ+Ⅱ期组39例,Ⅲ+Ⅳ期组21例。手术切取NSCLC组织60例份、癌旁组织(至少距肿瘤边缘5 cm以上)30例份(癌旁组)。
1.2 组织中CRT、BAP31检测方法 切取NSCLC组织、正常肺组织以及癌旁组织蜡块,每个标本切片3张,然后进行烤片,其中2张用于免疫组化,一张用于HE染色。HE染色常规进行,光镜下观察染色结果,然后与免疫组化结果做对照。免疫组化染色经过脱蜡、脱苯后分别向每张切片滴加约50 μL的3%H2O2浸泡10 min阻断内源性过氧化物酶活性,然后用PBS液冲洗两次,随后将切片浸入盛有柠檬酸缓冲液(pH 6.0)的高温容器中,微波炉加热直至沸腾后停止加热,然后自然冷却至室温后取出玻片,蒸馏水冲洗2次,每次2 min,PBS液冲洗3次,每次5 min,厚滴加一抗:每张切片滴加正常山羊血清工作液进行封闭,室温孵育30 min,然后滴加1∶100的CRT和BAP31一抗,然后进行室温孵育3 h,PBS液浸洗3次,每次3~5 min;滴加二抗,每张切片滴加50 μL试剂盒中的免疫组化试剂,放入37 ℃的孵育箱中孵育30 min;PBS液冲洗切片,每次5 min,反复冲洗2次;然后进行DAB显色、分化、脱水、封片,随后在光学显微镜下观察染色强度及染色细胞数。染色结果的判断与分级:结果的判断是根据切片的染色强弱程度以及阳性表达的肿瘤细胞数占肿瘤细胞总数百分比进行综合评估,根据文献报道[3],CRT主要定位于细胞质和细胞膜,其阳性表达的结果是肿瘤细胞胞质或胞膜中出现棕色或者褐色颗粒,在高倍显微镜(×400)下观察切片的染色情况,随机取10个视野的均值,对肿瘤细胞的阳性表达细胞百分比和染色强度分别进行评分,评分规则如下:(1)对组织切片中着色的阳性肿瘤细胞数与肿瘤细胞总数的比例进行评估,<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;(2)根据胞质的染色强度进行评分:未见显色的评为0分,显色为浅棕色的评为1分,显色为褐色的评为2分,显色为黑褐色的评为3分(染色深浅均与背景着色相对比);(3)定义上述两项分数相乘的结果为N,N≤1分评为阴性(-),1
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验,相关性分析采用Spearman等级相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组CRT、BAP31阳性率比较 肿瘤组、癌旁组CRT阳性率分别为88.33%、13.33%,BAP31阳性率分别为83.33%、6.67%,两组比较,P均<0.05。
2.2 CRT、BAP31阳性表达与NSCLC临床病理参数的关系 结果见表1。由表1可知,CRT阳性表达与NSCLC淋巴结转移、临床分期相关(P均<0.05)。
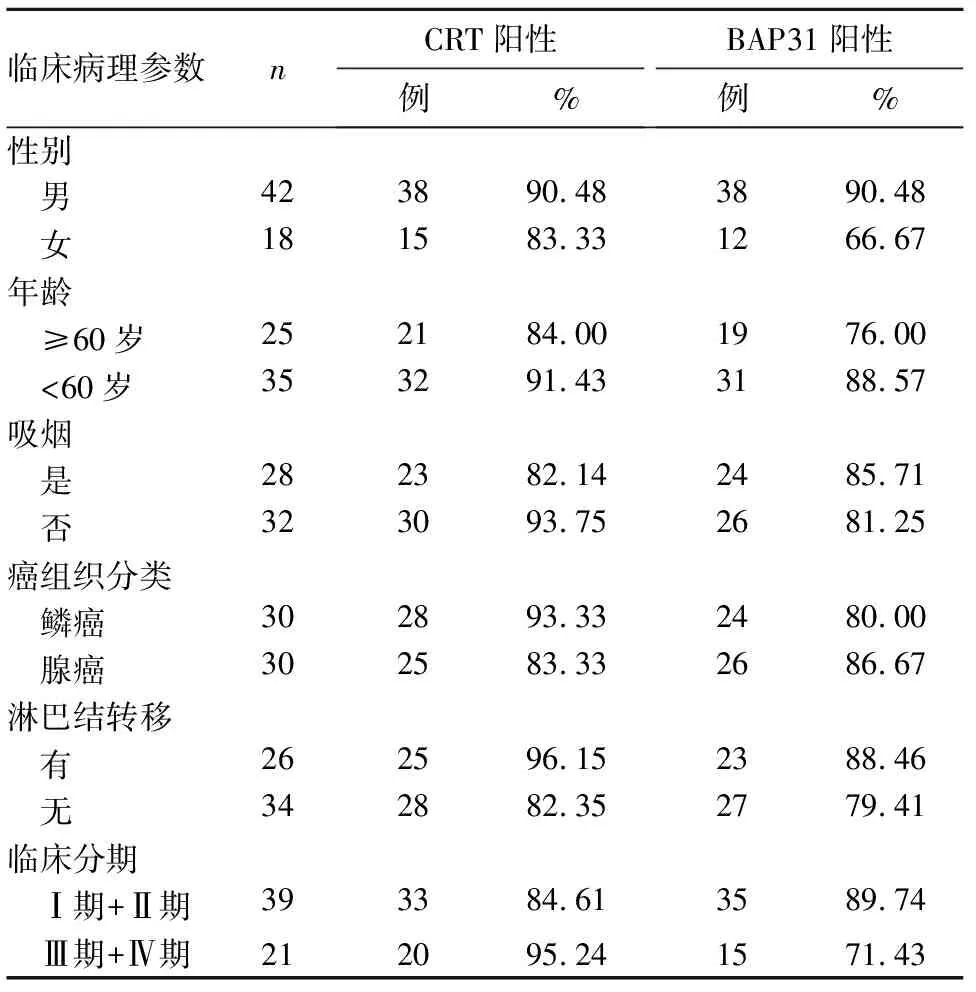
表1 CRT、BAP31阳性表达与NSCLC临床病理参数的关系
2.3 肿瘤组CRT与BAP31表达的相关性 肿瘤组CRT与BAP31表达无相关性(r=0.400,P>0.05)。
3 讨论
CRT是一种主要存在于内质网内的结构高度保守的分子伴侣和钙离子结合蛋白,参与了人体多种生理和病理过程[6]。CRT在许多疾病中都有异常表达,例如类风湿关节炎、系统性红斑狼疮[7]、心血管疾病等。目前已被证实CRT在多种肿瘤组织中呈高表达, CRT在胃癌中表达升高,且高表达的CRT会导致胃癌细胞的增殖和迁移,同淋巴结转移相关,并且具有较差的预后[8];在乳腺癌中CRT的表达明显升高,并且恶性程度越高的细胞中CRT表达越高,Ⅲ期和Ⅳ期表达较Ⅰ期和Ⅱ期明显升高[9];在NSCLC中,有研究报道[3]显示:CRT在鳞癌和腺癌均呈高表达,而小细胞肺癌中CRT的表达较鳞癌和腺癌却明显降低;王富强等[10]采用免疫印迹的方式检测NSCLC组织中CRT蛋白水平,结果发现CRT同NSCLC患者的淋巴结转移和TNM分期相关,但是目前尚未见通过免疫组化检测NSCLC患者中CRT的表达同淋巴结转移和临床分期的报道;研究[11]证实,CRT在NSCLC的高表达导致抗肿瘤免疫细胞(如树突状细胞等)的累积增加,进而引起抗肿瘤免疫反应,加强常规抗肿瘤治疗(放疗和化疗)的治疗效果,从而对NSCLC患者的预后有较大帮助。Liu等[12]研究进一步发现,CRT可以作为佐剂促进树突细胞成熟,并且增强针对NSCLC的黑素瘤相关抗原3(MAGE-A3)的特异性细胞毒性T淋巴细胞(CTL)应答。在NSCLC中,CRT介导的效应记忆T细胞主要是CD4+T淋巴细胞和CD8+T淋巴细胞,这些T细胞更趋向效应记忆表型,效应记忆T细胞记忆的细胞毒性可以控制原发肿瘤进展和转移,因此而被认为可以控制癌症的进展[13];另一方面,Stoll等[14]研究发现,CRT表达缺失的NSCLC患者预后较差。
CRT通过影响细胞黏附、迁移和侵袭从而进一步影响肿瘤转移的过程,CRT促进细胞黏附的机制主要是通过和整合素之间的相互作用而完成的,整合素的作用是连接细胞外基质和细胞内的细胞骨架以及触发由内向外、由外向内的信号转导,CRT结合整合素可能影响整合素-细胞骨架之间的相互作用,从而影响细胞黏附的能力[15],此外有研究证实钙网蛋白可以通过影响胰岛素受体底物1(IRS-1)磷酸化的差异而影响细胞粘附的能力[16]。由此可以看出,CRT可以通过促进细胞粘附和迁移从而影响NSCLC的发展。
BAP31是一种定位于内质网膜的多功能蛋白质,其可以通过与免疫球蛋白(mIgM和mIgD)结合而影响其功能,并且激活B淋巴细胞[17,18],参与了许多重要蛋白质在内质网的跨膜转运,并且可以介导细胞凋亡等,但BAP31只在人体部分正常组织中低表达(除睾丸组织外)[19],其阳性产物定位于胞质,是蛋白质分子转运过程中的重要载体蛋白。1996年,Li等[20]首次发现了BAP31在乳腺癌中表达明显升高;随后Yu等[21]发现,BAP31在绝大多数恶性黑色素瘤中呈高表达,其总阳性率达86.5%;我国学者董令仪等[22]研究了BAP31在结直肠癌中的表达情况,研究表明BAP31在结直肠癌中的表达阳性率为64.17%,明显高于黏膜组织中的6.67%,高分化和没有远处转移的结直肠癌患者中BAP31的表达较低分化以及有远处转移的患者更高,并且发现BAP31表达阴性患者的总体生存率明显低于BAP31阳性表达的患者,说明BAP31可能参与了肿瘤细胞的发展过程,可能BAP31的高表达能够通过一些通路阻止肿瘤细胞的侵袭和迁移,或者其介导的肿瘤免疫有利于患者的预后,这其中的机制尚未阐明,有待进一步的研究。但是,目前BAP31在NSCLC中的表达无相关研究报道。
本研究通过免疫组化法检测CRT、BAP31在NSCLC组织中的表达,并分析其表达水平同患者年龄、性别、吸烟、病理类型、有无淋巴结转移和临床分期的关系,结果显示NSCLC组的CRT和BAP31表达水平明显升高,在正常肺组织中和癌旁组织中也有微量表达,说明CRT可能参与了NSCLC形成的过程,可能成为NSCLC的一个独立预测因子;Ⅲ+Ⅳ期患者较Ⅰ+Ⅱ期患者CRT的表达更强,说明CRT的表达与NSCLC淋巴结转移相关,并同TNM临床分期相关,提示CRT可能参与了NSCLC的进展过程,之前有研究报道[10]使用免疫印迹方式检测CRT在NSCLC的表达,发现CRT在有淋巴结转移组较没有淋巴结转移组明显升高,ⅢA期较Ⅰ期、Ⅱ期明显升高,此结果与之前研究结果一致。因此说明CRT可能成为潜在的诊断NSCLC的标志物,并且其阳性表达与淋巴结转移和TNM分期相关,表明其可能参与了NSCLC的进展过程。BAP31在NSCLC中的表达同一系列临床参数无明显相关性,这些实验结果同前面研究报道[22]BAP31在结直肠癌中的表达结果相一致;目前,BAP31在NSCLC中发生、发展的具体机制尚未阐明,需进一步研究探讨。
BAP31作为一种内质网膜蛋白,在CRT移位至细胞膜表面的过程中起了重要作用[23],BAP31是CRT膜转位中必不可少的物质,阻断其介导的CRT膜转位通路,比如BAP31表达缺失的情况下,CRT将不能移位至肿瘤细胞膜表面,从而消除了肿瘤细胞凋亡的免疫原性,减弱肿瘤放疗或化疗引起的抗癌免疫反应。由此可以看出,CRT和BAP31在介导NSCLC的肿瘤免疫过程中起了协同作用,研究二者在NSCLC中的表达相关性可能为研究NSCLC免疫治疗提供新的方向。本研究通过对CRT和BAP31在NSCLC中表达的相关性分析发现,两者对应的总体相关系数无统计学意义,说明此两指标无明显相关关系,可能跟实验样本量偏小有关,更大样本量以及更精细的分期的研究或许更有利于分析二者在NSCLC中表达的相关性。
总之,CRT和BAP31在NSCLC中均呈高表达,二者可能均参与了NSCLC的发生发展以及远处转移,并且都与肿瘤免疫密切相关,因此CRT和BAP31可能成为诊断NSCLC新的生物标志物,并且有望成为免疫检测和治疗的新靶点,二者介入NSCLC的机制尚未完全阐明,有待进一步的研究证实。

