马源蜡样芽孢杆菌的分离鉴定及毒力基因检测
崔一龙,石 芸,杨达汉,尹有勤,薛江东,霍晓伟,马德慧
(1.内蒙古民族大学 动物科学技术学院,内蒙古 通辽 028000;2.内蒙古自治区肉牛疾病防控工程技术研究中心,内蒙古 通辽 028042)
蜡样芽孢杆菌(Bacilluscereus)是一种广泛分布于水、空气、土壤、饲料和各类食物中的革兰氏阳性、兼性需氧产芽孢杆菌[1]。该菌为条件致病菌[2],有的虽可作为益生菌添加到食品和饲料中,但有的也会污染食物,引起人畜的恶心呕吐、发热、腹痛腹泻等症状,也是引起牛乳房炎和子宫内膜炎的常见病原菌[3],但是对马感染该菌的报道极其罕见。
2018年年初,内蒙古通辽市某马术俱乐部多匹赛马颈部及关节部皮肤接连出现直径约为3 cm的脓肿结节,随后结节逐渐增大,变成脓肿,脓肿破溃后流出淡红色及黄白色脓液,溃疡处容易出血且不易愈合,少数马匹病死。内蒙古民族大学动物科学技术学院实验室通过对患病马匹脓液及死亡马匹肝脏中分离到的细菌进行染色镜检、动物致病性试验、生化鉴定、药物敏感试验、16S rRNA基因扩增、系统进化树分析及部分毒力基因检测分析,确定了该菌为致病性的蜡样芽孢杆菌。现报道如下。
1 材料与方法
1.1 实验材料
用碘酊对患病马匹未破溃的脓包进行消毒,再用消毒棉签蘸取脓汁保存备用;20只20 g左右小白鼠由内蒙古民族大学动物实验室提供。酵母浸粉、氯化钠、蛋白胨、琼脂粉、牛肉膏购自青岛海博生物技术有限责任公司;细菌基因组DNA提取试剂盒购自天根公司;DL 1 000 DNA Marker、DL 2 000 DNA Marker、PCR Mastermix、6×DNA Loading Buffer购自TaKaRa公司。
1.2 病原菌的分离与培养
将无菌采集的脓汁及死亡马匹的肝脏分别接种于营养琼脂平板和血琼脂平板上,37 ℃培养24 h后,挑取血琼脂平板上生长的细菌菌落进行革兰氏染色和显微镜检查;再挑取细菌菌落接种于普通液体LB培养基中,150 r·min-137 ℃振荡培养16 h。收集菌体进行后续实验。
1.3 分离菌的动物致病性试验
将小白鼠分为实验组及对照组,其中实验组分为3个小组,每组5只小鼠,这3个小组的小鼠分别腹腔注射104、106、108CFU·mL-1的分离菌,每只注射0.5 mL;对照组的5只小鼠分别腹腔注射0.5 mL生理盐水。注射后每3 h观察并记录一次结果,将死亡小鼠进行剖检,再次分离致病菌进行鉴定。
1.4 分离菌的生化鉴定和药物敏感性测试
使用BD PhoenixTM100全自动微生物及药敏分析系统对菌株进行生化特性鉴定和药物敏感性测试,吸取25 μL 0.6个麦氏单位的菌液加入到AST肉汤,将肉汤倒入革兰氏阳性鉴定药敏复合检测板,再将检测板放入仪器中,反应结束后仪器自动读卡并显示结果。
1.5 分离菌的16S rRNA PCR鉴定
利用细菌基因组DNA提取试剂盒提取分离菌的DNA作为模板。PCR扩增引物使用16S rRNA基因扩增通用引物,由吉林省库美生物有限公司合成,上游引物27f序列为:5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物1492r序列为:5’-ACGGCTACCTTGTTACGACTT-3’。PCR扩增反应的总体系为25 μL∶PCR Mastermix 11 μL,ddH2O 11 μL,DNA模板 2 μL,上下游引物各0.5 μL。反应条件:94 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 33 s,35个循环;72 ℃ 10 min,PCR产物经1%琼脂糖凝胶电泳检测。
1.6 分离菌株同源性及进化树分析
16S rRNA PCR产物由北京生工生物工程有限公司测序,测序结果在GenBank进行BLAST比对。选取同源性相近的几条序列,用MEGA 5.0软件对选取的序列进行编辑,并构建系统进化树分析结果。
1.7 分离菌的毒力基因PCR检测
根据文献[4],设计肠毒素FM基因(entFM)、细胞毒素K基因(cytK)、溶血型肠毒素基因(hbl)、非溶血型肠毒素基因(nhe)等8种潜在毒力基因的引物,引物由吉林省库美生物有限公司合成,引物信息见表1。PCR反应体系及条件参照1.5节所述,PCR产物经1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 分离菌株培养特征
病原菌在营养琼脂平板上37 ℃培养12 h,形成较大、灰白色、不透明、圆形、凸起的菌落,边缘呈毛玻璃状,迎光呈白蜡状;在血琼脂平板上37 ℃培养12 h形成浅灰色、似毛玻璃状菌落;革兰氏染色镜检为阳性大杆菌,菌体单个或长链状排列,有椭圆形芽孢,位于菌体中央或近端(图1)。培养特性初步表明分离菌株为蜡样芽孢杆菌菌群。
表1毒力基因PCR扩增引物
Table1Virulence gene PCR amplification primers

目的基因Target gene引物名称Primer name引物序列Primer sequence(5′-3′)产物长度PCR product/bp参考文献ReferencesentFMentFM FGTTCGTTCAGGTGCTGGTAC486[5]entFM RAGCTGGGCCTGTACGTACTTcytKcytK FCGACGTCACAAGTTGTAACA565[5]cytK RCGTGTGTAAATACCCCAGTTnheAnheA FTACGCTAAGGAGGGGCA500[6]nheA RGTTTTTATTGCTTCATCGGCTnheBnheB FCAAGCTCCAGTTCATGCGG935[6]nheB RGATCCCATTGTGTACCATTGnheCnheC FACATCCTTTTGCAGCAGAAC618[6]nheC RCCACCAGCAATGACCATATChblAhblA FGCAAAATCTATGAATGCCTA884[6]hblA RGCATCTGTTCGTAATGTTTThblChblC FCCTATCAATACTCTCGCAA695[6]hblC RTTTCCTTTGTTATACGCTGChblDhblD FAATCAAGAGCTGTCACGAAT430[6]hblD RCACCAATTGACCATGCTAAT
2.2 分离菌动物致病性试验结果
对照组的小鼠在实验期内一直未发病;试验组中,注射104CFU·mL-1菌液的小鼠6 h后接连出现食欲减退、被毛粗乱、精神萎靡、全身颤抖的现象,注射106CFU·mL-1菌液的小鼠12 h后全部死亡,而注射108CFU·mL-1菌液的小鼠6 h内全部死亡。剖杀死亡的小鼠,从心脏及肝脏中都分离到蜡样芽孢杆菌,该菌在动物体内呈败血症感染。动物试验结果表明,本研究中分离到的蜡样芽孢杆菌具有很强的致病性。
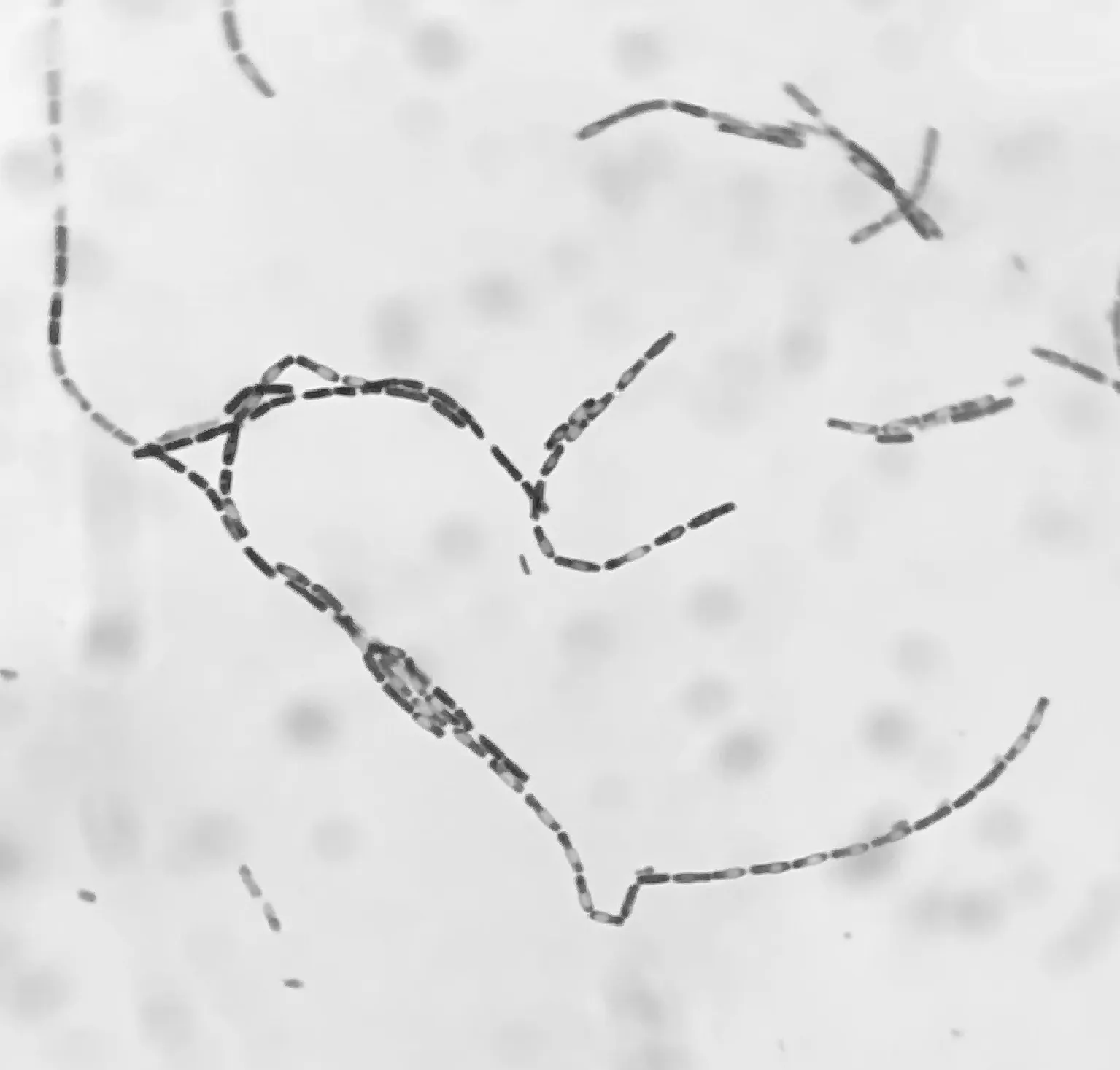
图1 分离菌株在显微镜下的形态(400×)Fig.1 Morphology of the isolates under the microscope(400×)
2.3 分离菌生化鉴定结果
利用Phoenix TM 100全自动微生物及药敏分析系统对分离菌株进行检测,结果显示,该菌能分解葡萄糖、果糖、海藻糖等,不分解尿素、塔格糖、七叶酸乙酸等(表2),表明分离菌符合蜡样芽孢杆菌的生化特性。
2.4 分离菌药物敏感性试验结果
药敏结果显示,分离菌株对克林霉素、庆大霉素等药物敏感,对红霉素、米诺环素等药物中度敏感,对头孢他啶、氨曲南等药物耐药(表3)。药敏试验结果为有针对性地选择药物防治蜡样芽孢杆菌引起的疾病提供了参考。
2.5 分离菌16S rRNA和部分毒力基因PCR鉴定结果
16S rRNA的PCR产物经1%的琼脂糖凝胶电泳后,获得目的基因产物与预期目的基因大小相符,测序产物大小为1 402 bp,表明分离菌株为蜡样芽孢杆菌(图2)。8种毒力基因PCR扩增再经琼脂糖凝胶电泳后均获得与预期大小相符的产物,毒力基因PCR结果表明分离菌株具有该8种毒力基因(图3)。
表2分离菌株生化试验结果
Table2Biochemical test results of isolated strains
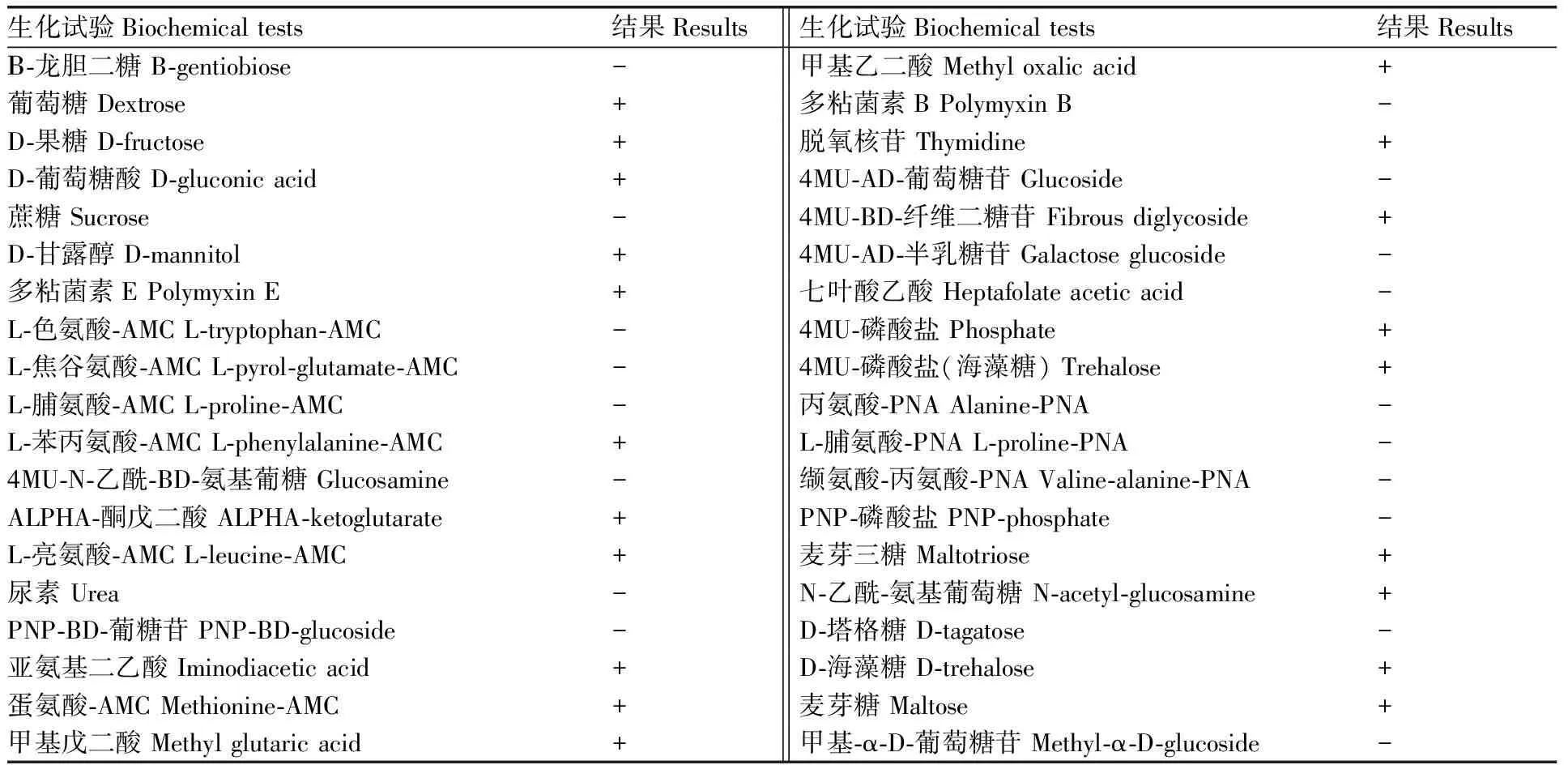
生化试验Biochemical tests结果Results生化试验Biochemical tests结果ResultsΒ-龙胆二糖 B-gentiobiose-甲基乙二酸 Methyl oxalic acid+葡萄糖 Dextrose+多粘菌素B Polymyxin B-D-果糖 D-fructose+脱氧核苷 Thymidine+D-葡萄糖酸 D-gluconic acid+4MU-AD-葡萄糖苷 Glucoside-蔗糖 Sucrose-4MU-BD-纤维二糖苷 Fibrous diglycoside+D-甘露醇 D-mannitol+4MU-AD-半乳糖苷 Galactose glucoside-多粘菌素E Polymyxin E+七叶酸乙酸 Heptafolate acetic acid-L-色氨酸-AMC L-tryptophan-AMC-4MU-磷酸盐 Phosphate+L-焦谷氨酸-AMC L-pyrol-glutamate-AMC-4MU-磷酸盐(海藻糖) Trehalose+L-脯氨酸-AMC L-proline-AMC-丙氨酸-PNA Alanine-PNA-L-苯丙氨酸-AMC L-phenylalanine-AMC+L-脯氨酸-PNA L-proline-PNA-4MU-N-乙酰-BD-氨基葡糖 Glucosamine-缬氨酸-丙氨酸-PNA Valine-alanine-PNA-ALPHA-酮戊二酸 ALPHA-ketoglutarate+PNP-磷酸盐 PNP-phosphate-L-亮氨酸-AMC L-leucine-AMC+麦芽三糖 Maltotriose+尿素 Urea-N-乙酰-氨基葡萄糖 N-acetyl-glucosamine+PNP-BD-葡糖苷 PNP-BD-glucoside-D-塔格糖 D-tagatose-亚氨基二乙酸 Iminodiacetic acid+D-海藻糖 D-trehalose+蛋氨酸-AMC Methionine-AMC+麦芽糖 Maltose+甲基戊二酸 Methyl glutaric acid+甲基-α-D-葡萄糖苷 Methyl-α-D-glucoside-
+, 阳性; -, 阴性。
+, Positive; -, Negative.
表3分离菌株药物敏感性试验结果
Table3Drug susceptibility test of the isolates
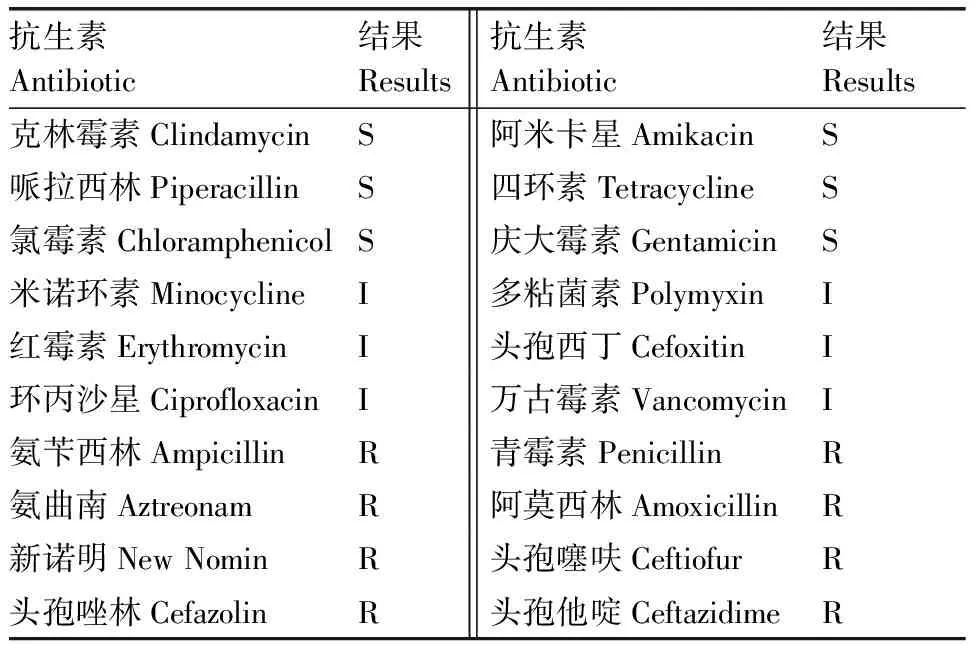
抗生素Antibiotic结果Results抗生素Antibiotic结果Results克林霉素ClindamycinS阿米卡星AmikacinS哌拉西林PiperacillinS四环素TetracyclineS氯霉素ChloramphenicolS庆大霉素GentamicinS米诺环素MinocyclineI多粘菌素PolymyxinI红霉素ErythromycinI头孢西丁CefoxitinI环丙沙星CiprofloxacinI万古霉素VancomycinI氨苄西林AmpicillinR青霉素PenicillinR氨曲南AztreonamR阿莫西林AmoxicillinR新诺明New NominR头孢噻呋CeftiofurR头孢唑林CefazolinR头孢他啶CeftazidimeR
R,耐药;I,中度耐药;S,敏感。
R, Drug resistance; I, Moderate resistance; S, Sensitive.
2.5 分离菌株同源性与系统进化树分析
将分离菌株的测序序列命名为“X”,测序结果在NCBI的GenBank中进行BLAST比较分析,结果与序列号为KR999918.1(中国新疆株)的蜡样芽孢杆菌同源性达到100%。选取比对结果中同源性相近的序列做系统进化树分析,结果显示,测序序列“X”与序列号为KR999918.1(中国新疆株)的蜡样芽孢杆菌遗传距离最近(图4),表明该分离菌株为蜡样芽孢杆菌。
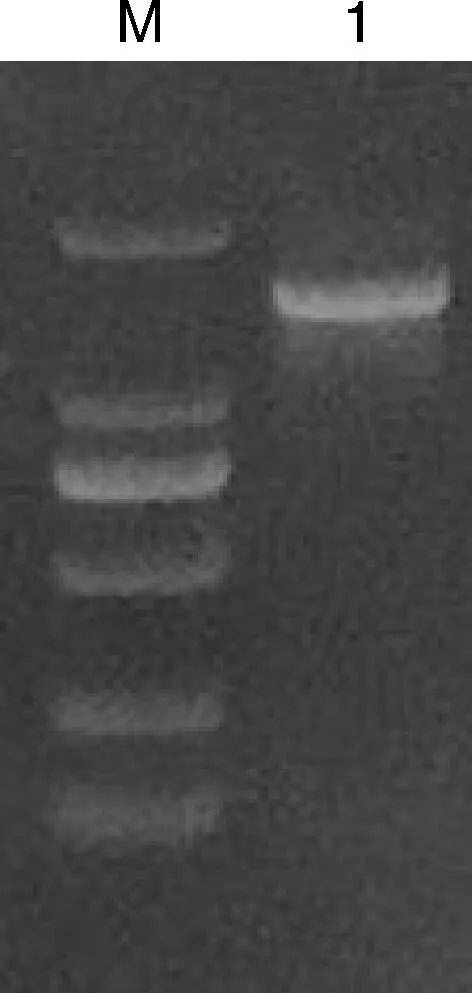
1,16S rRNA PCR扩增产物;M,DNA marker DL 2 000。1, Product of 16S rRNA by PCR;M, DNA marker DL 2 000.图2 分离菌株16S rRNA PCR扩增结果Fig.2 16S rRNA PCR amplification results of isolates
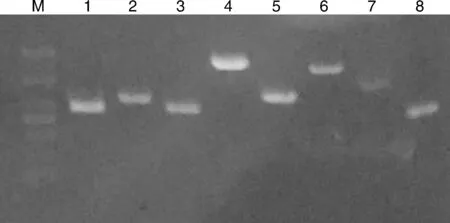
M,DL 1 000 DNA marker;1—8,毒力基因entFM, cytK, nheA, nheB, nheC, hblA, hblC, hblD的扩增结果。M, DL 1 000 DNA marker; 1-8, Virulence gene of entFM, cytK, nheA, nheB, nheC, hblA, hblC, hblD.图3 毒力基因PCR扩增结果Fig.3 PCR amplification of virulence genes
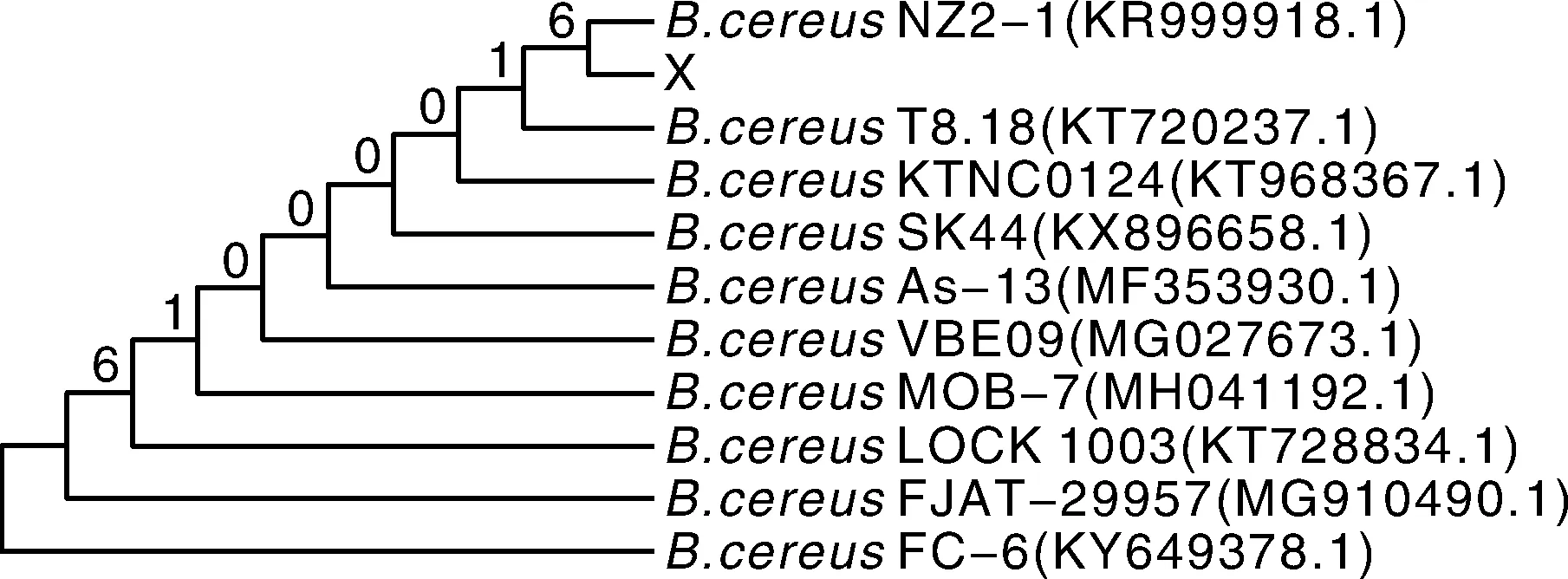
图4 分离菌株16S rRNA基因系统进化树Fig.4 Phylogenetic tree of the isolate 16S rRNA gene
3 讨论
本研究对分离得到的菌株进行细菌形态学观察、动物致病性试验、Phoenix TM 100全自动微生物及药敏分析系统检测、16S rRNA的分子生物学试验以及系统进化树分析等一系列鉴定,证明从患病及死亡马匹体内分离出的致病菌为蜡样芽孢杆菌。
传统的细菌鉴别方法步骤繁杂、过程缓慢、大多由人为主观判断,易给判定结果带来误差。16S rDNA基因具有高度的保守性和特异性,普遍应用于细菌鉴别或构造细菌的系统发育进化树,是细菌种属鉴定的分子生物学基础。本研究中应用的Phoenix TM 100全自动微生物及药敏分析系统比传统的生理生化检验方法、纸片药敏法更加专业和快捷,以更科学的角度对分离菌株进行了明确的鉴定。药敏试验结果显示,分离菌株对克林霉素、庆大霉素等多种药物敏感,应该在国家兽药使用准则允许的条件下,有针对性地选择药物来防治蜡样芽孢杆菌引起的疾病。
蜡样芽孢杆菌分布广泛,与人类的关系也非常紧密。它能产生多种酶类及营养物质,增进机体消化吸收,还可以产生抗菌物质,抑制有害微生物的繁殖,降解土壤中的营养成分,改善生态环境等。但是,作为条件致病菌,蜡样芽孢杆菌还能够引起人畜食物中毒,造成呕吐和腹泻,也是引起牲畜乳房炎、子宫内膜炎的病原菌之一。已有研究表明,蜡样芽孢杆菌主要含有与腹泻毒素相关的肠毒素FM基因、细胞毒素K基因、非溶血性肠毒素nhe基因、溶血素bl基因和与呕吐相关的呕吐基因[7],其中肠毒素FM基因控制肠毒素蛋白的合成[8];细胞毒素K基因对人类肠道上皮细胞具有毒性作用[9];非溶血性肠毒素可以控制一种金属蛋白,该蛋白具有分解明胶和胶原的活力[10];溶血素bl基因具有溶血性、细胞毒性,可引起皮肤溃烂、溃疡和充血、淤血等症状[11];呕吐基因可以产生呕吐毒素,该毒素能保持完整并且转化为活性毒素吸附在内脏上[12]。
本研究从分离到的蜡样芽孢杆菌基因组中检测到肠毒素FM基因、细胞毒素K基因、非溶血性肠毒素nhe基因和溶血素bl等8种毒力基因。因此可推断本研究中患病马匹的脓肿病症是由溶血素bl基因引起,再加上其他毒素的共同作用导致了部分马匹的死亡。目前关于蜡样芽孢杆菌致病性的相关报道少之又少,本研究分离出的蜡样芽孢杆菌致病性很强,对很多药物产生了抗药性,药敏试验中耐药比例占到了常用药物的40%,给动物造成了极大的危害,这提示人们应该重视致病性蜡样芽孢杆菌的潜在威胁,加强蜡样芽孢杆菌用作益生菌时的安全性检测,以及有必要对病原性蜡样芽孢杆菌的流行病学进行调查并对致病性蜡样芽孢杆菌的毒力基因作进一步的研究。

