犊牛脂肪干细胞的分离、培养与鉴定
王帅帅,张 才,2,*,孟素丹,黄永志,朱雪敏,王玉琴,2,杨自军
(1.河南科技大学 动物与科技学院,河南 洛阳 471000; 2.河南省肉羊繁育工程技术研究中心,河南 洛阳 471000)
我国奶牛的存栏量位于世界前列,奶牛围产期的营养代谢性疾病日趋严重,脂肪肝病和酮病给奶牛养殖业造成巨大的损失。奶牛脂肪细胞是奶牛营养代谢病研究的重点之一,成熟的脂肪细胞作为终末分化的细胞,体外分离比较困难,获得率和存活率较低。通过分离奶牛脂肪干细胞,体外定向诱导分化为脂肪细胞,可有效解决脂肪细胞体外分离的难题。已有国内学者从荷斯坦牛中分离出前体脂肪细胞或原代脂肪细胞,并成功诱导分化成为脂肪细胞[10-11],但并未对分离的细胞进行鉴定。
本研究采用组织剪碎法结合胰蛋白酶消化法消化、收集荷斯坦犊牛肾周脂肪组织中的脂肪干细胞。通过体外培养、表面标志物及生物学功能鉴定等方法对分离得到的细胞进行鉴定,以期为奶牛营养代谢病的相关研究打下基础。
1 材料与方法
1.1 试验动物
1日龄健康荷斯坦雄性牛犊由生生牧业有限公司提供。
1.2 试剂与仪器
1.2.1 主要试剂
1640培养基、胎牛血清购自美国Gibco公司;速眠新购自圣达动物药品有限公司;胰蛋白酶、胶原蛋白酶Ⅰ、二甲基亚砜(DMSO)、CCK8试剂盒、IBMX(3-异丁基-1-甲基黄嘌呤)、吲哚美辛、 β-甘油磷酸钠购自北京Solarbio公司。鼠抗兔Vimentin、CD31、CD34、CD44、CD45、CD90单克隆抗体,山羊抗兔IgG抗体,CY3显色试剂盒,DAPI染液购自武汉赛维尔生物科技有限公司;地塞米松、胰岛素、维生素C(VC)购自辰欣药业有限公司。
1.2.2 主要仪器
CO2恒温培养箱,上海三发科学仪器有限公司;倒置荧光显微镜,德国Carl Zeiss AG公司;低温高速离心机、酶标仪,美国Thermo Fisher公司;生物安全柜,上海博迅医疗生物仪器有限公司。
二是加强行业管理,建立以行业自律为主的会计职业道德管理机构,对出具虚假会计信息的事务所予以重罚,直至取消其执业资格,坚决打击违规者,净化行业空气,重塑行业信用。
1.3 试验方法
1.3.1 犊牛脂肪干细胞的分离培养
犊牛称重,静脉注射适量的速眠新,全麻后保定,对手术通路进行剃毛、消毒等处理,在无菌条件下获取肾周脂肪组织后转移至超净工作台。先用PBS清洗3次,在显微镜下仔细去除组织表面的血管、筋膜、结缔组织等,剪成1 mm3的小块。使用PBS冲洗3次后移入大离心管内,加入0.25%的胰蛋白酶消化液37 ℃恒温消化1 h,1 000 r·min-1离心5 min,弃上清,普通培养基(改良1640培养基+100 U·mL-1青霉素+0.1 mg·mL-1链霉素)重悬细胞再次离心,重复3次该操作。当观察到组织呈云雾状或乳糜状时,加入含血清培养基终止消化。以180目细胞筛网过滤去除未消化组织,1 000 r·min-1离心10 min。PBS漂洗,离心去上清,加入完全培养基(含体积分数为10%胎牛血清的普通培养基)轻轻吹打成单细胞悬液,备用。
1.3.2 犊牛脂肪干细胞原代培养及传代培养
使用贴壁培养基(完全培养基+5 μg·mL-1胰岛素+0.5μg·mL-1地塞米松)调整细胞浓度至2×104个·mL-1,接种5 mL细胞悬液于25 cm2细胞培养瓶中,放于CO2培养箱中(37 ℃、5% CO2、95%湿度)培养。24 h后首次换液,除去未贴壁细胞及杂质,之后每3 d换液1次。待细胞贴壁生长融合达到80%~90%时,经胰蛋白酶消化后,以1∶3进行传代培养。
1.3.3 犊牛脂肪干细胞表面蛋白鉴定
取第5代细胞,经胰蛋白酶消化后计数,调整细胞密度至每孔1×104个,接种12孔板中(放入细胞爬片),培养30 min后加入1.5 mL完全培养基,每3 d换液1次。待细胞生长融合达80%时吸去培养基,PBS清洗3次,用4%多聚甲醛室温下固定30 min,PBS清洗3次,加100 μL破膜工作液,室温孵育10 min,PBS清洗3次,血清封闭30 min,加入大鼠抗兔Vimentin、CD31、CD34、CD44、CD45和CD90单克隆抗体,空白对照用PBS代替,平放于湿盒内4 ℃过夜。次日取出,用PBS清洗3次,加入CY3标记的山羊抗兔IgG抗体,37 ℃避光孵育50 min,之后用PBS清洗3次,加入DAPI染液,避光室温孵育10 min。细胞爬片稍微甩干后用抗荧光淬灭封片剂封固在载玻片上,荧光显微镜下观察。
1.3.4 成脂诱导分化
取第10代细胞,调整细胞密度至每孔2×104个,接种于12孔板中。处理组和对照组各6孔,加入完全培养基,待细胞贴壁生长融合至70%时,处理组改用成脂诱导培养基(完全培养基+1 μmol·L-1地塞米松+10 μg·L-1胰岛素+500 μmol·L-1IBMX+200 μmol·L-1吲哚美辛)培养,对照组用完全培养基培养,每2 d换液1次。培养21 d后,吸出培养基, PBS冲洗3次,室温下加入4%多聚甲醛溶液固定20 min,PBS冲洗3次,加入油红O染液,锡箔纸包被避光染色20 min,PBS冲洗3次,倒置显微镜下观察。
1.3.5 成骨诱导分化
取第10代细胞,调整细胞密度至每孔2×104个,接种12孔板中。处理组和对照组各6孔,加入完全培养基,待细胞贴壁生长融合至70%时,处理组改用成骨诱导培养基(完全培养基+50 mg·L-1VC+10 mmol·L-1β-甘油磷酸钠+0.1 μmol·L-1地塞米松)培养,对照组用完全培养基培养,每2 d换液1次。培养21 d后,吸出培养基,用150 mmol·L-1NaCl冲洗3次, 4 ℃下用70%乙醇固定1 h,室温下用2%茜素红染色10 min,倒置显微镜下观察。
1.3.6 细胞增殖情况
取第5代、第10代细胞,用胰蛋白酶消化液消化细胞制成单细胞悬液,调整细胞密度至1×104个·mL-1,接种于96孔板。以天数为单位分为8组,每组6个重复,其余6孔加入等量培养基作为对照组。接种24 h后,CCK-8法检测细胞增殖情况,用酶标仪在450 nm处测定每24 h的吸光度值,连续测量7 d,制作细胞生长曲线。
2 结果与分析
2.1 细胞形态学观察
犊牛脂肪干细胞接种后24 h已经贴壁生长,形态呈梭状逐渐展开,开始少量增殖(图1-A);48 h后细胞已经伸展为梭形、多角形,细胞数量增多(图1-B);72 h后细胞大量增殖,呈铺开生长(图1-C);96 h后细胞呈纤维细胞样,并且呈旋涡状,细胞融合达到50%左右(图1-D)。随着培养时间的增加,细胞融合度越来越高(图1-E、1-F)。
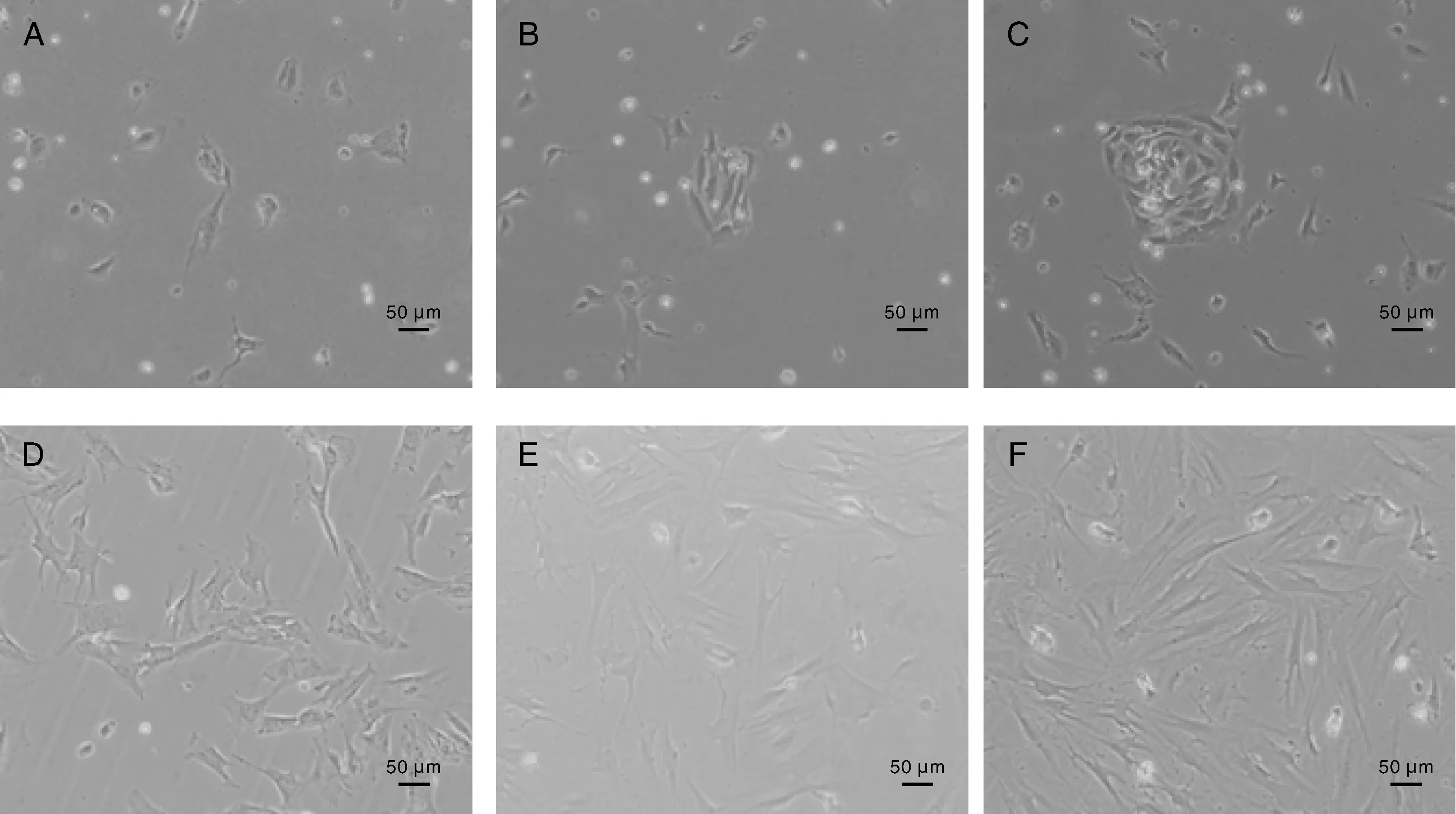
A~F分别表示细胞接种后24 、48、72、96、120、144 h时的细胞形态。A-F represented morphology of adipose-derived stem cell which were cultured 24, 48, 72, 96, 120, 144 h.图1 犊牛脂肪干细胞的形态Fig.1 Morphology of adipose-derived stem cells of calves
2.2 犊牛干细胞表面蛋白鉴定
由图2可知,经体外培养的第5代犊牛脂肪干细胞细胞核DAPI染色呈蓝色;加入大鼠抗兔Vimentin、CD34、CD44、CD90单克隆抗体后, CY3染色呈红色(图A2、C2、D2、F2),表明细胞Vimentin、CD34、CD44、CD90呈阳性表达;加入CD31、CD45单克隆抗体后,CY3未染色,表明细胞CD31、CD45呈阴性表达。
2.3 犊牛干细胞的成脂诱导分化
由图3可以看出,细胞经成脂诱导21 d后,细胞形态由长梭形逐渐变为不规则的多边形、三角形,最后变为不规则的钝圆形。细胞间及胞内出现了折光率较强的类似于脂滴样的物质(图3-C),经油红O染色后,经诱导的细胞被染成红色(图3-D)。未经诱导的细胞培养21 d后,细胞仍然呈长梭形、旋涡状生长(图3-A),油红O染色呈阴性(图3-B)。
2.4 犊牛脂肪干细胞成骨诱导分化
由图4可以看出,细胞经成骨诱导21 d后,细胞结节中心的细胞发生融合,细胞结构消失,出现明显的骨化结(图4-C);茜素红染色后,骨化结呈现暗红色(图4-D)。未经诱导的细胞培养21 d后,细胞没有发生形态上的改变,也没有堆积和产生骨结节(图4-A);茜素红染色后,细胞未出现暗红色的结节(图4-B)。
2.5 犊牛脂肪干细胞生长曲线
从图5可以看出,第5代和第10代犊牛脂肪干细胞在第1天、第2天处于生长潜伏期,第3天至第6天基本处于生长对数期,第7天后基本处于生长平台期。这说明犊牛脂肪干细胞在体外培养条件下细胞增殖比较稳定,随着细胞传代的增加,生长状态基本无异常。
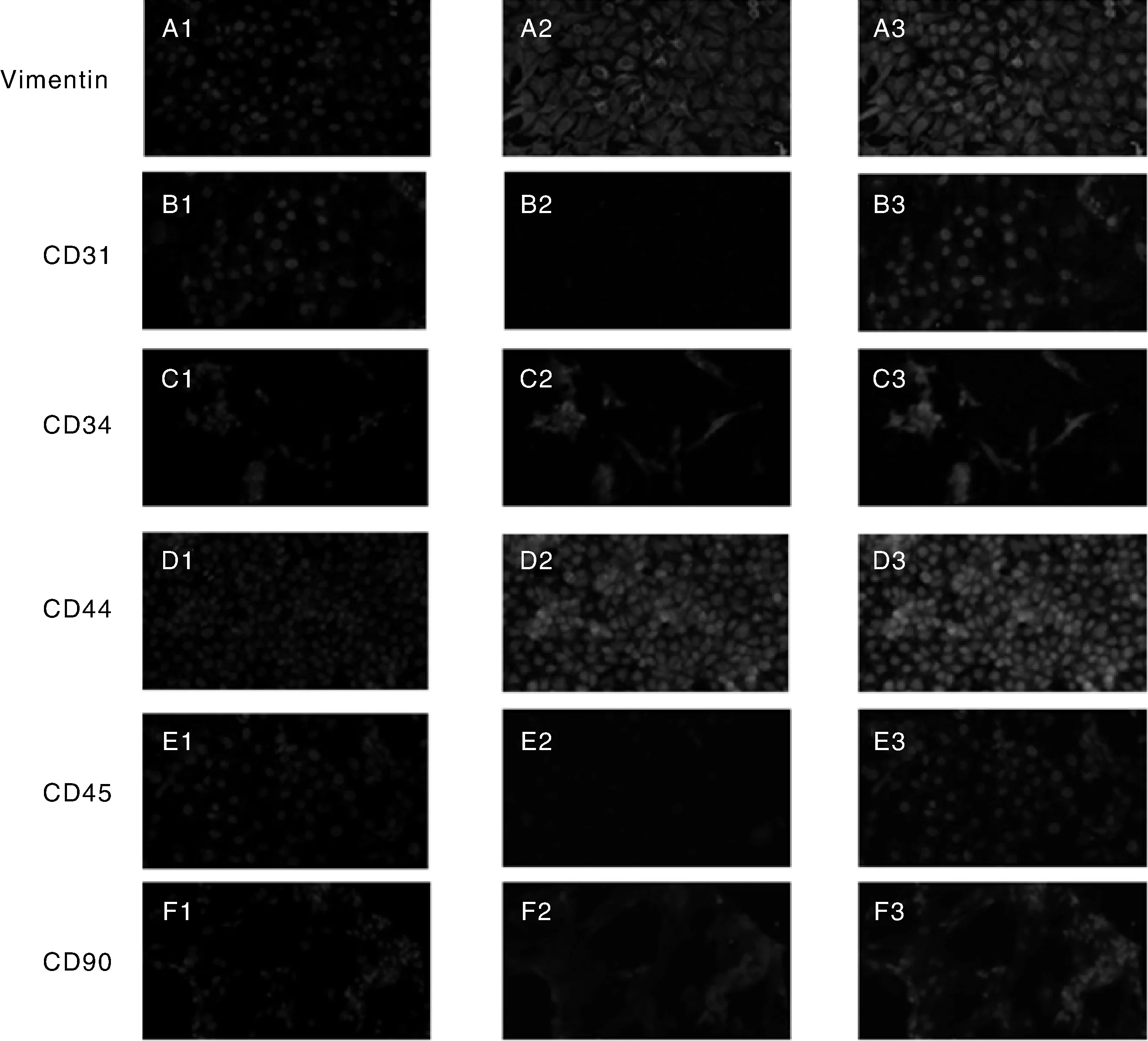
A1~F1为DAPI染色,A2~F2为CY3染色,A3~F3为DAPI复染CY3。A1-F1 represented DAPI staining, A2-F2 represented CY3 staining, A3-F3 represented DAPI redyeing CY3.图2 犊牛脂肪干细胞免疫荧光染色Fig.2 Immunofluorescent staining results of the calf ADSCs

A、B,对照组染色前、后;C、D,处理组染色前、后。A and B represented cell morphology of control group before and after Oil Red O staining, C and D represented cell morphology of experimental group before and after Oil Red O staining.图3 犊牛脂肪干细胞成脂诱导染色结果Fig.3 Adipogenic induced staining results of the calf ADSCs

A、B,对照组染色前、后;C、D,处理组染色前、后。A and B represented cell morphology of control group before and after alizarin red staining, C and D represented cell morphology of experimental group before and after alizarin red staining.图4 犊牛脂肪干细胞成骨诱导染色结果Fig.4 Osteoginic induced staining results of the calf ADSCs

图5 各代脂肪干细胞生长曲线Fig.5 Growth curves of adipose-derived stem cells of different passages
3 讨论
近些年对脂肪干细胞的研究主要集中在通过人体吸脂手术获得脂肪干细胞来进行体外培养和多向诱导分化,从而用于再生医学和美容业[13-15]。动物体脂肪干细胞研究主要集中在大鼠及兔等小动物,用于肝损伤模型及骨折模型等研究[16-17],关于奶牛等大型家畜脂肪干细胞的报道较少[18-19]。殷立恒[10]从荷斯坦犊牛腹腔大网膜和肠系膜脂肪组织中分离培养得到1种脂肪前体细胞,诱导分化为成熟脂肪细胞,并检测到脂肪前体细胞和成熟脂肪细胞中成脂相关因子的表达。张世奇[11]从荷斯坦犊牛腹腔大网膜和肠系膜脂肪组织中分离出原代脂肪细胞,通过转染PLIN1过表达腺病毒和沉默siRNA,发现PLIN1可促进甘油三酯在脂肪细胞的积累和脂滴的增多增大,同时可以抑制由NF-κB炎症信号通路引起的炎症反应。本研究从奶牛肾周获取脂肪组织,分离得到的脂肪干细胞与其他动物不同部位分离所得的脂肪干细胞具有相似的细胞形态以及生长特性。
脂肪干细胞表面的特异性蛋白尚无明确定论。2006年,国际细胞治疗协会宣布脂肪干细胞的表型是CD31-/CD34+/CD45-[20-21]。2013年,国际脂肪应用技术协会宣布新分离的脂肪干细胞表型为CD31-/CD34+/CD45-/CD235a-,而经体外培养的ADSCs表型为CD31-/CD44+/CD45-/CD73+/CD90+/CD105+[21-22]。本研究测定了犊牛脂肪干细胞Vimentin、CD31、CD34、CD44、CD45、CD90 6个蛋白。CD34是目前学术界存在广泛争议的蛋白,陈犹白等[21]提出体内的、刚分离的和体外培养初期的脂肪干细胞高表达CD34,但经体外长时间培养后,其表达逐渐降低至最后完全消失。Vimentin是主要的中间丝蛋白之一,广泛存在于各种间充质细胞及中胚层来源的细胞中,本研究测得Vimentin染色呈阳性,说明分离所得的细胞是来源于中胚层的间充质干细胞。而分离的细胞CD34、CD44、CD90呈阳性,CD31、CD45呈阴性,其表型基本符合国际细胞治疗协会最新宣布的脂肪干细胞表型,可初步证明分离的细胞是犊牛脂肪干细胞。
脂肪干细胞的多向分化能力多可通过分化为成脂细胞和成骨细胞来鉴定,肖建红等[23]研究发现,对第5代脂肪干细胞进行成脂诱导分化后,经油红O染色可见细胞内大量葡萄样的红色脂滴;张鉴清等[24]从小鼠附睾分离的脂肪干细胞经体外成脂诱导后,细胞内可见较多圆形被染的小脂滴。李玲慧等[25]从大鼠腹腔内取材,并对第3代脂肪干细胞进行成骨性诱导,28 d后经茜素红染色阳性,细胞堆积生长,可见橘红色深染的矿化结节。这与本研结果相似,证明试验分离的犊牛脂肪干细胞可以经体外诱导定向分化为脂肪细胞和成骨细胞。

