少孢节丛孢菌XJ-A1几丁质酶AO-483基因的克隆及生物学活性
贡莎莎,孟庆玲,*,乔 军,钟文强,黄运福,张国武,陈 英,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003; 2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
捕食线虫真菌(Nematophagousfung)一般分为捕食菌物、内寄生菌物、机会菌物和产毒素菌物,能捕捉、寄生、定植和产生毒素,杀死线虫,涉及到真菌界的壶菌门、接合菌门、子囊菌门、担子菌门、有丝分裂菌类和假菌界的卵菌门[1-2],种类繁多,在生物防控线虫方面拥有巨大的价值和潜力。
少孢节丛孢菌(Arthrobotrysoligospora)是一种典型的捕食线虫真菌,能够产生黏性菌网捕捉线虫。在侵染线虫过程中,少孢节丛孢菌可分泌蛋白酶、几丁质酶和胶原酶等胞外水解酶,与捕食结构共同作用从而高效地完成线虫的固定、角质层的入侵以及宿主细胞的降解等过程[3-6]。2011年,Yang等[3]对经线虫诱导产生捕食器官的少孢节丛孢菌进行基因组学分析,预测出16个具有糖苷水解酶18家族几丁质酶结构特征的几丁质酶基因[4],发现这些几丁质酶在碳源缺乏或几丁质底物存在时表达量明显上调,提示几丁质酶在少孢节丛孢菌捕食线虫的过程中可能发挥重要作用。然而,目前对少孢节丛孢菌的几丁质酶生物学功能及其作用机制尚不清楚。
本研究对少孢节丛孢菌新疆分离株几丁质酶AO-483基因进行克隆和分子特征分析,构建原核表达载体,进行原核表达重组融合蛋白;采用DNS还原糖法检测通过Ni-NAT亲和层析柱纯化的重组几丁质酶活性,并将其作用于秀丽隐杆线虫Ⅰ期和Ⅳ期幼虫以验证其生物学活性,为进一步揭示几丁质酶AO-483在少孢节丛孢菌捕食线虫过程中的作用及机制奠定基础。
1 材料与方法
1.1 菌株、试剂及培养基
少孢节丛孢菌新疆分离株(ArthrobotrysoligosporaXJ-A1)、大肠埃希菌(Escherichiacoli)DH5α菌株、大肠埃希菌BL21菌株(DE3)和pET32a(+)质粒由石河子大学预防兽医学实验室保存;反转录试剂盒、pMD19-T载体、His融合蛋白纯化柱购自日本TaKaRa公司;EZ柱式真菌RNA抽提试剂盒购自上海生物工程有限公司;透析袋购自广州东盛生物科技有限公司;鼠抗His抗体、HRP标记的羊抗鼠IgG购自北京全氏金生物技术有限公司;DNS试剂购自北京生东科技有限公司;几丁质购自上海瑞永生物科技有限公司;NGM培养基参考文献[7]配制。
1.2 几丁质酶基因AO-483cDNA的克隆及序列分析
按照RNA提取试剂盒说明书提取少孢节丛孢菌XJ-A1分离株RNA,利用反转录试剂盒反转录成cDNA,进行RT-PCR扩增。引物由Primer 5设计,由北京六合华大基因科技股份有限公司合成。上游引物F: 5′-CCGGAATTCATGCCGCCAGTCCTCCC-3′;下游引物R: 5′-CGAGCGGCCGCTTATTCCTGGGCCTCTAAGCC-3′(下划线部分分别为EcoRI和NotI酶切位点)。反应体系:PCR Mixture 8 μL,上下游引物各0.5 μL,cDNA模板2 μL,补足超纯水至20 μL。反应条件:95 ℃ 5 min;94 ℃ 40 s,63 ℃ 40 s,72 ℃ 70 s,共35个循环;72 ℃ 10 min。扩增产物经1.5%琼脂糖凝胶电泳,回收后与pMD19-T连接,转化至大肠埃希菌DH5α感受态细胞,筛选阳性克隆,提取重组质粒pT-AO483进行测序。利用在线生物分析软件对AO-483基因及其编码蛋白进行序列分析。
1.3 原核表达质粒pET32a-A0483的构建
用EcoRI和NotI分别对pMD19-AO483和pET32a(+)质粒进行双酶切,回收pET32a载体片段和AO-483目的片段,在T4 DNA 连接酶作用下16 ℃过夜连接后转化入E.coliDH5α感受态细胞中,经氨苄青霉素抗性筛选和菌液PCR验证后获得重组质粒pET-A0483。
1.4 目的蛋白的诱导表达及SDS-PAGE和Western blot鉴定
将重组质粒pET-AO483转化入大肠埃希菌BL21(DE3)感受态细胞中,取阳性克隆菌液200 μL接种于200 mL含氨苄青霉素抗性的LB培养液中,37 ℃,180 r·min-1过夜培养至D600为0.6~0.8,加入终浓度为1 mmol·L-1的诱导剂IPTG进行诱导,6 h后收集菌体,进行SDS-PAGE分析,并以小鼠抗少孢节丛孢菌多克隆血清抗体为一抗,HRP标记的羊抗小鼠IgG为二抗进行Western blot鉴定。
1.5 重组几丁质酶AO-483的纯化
将收集的菌体用细胞裂解液悬浮后反复冻融,离心收集沉淀,加10 mL 8 mol·L-1尿素后,于室温放置2 h,用Ni-NTA亲和层析柱进行纯化,然后将纯化蛋白AO-483转移至透析袋中,分别在6、4、2、1 mol·L-1尿素及去离子水中透析6~8 h,然后用蔗糖浓缩3 h后,收集透析袋中蛋白。
1.6 重组几丁质酶AO-483酶活性测定
1.6.1 N-乙酞葡萄糖胺(NAG)标准曲线的绘制
配制浓度为1 mg·mL-1的NAG标准液,准确取0、0.1、0.2、0.4、0.6、0.8 mL分别加入到10 mL的试管中,并分别补加超纯水至2 mL后加入3 mL DNS试剂。以NAG浓度为横坐标、不同浓度的NAG反应液(3个重复)在540 nm处吸光值为纵坐标绘制标准曲线。
1.6.2 重组几丁质酶AO-483活性测定
采用DNS(二硝基水杨酸)法测还原糖含量来测定重组酶活性,参照文献[8]制备胶体几丁质,参考文献[9]以胶体几丁质为底物测定酶活性。取200 μL粗酶液和200 μL胶体几丁质混匀,37 ℃反应30 min后加入600 μL DNS试剂反应,取上清200 μL于540 nm处测D值。在此反应体系下每生成1 μg NAG所需的酶量定义为1个几丁质酶活力单位。
1.6.3 重组几丁质酶AO-483作用于秀丽隐杆线虫幼虫
将制备的秀丽隐杆线虫Ⅰ期及Ⅳ期幼虫悬液[7]分别与等量的重组几丁质酶AO-483混匀,对照组将幼虫悬液分别与等量的PBS缓冲液混匀,置于37 ℃,作用0、0.5、1、6、12、24、36 h时分别取400 μL,利用 DNS试剂测定NAG含量,并通过显微镜观察重组酶作用于幼虫后其形态学变化,分析重组蛋白酶的生物学活性。
2 结果与分析
2.1 少孢节丛孢菌AO-483基因的RT-PCR扩增与克隆
利用特异性引物通过RT-PCR扩增,经琼脂糖凝胶电泳检测,目的基因AO-483大小为930 bp,与GenBank已公布的少孢节丛孢菌标准株(ATCC 24927)AO-483 cDNA大小一致(图1)。
2.2 少孢节丛孢菌几丁质酶AO-483基因及编码蛋白分析
序列分析发现(图2),AO-483基因全长930 bp,编码309个氨基酸,与少孢节丛孢菌标准株(ATCC 24927)几丁质酶AO-483基因序列同源性为96.88%,氨基酸序列同源性为97.73%。AO-483基因编码蛋白具有1个Glyco-hydro-18结构域(位于20~297位氨基酸);催化活性区域位于17~281位,其特征序列为第96~100位的GMLGG为底物结合位点,第132~140位的LDGLDLDVE为水解酶催化活性位点。此外,还有5个CKⅡ磷酸化位点(位于66~69、107~110、185~188、213~216、253~256位氨基酸),4个N端 酰基化位点(位于96~101、209~214、239~244、266~271位氨基酸),1个PCK磷酸化位点(位于113~115位氨基酸)。SWISS-MODEL分析显示(图3),几丁质酶AO-483具有典型的GH18几丁质酶三磷酸异构酶桶形结构域。
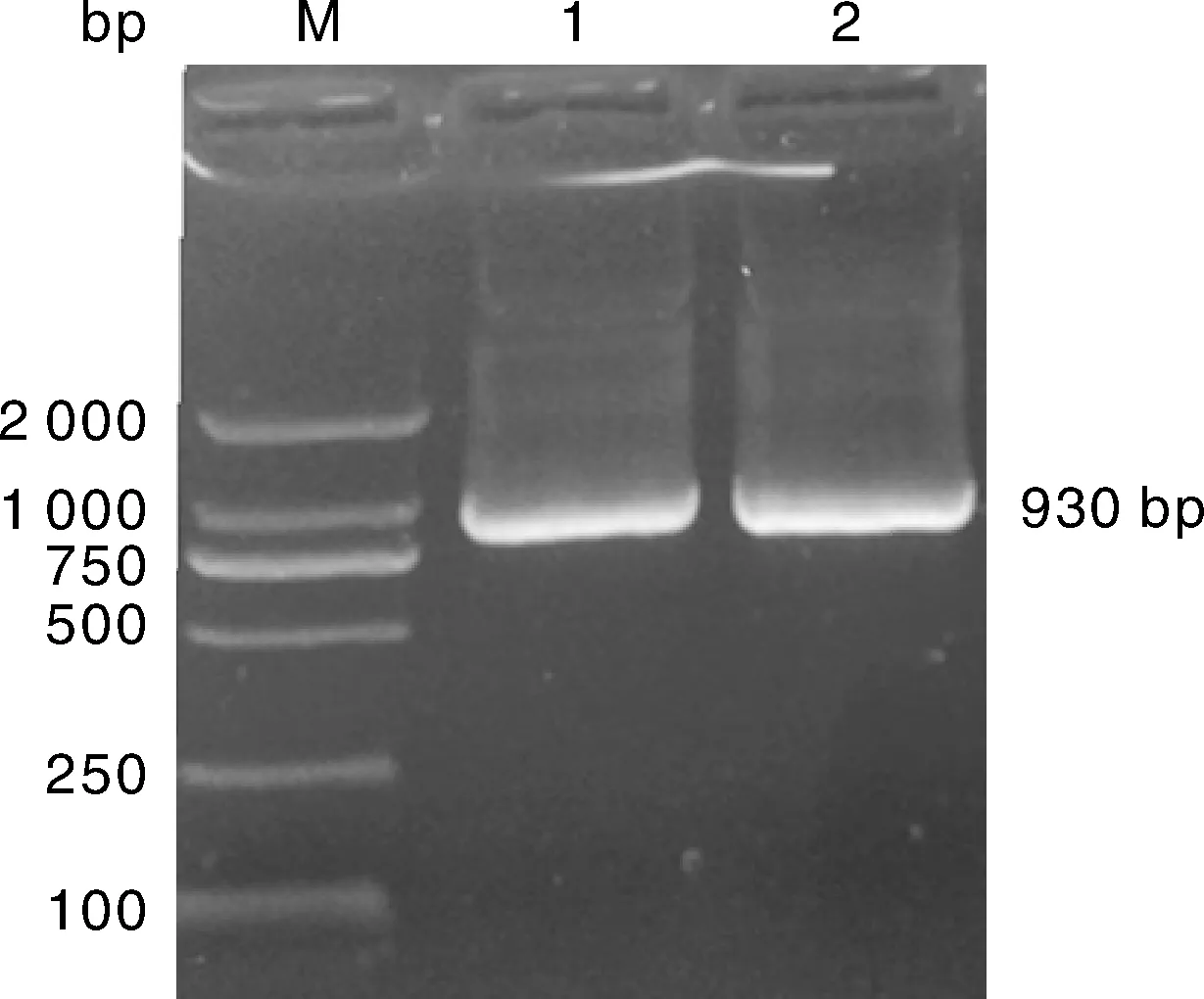
M,DL2000 DNA marker;1~3,RT-PCR扩增产物。M,DL2000 DNA marker;1-3,Amplification products of RT-PCR.图1 AO-483基因RT-PCR扩增结果Fig.1 RT-PCR product of AO-483 gene
2.3 重组质粒pET-AO483的双酶切鉴定结果
用EcoR I和NotI对重组质粒pET-AO483进行双酶切,获得5 874 bp和930 bp大小的2条核酸条带,与预期结果一致(图4),证实重组质粒pET-AO483构建成功。
2.4 重组蛋白SDS-PAGE和Western blot分析
如图5所示,表达产物经SDS-PAGE分析后,在相对分子质量约52 ku处可见特异性反应条带,分子量与预期值相同;用镍柱纯化的蛋白酶出现与预期大小一致的单一蛋白条带。Western blot分析表明,表达的重组蛋白能与小鼠抗少孢节丛孢菌多克隆血清抗体发生特异性反应。
2.5 重组几丁质酶AO-483酶活性研究
根据NAG标准曲线计算,以胶体几丁质为底物,检测重组几丁质酶AO-483活性为223.31 U·mL-1。将重组几丁质酶液分别作用于Ⅰ期幼虫和Ⅳ期幼虫,利用DNS试剂测定该反应过程中能否产生及能产生多少还原糖。结果发现,对照组未检测到还原糖产生,而试验组作用于Ⅰ期幼虫6 h后,在反应液中检测到还原糖产生,随着反应时间的增长,产生的还原糖量越多,分别为154.08、188.69、189.46、191.77 μg。作用于Ⅳ期幼虫12 h后,才能检测到还原糖产生,还原糖量也随着反应时间的增长而增多,分别为151.00、165.62、181.77 μg。
2.6 重组几丁质酶AO-483对秀丽隐杆线虫幼虫的降解作用
重组几丁质酶液作用Ⅰ期和Ⅳ期幼虫后,发现试验组Ⅰ期幼虫在6 h时全部死亡,虫体体壁皱缩破裂,至12 h时体壁组织发生降解,36 h时大部分体壁组织发生降解;对照组Ⅰ期幼虫初期未见异常,虫体继续发育,后期虫体活力下降,运动缓慢,但体壁完整(图6)。与Ⅰ期幼虫的对照组幼虫类似,试验组Ⅳ期幼虫在6 h时表现为活力下降,运动缓慢,至12 h时全部死亡,虫体体壁部分发生降解,至36 h时大部分体壁组织发生降解;对照组Ⅳ期幼虫初期未见异常,虫体继续发育,后期虫体僵直,活力下降,但体壁完整(图7)。
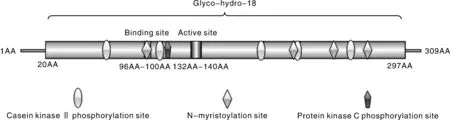
图2 AO-483基因编码蛋白结构域模式图Fig.2 Domains of AO-483 gene encoding protein
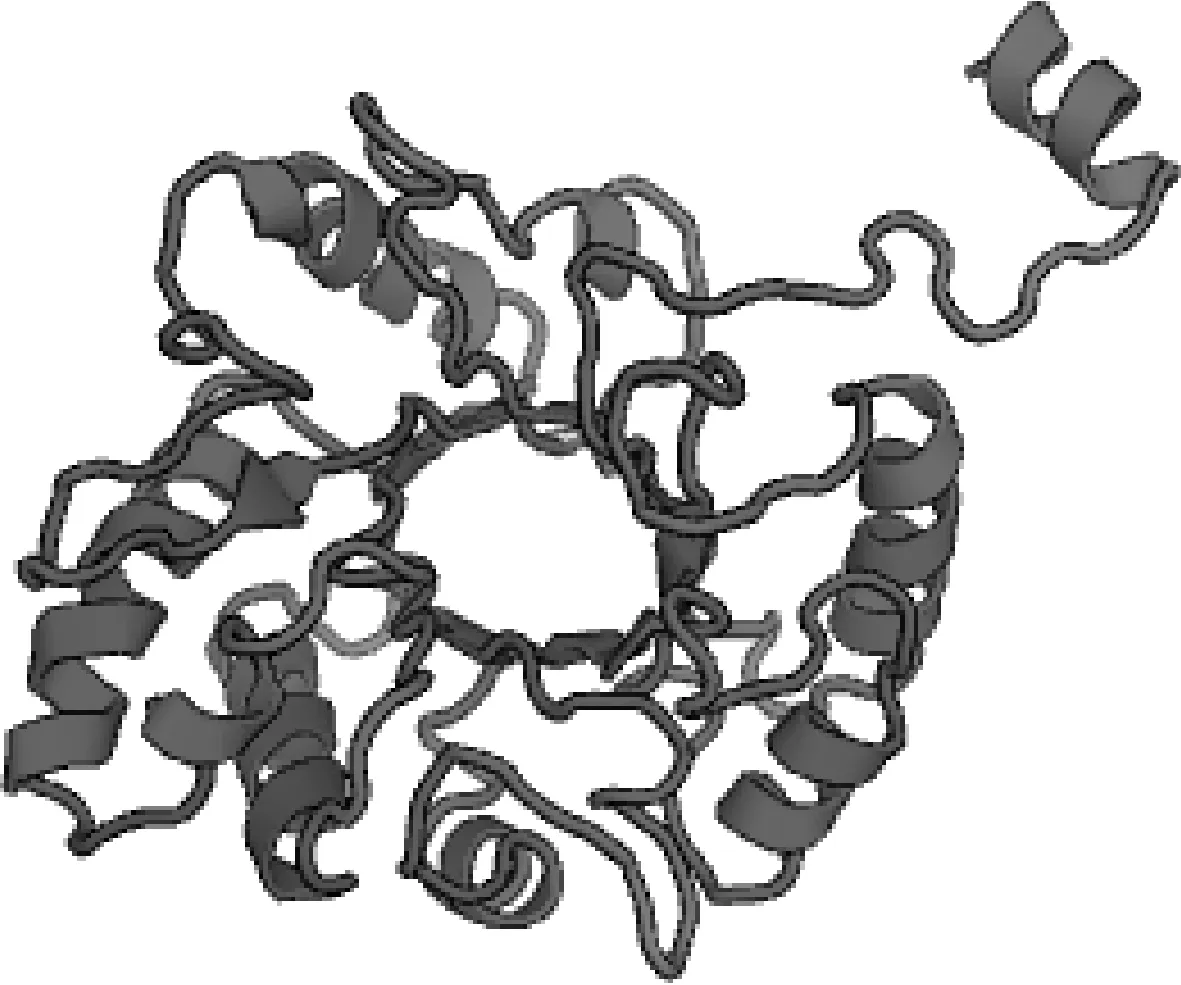
图3 AO-483基因编码蛋白三级结构预测Fig.3 Prediction of tertiary structure of AO-483 gene encoded protein

M,DL 5 000 DNA marker;1,双酶切pET-AO483重组质粒;2,pET-AO483重组质粒。M,DL 2 000 DNA marker;1,Double enzyme digestion for identification of recombinant of pET-AO483;2,Recombinant of pET-AO483.图4 重组质粒 pET-A0483双酶切鉴定Fig.4 Restriction enzyme analysis of the recombinant plasmid pET-AO483
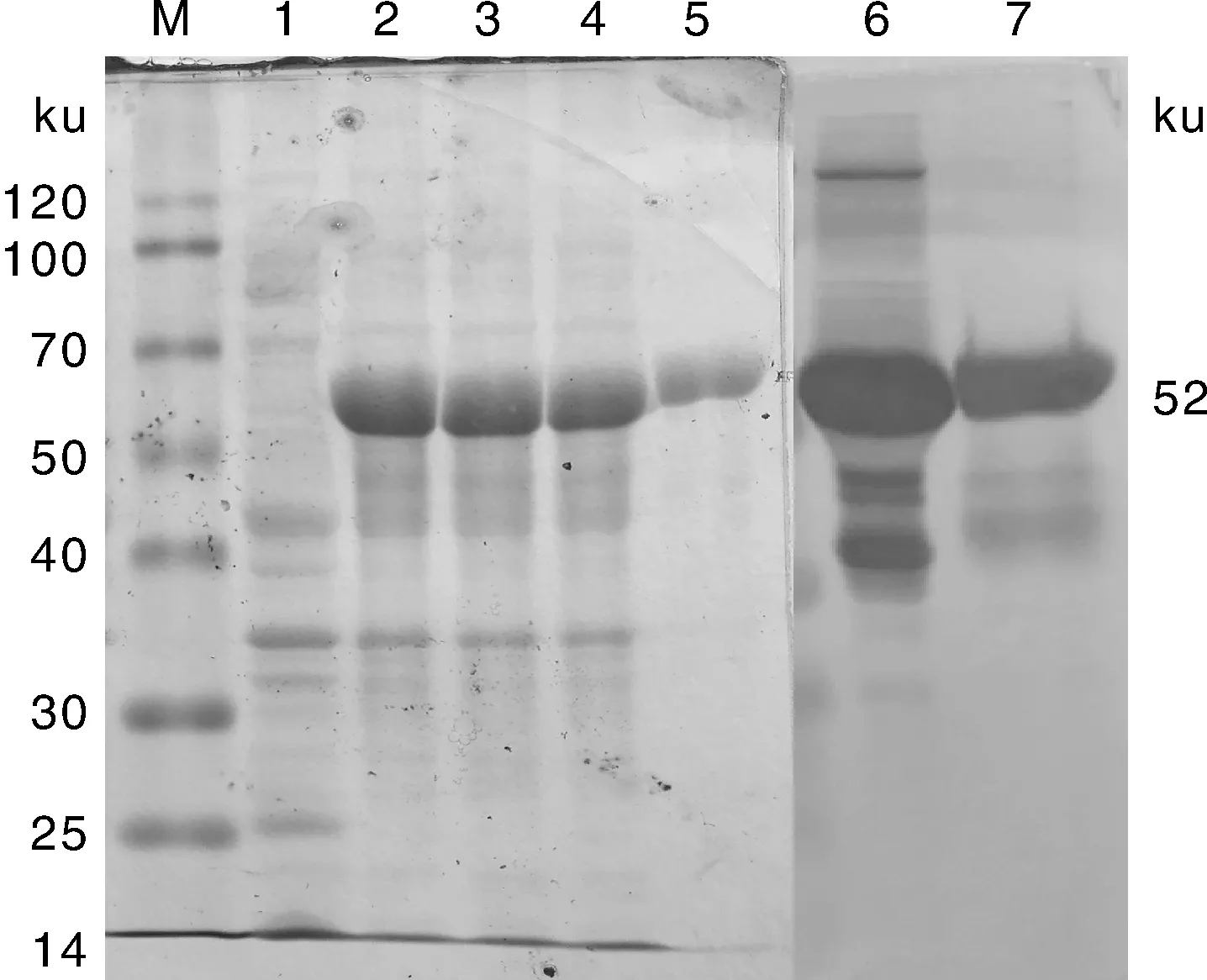
M,融合蛋白表达量; 1,pET32a空载体SDS-PAGE分析结果;2~4,重组载体pET-AO483诱导6 h SDS-PAGE分析结果;5,纯化的重组酶AO-483 SDS-PAGE分析结果;6,未纯化的重组酶AO-483 Western blot分析结果;7,纯化的重组酶AO-483 Western blot分析结果。M,Expression of fusion protein;1,SDS-PAGE analysis results of pET32a no load induced protein expression;2-4,SDS-PAGE analysis results of expression of pET-AO483 recombinant was induced for 6 h;5,SDS-PAGE analysis results of purified recombinant enzyme AO-483;6,Western blot analysis results of unpurified recombinant enzyme AO-483;7,Western blot analysis results of purified recombinant enzyme AO-483.图5 重组蛋白AO-483 SDS-PAGE和Western blot分析结果Fig.5 SDS-PAGE and Western blot analysis of recombinant protein AO-483
3 讨论
已有研究表明,作为线虫的自然天敌,捕食线虫性真菌分泌的胞外水解酶丝氨酸蛋白酶和几丁质酶在其捕食线虫过程中可能发挥着降解蛋白质和几丁质的重要作用。目前,已经从捕食线虫性真菌少孢节丛孢菌中分离鉴定的丝氨酸蛋白酶如PⅡ、Aoz1、P186等[10-11],并且对其理化性质、作用底物及降解线虫活性开展了研究,证实了在捕食线虫的过程中丝氨酸蛋白酶对角质层的侵入、宿主细胞的降解有重要的生物学作用。然而,目前对于捕食线虫性真菌几丁质酶的研究还较少。已有研究发现,通过基因组序列分析鉴定少孢节丛孢菌中有16个几丁质酶(AO-379、AO-406、AO-486、AO-492、AO-576、AO-587、AO-190、AO-483、AO-59、AO-342、AO-427、AO-31、AO-14、AO-223、AO-229和AO-801),但其结构与功能尚不清楚[4]。
几丁质酶广泛存在于微生物、植物、动物中,典型的GH18几丁质酶家族一般都含有信号肽、几丁质酶催化域、几丁质结合域及1个短的C端区域结构,部分几丁质酶还含有几丁质酶插入结构域[12-19]。本研究通过对具有强捕食活性的少孢节丛孢菌新疆分离株XJ-A1的几丁质酶AO-483基因进行分子特征分析发现,AO-483属于糖苷水解酶18家族,其含有几丁质底物结合位点GMLGG和几丁质酶催化活性位点LDGLDLDVE,与其他典型的GH18几丁质酶不完全相同。

图6 重组几丁质酶AO-483作用秀丽隐杆线虫Ⅰ期幼虫后虫体形态学观察Fig.6 Morphological observation of Caenorhabditis elegans larvae stage 1 treated by recombinant AO-483

图7 重组几丁质酶AO-483作用秀丽隐杆线虫Ⅳ期幼虫后虫体形态学观察Fig.7 Morphological observation of Caenorhabditis elegans larvae stage 4 treated by recombinant AO-483
几丁质是线虫的体壁和虫卵外壳的重要组成成分,能发挥屏障保护作用,使虫卵及线虫抵御外界不良环境。Waller等[20]认为,捕食线虫性真菌对Ⅲ期幼虫的捕获能力更强;Grant等[21]认为,捕食线虫性真菌分泌的GH18几丁质酶能够降解根结线虫Ⅰ期幼虫的角质层从而抑制其生长。本研究中,将重组AO-483酶液作用于秀丽隐杆线虫幼虫,利用DNS试剂在反应6 h的Ⅰ期幼虫反应液以及反应12 h的Ⅳ期幼虫反应液中检测到还原糖产生,表明重组酶AO-483对于线虫的几丁质成分具有降解作用。同时,通过对Ⅰ期幼虫以及Ⅳ期幼虫的形态学观察也发现,重组酶对Ⅰ期幼虫降解能力强于Ⅳ期幼虫。本研究结果提示,少孢节丛孢菌几丁质酶AO-483在降解线虫过程中发挥了重要的作用,为进一步研发动物消化道线虫病新型生物防控制剂提供了科学依据。
——一道江苏高考题的奥秘解读和拓展

