急性脑梗死患者脑微出血的危险因素分析
湛彦强,许峰,邢变枝,张海栋,段申汉,曾非,姚涛
脑微出血(cerebral microbleeds,CMBs)是因为各种原因导致脑微小血管壁损伤,血管通透性发生改变,血液从血管壁渗出,导致含铁血黄素在脑实质内沉积为主要特征的一种特殊影像学表现。CMBs通常临床无症状,其在颅脑MRI T2加权梯度回波序列(gradient-recall echo,GRE)及磁敏感加权成像 序 列(susceptibility weighted imaging,SWI)上特异性表现为直径2~5 mm,最大不超过10 mm的圆形或卵圆形低信号病灶,病灶周围无水肿现象。目前国内外研究均将SWI序列作为CMBs的标准检测序列[1]。高尿酸和高同型半胱氨酸(Homocysteine,Hcy)水平与急性脑梗死密切相关,但两者与CMBs的关系尚不确定[2]。本研究对336例急性脑梗死患者的临床和影像学资料进行回顾性分析,探索急性脑梗死患者高尿酸、高Hcy水平及其他脑血管病危险因素与CMBs的相关性及不同部位CMBs对脑梗死神经损伤的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2016年7月至2018年7月在我院就诊的急性脑梗死患者336例,其中无CMBs 154例(无CMBs组),伴CMBs 182例(CMBs组)。纳入标准:符合中国急性脑梗死诊治指南2010标准,且经头颅MRI平扫+T2Flair+DWI+ADC确诊;发病7 d内;年龄≥60岁。排除标准:出血性卒中;有明确栓子来源的脑梗死,如房颤、肿瘤细胞等;有肿瘤、血液系统疾病、血管畸形、动脉瘤等病史;伴严重基础疾病,如重症感染、肾功能衰竭、呼吸循环衰竭、内分泌疾病等;长期服用化疗药、糖皮质激素、免疫抑制剂等[3]。
1.2 方法
1.2.1 一般临床资料收集 记录与CMBs相关的人口学特征、相关危险因素和血液检验结果:高血压病、高胆固醇血症、糖尿病、心脏疾病(房颤、心肌梗死及瓣膜疾病)、抗凝剂使用史、血尿酸水平、Hcy水平及饮酒史。入院后次日清晨收集空腹血液标本,采用酶偶联测定法测定血清尿酸及Hcy水平。
1.2.2 检测仪器及方法 采用美国GE公司1.5T MRI成像仪,相关序列参数:④T1Flair加权扫描TE=25.1 ms,Tr=1 751.1 ms;④T2加权扫描 TE=92.8 ms,Tr=5 657.3 ms;④T2Flair加权扫描 TE=146.6 ms,Tr=8 400 ms;④弥散加权扫描TE=65.4ms,Tr=3 000 ms;④SWI扫描TE=40 ms,Tr=50 ms,层厚2 mm,矩阵330×390,翻转角为30º。CMBs的MRI影像学表现为点状圆形或类圆形、直径<10 mm、性质均一、周围无水肿带的信号减低区,且排除动脉留空影横断面、血管周围间隙、海绵状血管瘤、苍白球钙化及动脉粥样硬化钙化斑。
1.2.3 神经功能评估 采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)对患者神经功能受损情况进行评估,量表内容包括意识水平、凝视、视野、面瘫、上下肢运动、共济失调、感觉、语言、构音障碍和忽视,总分范围0~42分,分数越高,患者神经功能受损越严重。
1.3 统计学处理
采用SPSS 22.0统计学软件处理数据,计量资料以(x±s)表示,t检验;计数资料以率表示,χ2检验;单因素分析采用Logistic回归分析,多因素分析采用Cox比例风险回归模型;相关性采用Pearson相关分析;P<0.05为差异有统计学意义。
2 结果
2.1 2组基线资料比较
与无CMBs组相比,CMBs组尿酸和Hcy水平更高,合并高血压病、糖尿病史、高总胆固醇及既往脑卒中病史的几率均更高,差异均有统计学意义(P<0.05),见表1。
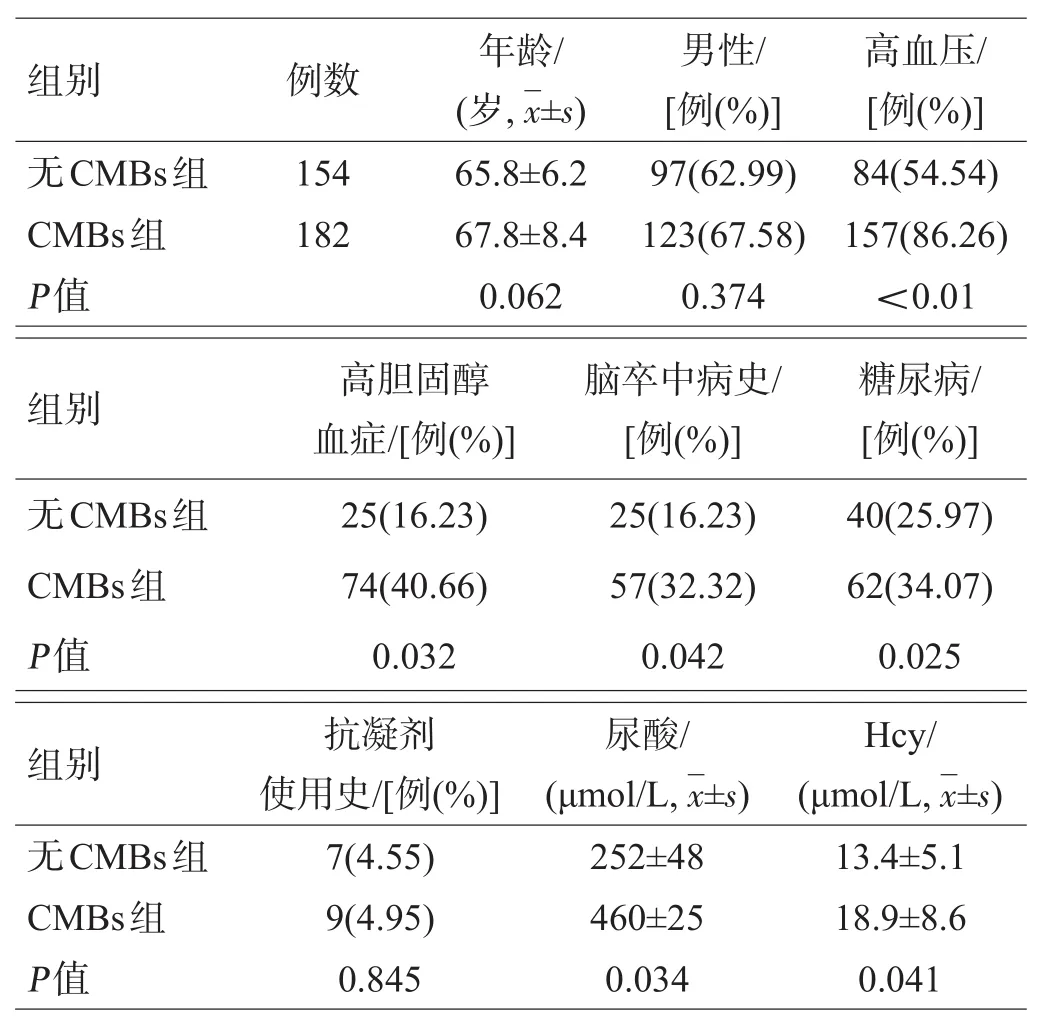
表1 2组基线资料比较
2.2 CMBs发生的单因素Logistic回归分析
Logistic回归分析结果显示,高血压、高胆固醇血症、高血糖、脑卒中病史、Hcy和尿酸水平与CMBs的发生有关(P<0.05),见表2。
2.3 CMBs发生的多因素分析
高尿酸、高Hcy、高血压、高胆固醇血症、糖尿病和卒中病史均为CMBs发生的独立预测因素,见表3。
2.4 CMBs组中不同出血部位的患者尿酸、Hcy、NIHSS评分比较
CMBs组CMBs分布于皮质37例(20.3%),皮质下区45例(24.7%),基底节区61例(33.5%),幕下39例(21.4%),差异无统计学意义(P>0.05);CMBs分布于不同部位患者的尿酸水平、Hcy水平及NIHSS评分差异无统计学意义(P>0.05),见表4、图1。
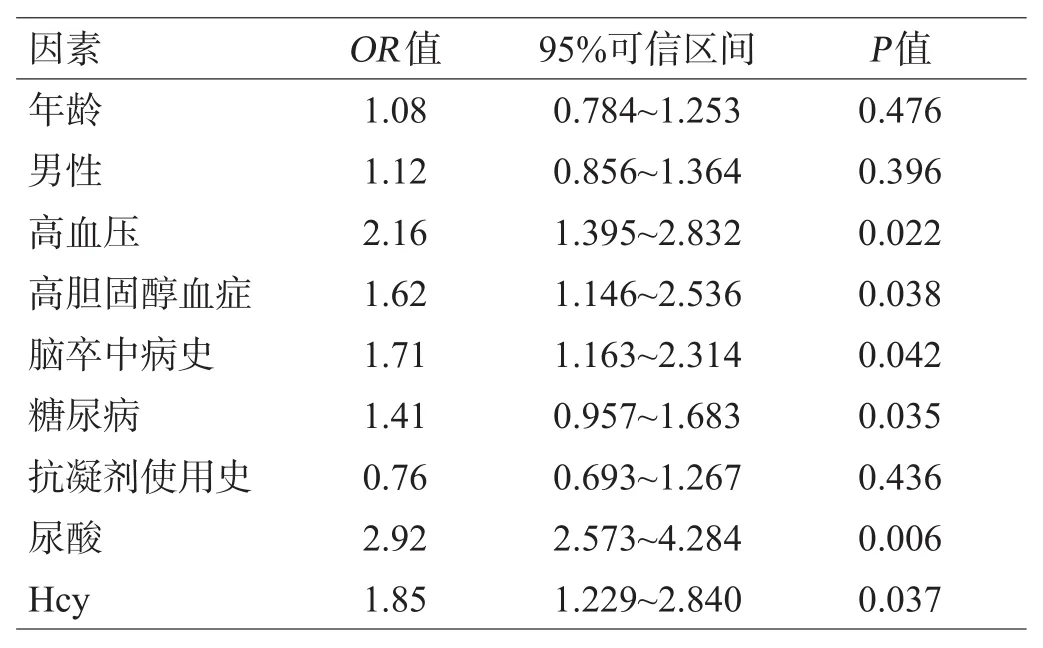
表2 CMBs单因素Logistic回归分析结果
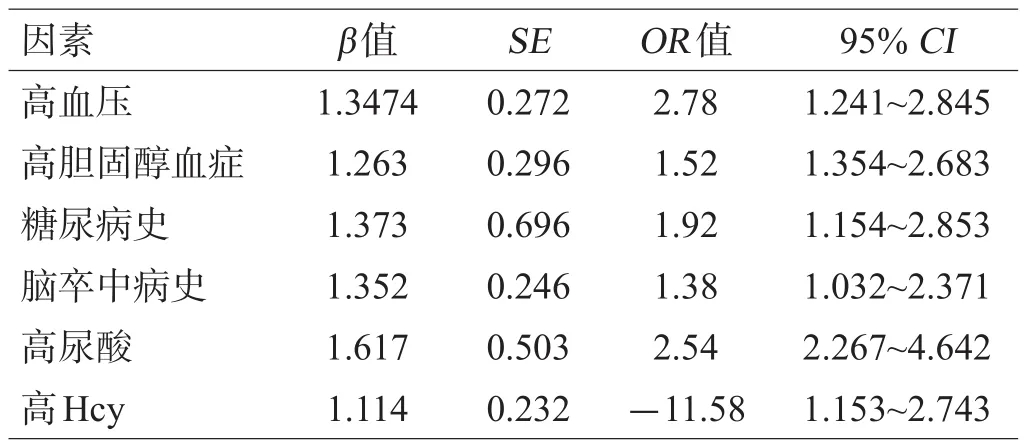
表3 CMBs发生的多因素Cox比例风险回归分析
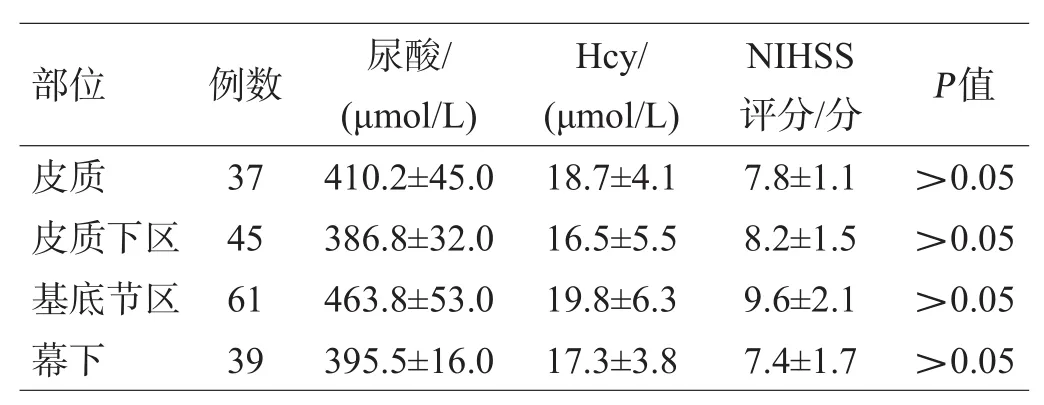
表4 不同脑区CMBs患者尿酸水平、Hcy水平及NIHSS评分比较(x±s)

图1 不同脑区CMBs典型分布的MRI影像
3 讨论
CMBs是颅内微小脑血管破裂,含铁血黄素在脑内局部沉积,MRI上相应的沉积区域由于铁的顺磁效应导致磁共振信号减低,通过磁共振晕染效应(blooming effect)来凸显微出血病灶,在MRI上显示为小圆形或类圆形低信号,而且其低信号不同于MRI血管流空效应及非出血性皮质下矿物质沉积[3],病灶周围也无水肿。最初的GRE及T2序列可检测到毫米级别的顺磁性物质,由于含铁血黄素可沉积在巨噬细胞中很多年,GRE序列评估CMBs的可靠性长期存在。SWI等核磁的新技术对CMBs病灶成像更加敏感,显著提高CMBs的检测率。
CMBs是脑小血管病的一种,是微小血管损伤程度的标志之一。有研究报道,CMBs是脑梗死继发脑出血的独立危险因素,还与共济失调、情感障碍、认知功能障碍等临床症状[4]相关。根据CMBs的病灶数量、分布部位还可进一步指导临床诊断及调整抗栓、抗凝、溶栓等治疗的强度。CMBs病因复杂多样,其发病机制仍不清楚,前比较统一的观点认为CMBs与高血压动脉粥样硬化、脑血管淀粉样变有关,但新的研究发现CMBs与内皮细胞功能障碍、炎症反应可能也存在密切关系[5]。
既往研究已证实,高血压是CMBs的独立危险因素[6]。汇萃分析结果表明高血压及糖尿病患者CMBs风险增加,但早期研究无法区分与不同脑区发生CMBs的风险。既往研究发现[7]:分布于皮质软脑膜、皮质及灰白质交界处的CMBs常与脑淀粉样血管病(cerebral amyloid angiopathy,CAA)相关;而分布于基底节、丘脑、脑干及小脑的CMBs常与高血压病相关[8]。高血压血管病、CAA、大脑常染色体显性动脉病变伴皮质下梗死和白质脑病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)等疾病中的CMBs的存在和数量也可反映小血管病变的严重程度,并能预测这些疾病的临床结果,包括痴呆症和认知能力下降的风险[9]。
本研究结果显示,CMBs组的尿酸及Hcy水平高于无CMBs组,合并高血压病、糖尿病史、高总胆固醇及卒中史的几率均更高(P<0.05);单因素Logistic回归分析结果表明,高血压、糖尿病史、高胆固醇血症、脑卒中病史、Hcy和尿酸水平与CMBs的发生有关(P<0.05);多变量分析显示,高尿酸、高Hcy、糖尿病史、脑卒中病史、高胆固醇血症和高血压均为CMBs发生的独立预测因素。既往血压或血糖控制不佳、有卒中病史或腔隙性梗死病史及高Hcy水平患者发生CMBs风险更高。
CMBs的出现可能会加速脑梗死后出血转化的进展过程,影响脑梗死后的转归,它对疾病的诊断、预后评估及治疗可能有重要的指导作用。后续需要大规模、随机对照临床研究进一步证实。

