新生儿早发李斯特菌败血症诊治分析
王颍源, 方盼盼, 刘大鹏, 张耀东, 康文清
李斯特菌病是由单核细胞增生性李斯特菌感染引起,可继发严重败血症、脑膜炎,甚至器官功能衰竭等,病情凶险,病死率高。欧美国家报道较多,甚至可出现暴发流行;我国发病率较低,主要以散发病例为主,缺乏多中心流行病学研究[1]。本文分析我院近5年收治的李斯特菌感染患儿的临床资料,旨在为围产期李斯特感染的诊治提供参考。
1 资料与方法
1.1 临床资料 选择2012年12月至2017年12月郑州大学附属儿童医院新生儿重症监护病房收治的血和(或)脑脊液培养为单核细胞增生性李斯特菌败血症患儿11例为研究对象,其中男7例,女4例;胎龄<37周(28+6~36+4)5例,>37周(37+3~39+1)6例;出生体质量1 680~3 850 g,其中<2 500 g 5例;发病日龄均<7 d,其中48 h内发病5例;住院时间2~48 d。
1.2 方法 入院后对临床可疑败血症患儿行血常规、C反应蛋白、未行抗菌药物应用前所有患儿均行2个不同部位血培养检查,诊断败血症患儿同时行脑脊液检查,同时详细记录母亲孕产史、患儿围产期情况、临床表现、实验室检查、治疗情况及随访情况。11例患儿均由外院转入,入我院前曾应用头孢菌素抗感染治疗7例,应用美洛西林2例,阿莫西林克拉维酸钾2例,入我院当天完善血培养后经验性选用抗菌药物,其中单用头孢哌酮舒巴坦1例,头孢他啶联合氨苄西林6例,单用美罗培南4例,其中8例住院期间曾应用人免疫球蛋白针。血培养报告阳性后立即将患儿进行隔离,同时停用头孢菌素,诊断化脓性脑膜炎的6例患儿病情危重均先应用美罗培南联合氨苄西林抗感染效果差,后改为美罗培南联合万古霉素抗感染治疗。单用氨苄西林治疗1例,余4例应用美罗培南联合氨苄西林抗感染治疗。
2 结果
2.1 围产期情况 11例患儿母亲中4例曾有明确进食生冷食物,5例有发热(其中2例为高热,体温38.5 ℃以上),3例有腹泻、呕吐消化道症状;剖宫产8例,顺产3例;既往有不良孕产史4例(其中2例曾先兆流产,2例既往有胎儿不明原因死亡),胎膜早破3例(均在18 h以上),羊水不同程度浑浊6例,合并围产期窒息4例,其中有2例高热产妇外院血培养为单核细胞增生性李斯特菌。
2.2 临床表现及并发症 本组患儿入院主要临床表现为发热(7例)、气促(5例)、呻吟(5例)、青紫(7例)、皮疹(3例),其中进展出现急性呼吸窘迫、严重肺部感染、大面积硬肿症、继发严重脓毒症、脓毒性休克4例,继发急性呼吸窘迫综合征1例,均行机械通气,该5例患儿中同时诊断弥散性血管内凝血3例。
2.3 实验室检查 (1)血常规+C反应蛋白:白细胞明显升高(21.4~46)×109/L 8例,2例正常或轻度增高,1例白细胞(2.78×109/L)降低,分类单核细胞比例增高(>8%)5例,余比例在正常范围,血小板明显减少(7~20)×109/L 3例,C反应蛋白均升高(>100 mg/L),有4例降钙素原明显升高(其中2例降钙素原峰值>1 μg/L)。(2)血培养11例均为单核细胞增生性李斯特菌生长,血培养时间诊断前4例采用传统血培养方法周期3~5 d,后7例在血培养报告阳性后采用基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS),周期2~3 d。(3)脑脊液11例患儿入院后均接受脑脊液检查,其中6例患儿脑脊液白细胞均不同程度增高(89~1 924)×106/L,分类以单核细胞为主,脑脊液培养同为单核细胞增生性李斯特菌4例,其中2例因早期病情危重,未行头颅影像学检查;另2例头颅MRI表现主要为侧脑室旁点片状稍短T1信号(图1)。(4)胸部X线片诊断肺炎10例,进展成“白肺”1例。
2.4 转归及随访 11例患儿治愈9例,其中脑脊液培养亦为李斯特菌的4例患儿中1例自动出院(合并颅内感染,出院时同时行机械通气,家属考虑可能预后不良自动出院,院外失访),1例死亡(为本研究诊断的第1例,患儿入院后单用头孢哌酮舒巴坦,病情急剧进展恶化,继发脓毒性休克和弥散性血管内凝血,血培养结果报告前1天死亡,后脑脊液培养亦证实为李斯特菌感染),另两例患儿经抗感染治疗后脑脊液恢复正常,头颅MRI异常信号消失,随访其均生长发育良好。
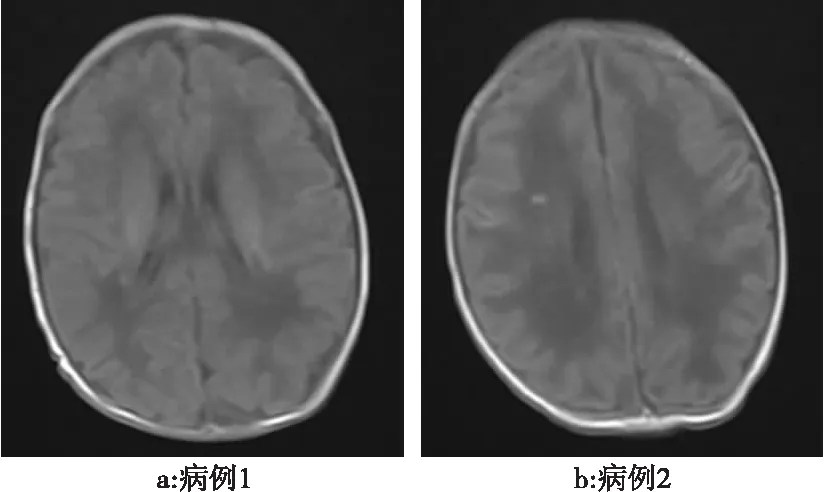
图1 单核细胞增生性李斯特菌败血症患儿头颅MRI表现
3 讨论
李斯特菌是一种革兰阳性无芽孢杆菌,广泛存在于自然环境中,因污染各种肉类、乳制品等食物而最终引起人类严重的感染;健康人群带菌率为1%~5%,李斯特菌的8个菌种中只有单核细胞增生性李斯特菌对人类致病[2]。临床表现为败血症和(或)中枢神经系统感染,伴或不伴多器官功能障碍。健康带菌者是本病的主要传播源,其传播途径主要是进食上述污染的食物及母婴垂直传播,易感人群主要为孕妇、新生儿、老年人和免疫缺陷者[3-4]。
近年来,我国围生期李斯特菌感染开始受到临床关注,主要因为其不仅可以导致不良的妊娠结局如孕期感染、流产、死胎,而且因为感染致新生儿致残,甚至死亡的病例占一定比例。查阅国内外文献,可大致总结本病围产期的高危因素有母亲围产期进食生冷食物或冰箱宿食、既往有不良孕产史如不明原因流产、死产、早产或有新生儿早期感染者、围产期有呼吸道或消化道感染症状、胎膜早破时间>18 h、有围产期窒息病史及患儿为早产儿[5-6]。本组所有患儿母亲围产期均合并有至少1种及以上上述感染相关的高危因素。
新生儿李斯特菌败血症亦分为早发型败血症和晚发型败血症,早发型败血症,多由胎盘垂直传播、宫内感染所致;主要表现为发热,气促,呻吟、青紫等表现,进展出现急性呼吸窘迫、严重肺部感染、大面积硬肿症,进一步可导致脓毒症,并发脑膜炎,还可导致脓毒性休克、弥散性血管内凝血等,如未及时诊治死亡率可达到100%,如得到及时有效诊治则致死率为20%~50%[7];而晚发型病例合并脑膜炎多见,主要表现为拒奶、哭闹、呕吐、高热、易激惹;虽致死率较早发型明显下降,但致残率较高,但致残率较高,文献报道合并脑膜炎的患儿中临床治愈存活婴儿约40%留有严重神经系统后遗症,包括脑性瘫痪、癫痫、脑积水、神经性耳聋及听力障碍等[8]。本组患儿均属于早发型败血症范畴,但本组患儿早产及低出生体重儿比例不高,临床表现亦主要为感染的常见临床表现,无明显特异性,但合并脑膜炎比例高(6例),发生率高于国内外报道[5,9],可能与患儿早期感染院外治疗时感染未得到有效控制有关,但治愈患儿未见后遗症。
目前李斯特败血症的确诊仍依赖于细菌培养,但体外细菌培养的阳性率偏低,故目前国内新生儿李斯特菌实际感染的患儿数远大于临床确诊的病例数[10],此外由于早发型败血症患儿病情往往凶险,抢救性治疗的时间短,李斯特菌具有低温增殖性,在常温培养条件下血培养阳性报告时间需3~5 d,同期其他新生儿败血症血培养阳性报告时间1~3 d,所以早期明确病原菌有一定难度,因此对于重症患儿等待微生物报告之前,应注意对每例患儿的临床表现、体征和感染指标均实施动态监测,认真分析患儿血常规及脑脊液特点,结合脑脊液及血常规中单核细胞比例的高低大致判断,并尽早确诊感染给予经验性的抗感染及支持治疗;同时注意反复详细询问产妇围产期病史,甚至尽早建议有高危因素的产妇送检血常规及血培养;本组前4例确诊患儿均采用常规血培养技术,余7例患儿血培养报告阳性后行MALDI-TOF MS,比传统血培养明确菌种提前1~2 d,MALDI-TOF MS具有操作简单、快速、自动化程度高、高通量的特点[11],为临床治疗赢得宝贵时间,如本组接受传统血培养明确诊断的患儿有1例死亡,而接受MALDI-TOF MS的患儿均临床治愈,笔者认为该方法可以积极推广。
对于单核细胞增生李斯特菌感染目前国内外最常用的药物是氨苄西林、青霉素和阿莫西林,但是青霉素耐药率高,另国内已有氨苄西林耐药报道[7]。如对青霉素过敏者可选用氨基糖苷类、红霉素、万古霉素等。因头孢菌素不能与李斯特菌细胞膜上的青霉素结合蛋白3结合,故李斯特菌对头孢菌素天然耐药[12]。虽针对李斯特菌并不主张首选美罗培南,但美罗培南在体外对李斯特菌有很强的灭菌作用,且临床上应用美罗培南成功治疗李斯特菌感染的病例报道相对较多[13]。本组首例确诊患儿入院后应用三代头孢菌素,在等待血培养过程中虽出现了典型的皮疹,感染进展并出现弥漫性血管内凝血,但由于认识的不足,血培养及脑脊液培养报告之前即迅速死亡;之后本组余患儿有感染的临床表现,我们在治疗中把李斯特菌作为考虑覆盖的病原菌,入院采取三代头孢菌素联合氨苄西林等抗感染,均最终治愈,其中本组有10例均应用过美罗培南,其中6例患儿在应用氨苄西林后病情未得到控制,后调整为美罗培南联合万古霉素,主要与其感染重,且合并颅内感染有关;本组仅1例单用氨苄西林治愈,另4例应用美罗培南联合氨苄西林最终治愈,本组患儿治疗过程中选用抗菌药物级别较高,主要与患儿感染后全身炎症反应启动临床症状重,合并脑膜炎比例高有关;国内外报道李斯特菌感染死亡率在20%[14],本研究死亡1例,死亡率在10%,但机械通气下放弃1例,可能实际死亡率与国内外报道一致;目前导致围产期严重感染的无乳链球菌及李斯特菌,虽细菌耐药率低,但导致严重后遗症甚至死亡的病例时有发生,但此类危重感染的控制关键是抗菌药物应用的时间要早,在患儿全身炎症反应启动后应用任何高级别的抗菌药物可能都收效甚微;因此对于早期新生儿的感染病例病原菌尚未明确的疑似病例,青霉素及氨苄青霉素仍应作为临床首选药物尽早单独或联合使用,这一点仍应为所有围产期工作人员认识到;而对于氨苄西林不敏感李斯特菌感染病例的药物选择及美罗培南对李斯特菌的疗效尚需进一步研究。
综上所述,新生儿李斯特菌败血症病情较重,且早发型败血症多见,从事围产工作的医护人员应提高对李斯特菌感染的认识,提高警惕,对相关病患积极行血和脑脊液培养,尽早明确病原菌,同时重视并发症,争取做到早诊断、及时有效的治疗,努力降低感染病患的致残率和病死率。

