人胎盘来源间充质干细胞对T淋巴细胞分泌白细胞介素-4和γ干扰素影响的实验研究
张莉, 吴素琴, 孙晓
间充质干细胞具有自我更新和多向分化的潜能,但由于间充质干细胞主要来源于骨髓,成人骨髓中间充质干细胞含量又比较低,因此来源在一定程度上受限。人胎盘来源间充质干细胞的发现,及时有效的弥补了间充质干细胞来源受限的缺点。研究发现,人胎盘来源间充质干细胞与骨髓来源的间充质干细胞具有很多相似的生物学特性,同时也存在很多特有的生物学特性[1-3]。急性移植物抗宿主病发生在器官移植后,是移植物中的免疫细胞对宿主的组织抗原产生免疫应答并引起组织损伤的一种疾病。研究发现,如果去除骨髓中的T细胞,则可避免急性移植物抗宿主病的发生[1-3]。因此,可推论T细胞在急性移植物抗宿主病的发生中起重要作用。
本研究采用体外实验的方式,将人胎盘来源间充质干细胞与不同来源的T淋巴细胞混合共培养的方法,观察人胎盘来源间充质干细胞对活化的T淋巴细胞分泌白细胞介素-4(interleukin-4,IL-4)、γ干扰素(interferon-γ,IFN-γ)能力的影响,推测人胎盘来源间充质干细胞应用于临床多种疾病治疗的可能性。
1 材料与方法
1.1 细胞来源 人胎盘来源间充质干细胞分离自人源胎盘组织,胎盘组织采集于沈阳市妇婴医院;人T淋巴细胞,分离自本院健康志愿者,均取得受试对象同意。培养条件:含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养液,5%CO2。
1.2 实验试剂 RPMI-1640培养液、MesencultTM培养液(海克隆公司);胎牛血清(杭州四季青公司);IL-4、IFN-γ检测试剂盒(武汉优尔生商贸有限公司)。
1.3 仪器 二氧化碳培养箱、酶标仪(Thermo公司);生物安全柜(上海力申公司);高压蒸汽灭菌器(日本三洋公司);恒温水浴振荡器(常州国华仪器设备厂)。
1.4 实验方法
1.4.1 人胎盘来源间充质干细胞分离 无菌条件下,于沈阳市妇婴医院产科手术室内,无菌切取剖宫产后产妇胎盘的胎儿蜕膜侧胎盘组织(胎盘来源均为足月剖宫产胎儿,且征得孕母同意)。迅速放入4 ℃冰盒内,转移至细胞培养室生物安全柜中,以磷酸盐缓冲液充分冲洗,将残血洗干净,然后用剪刀将组织剪成约1 mm×1 mm×1 mm。加入0.25%胰蛋白酶,37 ℃恒温水浴振荡器中消化5 min,消化终止后,以200目无菌滤网过滤,收集滤过液,红细胞裂解液裂解红细胞,磷酸盐缓冲液洗涤3次,接种于25 cm2的细胞培养瓶中,培养基MesencultTM(含1%双抗,5 μg/L碱性成纤维生长因子,10%FBS),37 ℃,5%CO2饱和湿度条件下静置培养。
1.4.2 人T淋巴细胞培养 经肝素抗凝的外周血采集自本院健康志愿者,采用淋巴细胞分离液(Ficoll,1.077 kg/L)行密度梯度离心分离法分离外周血单个核细胞。再取分离的外周血单个核细胞注入T细胞尼龙毛柱,37 ℃下孵育1 h,用RPMI-1640培养基冲洗出非黏附细胞即主要为T淋巴细胞,培养条件:RPMI-1640培养液(含1%双抗,10%FBS)37 ℃,5%CO2饱和湿度条件下静置培养。细胞呈悬浮生长状态。
1.4.3 人胎盘来源间充质干细胞与T细胞共培养
1.4.3.1 混合淋巴细胞培养(mixed lymphocyte culture,MLC)体系制备 无菌采集甲、乙两个健康人外周血,分别提取、分离T淋巴细胞,以1 mg/L的植物血凝素刺激,然后将甲、乙两个来源的T淋巴细胞等比例混合,即为MLC体系,也是后续实验中的靶细胞。
1.4.3.2 共培养 首先将取自胎盘的胎儿蜕膜侧人源间充质干细胞以25 μg/L丝裂霉素处理,37 ℃水浴中处理30 min,以抑制过度分化,此即效应细胞。然后按照效靶细胞比为1∶5的比例混合,接种于96孔培养板中,进行培养。
1.5 分组及干预方法 根据细胞的干预因素不同,将细胞分为4组:同源T细胞Ⅰ组、同源T细胞Ⅱ组、共培养组、阳性对照组,每组接种10孔。同源T细胞Ⅰ组:为来源于健康人甲外周血的T淋巴细胞。培养72 h。同源T细胞Ⅱ组:为来源于健康人乙外周血的T淋巴细胞。培养72 h。共培养组:为胎盘间充质干细胞与MLC体系中T细胞比例1∶5混合的共同培养体系。培养72 h。阳性对照组:为甲、乙两个健康人来源等比例混合的T淋巴细胞,即MLC体系。培养72 h。
1.6 观察指标 培养72 h后,平板离心机离心96孔培养板(1 000 r/min,离心5 min),收集培养上清液。采用ELISA法检测各孔细胞培养上清液中IL-4、IFN-γ浓度,操作步骤严格按照试剂盒说明书进行。
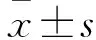
2 结果
各组细胞培养上清液中IL-4和IFN-γ浓度比较见表1。同源T细胞Ⅰ、Ⅱ组组间细胞培养上清液中IL-4和IFN-γ比较差异无统计学意义(P>0.05);与同源T细胞Ⅰ、Ⅱ组比较,共培养组和阳性对照组细胞培养上清液中IL-4和IFN-γ浓度显著升高,差异有统计学意义(P<0.01);与共培养组比较,阳性对照组细胞培养上清液中IL-4浓度显著升高,IFN-γ浓度显著降低,差异有统计学意义(P<0.01)。
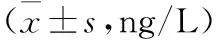
表1 各组细胞培养上清液中IL-4和IFN-γ浓度比较
注:与同源T细胞Ⅰ组比较,aP<0.01;与同源T细胞Ⅱ组比较,bP<0.01;与共培养组比较,cP<0.01。
3 讨论
混合淋巴细胞反应又称混合淋巴细胞培养,是指两个无关个体、功能正常的淋巴细胞在体外混合培养时,由于HLA Ⅱ类抗原中D和DP抗原不同,可相互刺激对方的T细胞发生增殖。增殖程度的大小,可反映两个个体间HLA抗原差异的大小[4]。
人胎盘来源间充质干细胞生物活性与骨髓间充质干细胞高度相似[5],可在体外培养,具有强大的向多种组织分化的特性,在适当的条件下可被诱导分化为韧带细胞、骨骼肌细胞、心肌细胞、胰腺细胞、肝脏细胞等[6-7],可用于糖尿病、心血管系统疾病、肿瘤及自身免疫性疾病等疾病的治疗[8]。
目前关于人胎盘来源间充质干细胞对T细胞分化作用的研究较少,有研究报道人胎盘来源间充质干细胞能抑制T淋巴细胞增殖[9-12],能诱导人外周血单个核细胞CD4+CD25+Fop3+Treg细胞的增殖[13],还能诱导CD3、CD28活化的人外周血单个核细胞Tr1细胞增殖[14],尚未见报道其对Th1/Th2平衡的明确研究。本研究采用人胎盘来源间充质干细胞与不同健康人T淋巴细胞共培养的方法,观察异体T淋巴细胞分泌IL-4和IFN-γ情况以及人胎盘来源间充质干细胞对MLC体系中T淋巴细胞分泌IL-4和IFN-γ能力的影响。结果显示:同源T细胞Ⅰ、Ⅱ组分泌IL-4和IFN-γ的能力均较低,但混合培养后,上清液中IL-4和IFN-γ浓度均显著升高,这是因为不同来源的T细胞相互刺激,导致T细胞发生增殖,从而引起IL-4和IFN-γ分泌量增多。而共培养组细胞培养上清液中IL-4浓度较阳性对照组显著降低,IFN-γ浓度显著升高,提示我们,人胎盘来源间充质干细胞可抑制活化的T淋巴细胞分泌IL-4的能力、促进IFN-γ的能力。以往研究表明,IFN-γ主要由Th1型细胞分泌,而IL-4主要由Th2型细胞分泌[15]。由IL-4和IFN-γ的浓度,可以推测,人胎盘来源间充质干细胞具有促进Th1/Th2细胞的平衡向Th1漂移。Th1细胞分泌的细胞因子主要介导细胞免疫应答,而Th2细胞分泌的细胞因子主要介导体液免疫应答。健康状态下机体Th1/Th2处于平衡状态,该研究对于人胎盘来源间充质干细胞应用于临床疾病的免疫调节作用提供了理论基础,对于Th2细胞比例升高,可以应用人胎盘来源间充质干细胞促进其向Th1细胞漂移。
综上所述,人胎盘来源间充质干细胞具有调节T淋巴细胞分泌细胞因子的功能,同时具有促进Th0向Th1细胞分化的作用。

