银染聚丙烯酰胺凝胶电泳技术体系的优化
王露露,刘欣婷,周 涛,王 娟,贾东海,李 强,侯献飞,石必显,顾元国,兰海燕
(1.新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046;2.新疆农业科学院经济作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】按分子质量大小分离DNA的凝胶电泳技术,已经发展成为一种分析鉴定DNA分子的重要实验手段。目前分离、鉴定和纯化DNA片段的最简便的方法主要为琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)[1]。二者相比,琼脂糖凝胶电泳以水平装置在强度和方向恒定的电场下电泳,因分离DNA片段的范围较广、操作简单、耗时短而被广泛使用,但无法分辨质量差异小的DNA片段;而PAGE采用垂直电泳装置,具有极高分辨率,长度相差1 bp或质量相差0.1%的DNA都可以彼此分离,但制备和操作较麻烦[2, 3]。PAGE孔径的大小可通过控制丙烯酰胺(Acrylamide,Acr)单体和甲叉双丙烯酰胺(Bisacrylamide,Bis)交联剂的比例来调节,满足不同分子量物质的分离要求[1]。1959年,Raymond和Weintraub将聚丙烯酰胺交联链作为电泳支持介质[4],经不断改良,使其具有热稳定、分辨率高、上样量少、不易扩散、灵敏度高等优点[5, 6],如今聚丙烯酰胺凝胶作为电中性的介质被广泛应用于分离、鉴定、纯化DNA和小分子多肽,是遗传图谱构建、基因定位、种子活力测定等遗传育种研究的重要手段[7],特别是在 SSR、AFLP、SNP、RAPD、RFLP 等分子标记以及 mRNA差异显示研究中具有不可替代的作用[8, 9]。但 PAGE 技术包括凝胶制备、电泳分离、染色显影等过程,操作步骤繁琐复杂,费时费工,限制了大规模分子标记分析的效率,且实验常出现条带不整齐、不清晰、背景太深、胶破裂、有气泡等问题[10]。【前人研究进展】前期对PAGE实验的探究,大多集中在银染方法的改良[11]、确定Acr和Bis的配比、最佳凝胶浓度及电泳条件等方面[10],对实验中具体问题的探讨涉及较少。孟菲等[12]研究表明,固定液中的乙醇可清洗凝胶上残留的杂质,提高凝胶的清晰度;乙酸可防止核酸分子从凝胶中脱离,但乙酸体积比在0.4%~3.0%之间时对凝胶显色结果影响不大。【本研究切入点】银染聚丙烯酰胺凝胶电泳(PAGE)主要用于小片段DNA的分离,具有提高分辨率的显著效果,但此技术在实验过程中受到很多因素干扰,常导致实验结果难以分析。研究在前期对甘蓝型油菜基因组DNA PCR产物进行银染PAGE分析时发现,电泳过程中经常出现染色较深、电泳条带不清晰不整齐、条带弥散、胶体有气泡等问题。研究银染聚丙烯胺凝胶电泳技术体系的优化。【拟解决的问题】对银染PAGE的条件进行优化,并提出相应的改进方法,以获得凝胶背景浅、条带清晰的结果,为相关实验提供借鉴及技术支持。
1 材料与方法
1.1 材 料
甘蓝型油菜(BrassicanapusL.)由新疆农业科学院经济作物研究所种植于试验大田中,待苗长出3~6片真叶时,取新鲜幼嫩的3片真叶,提取植物基因组DNA。根据表1的5对引物进行PCR反应。表1
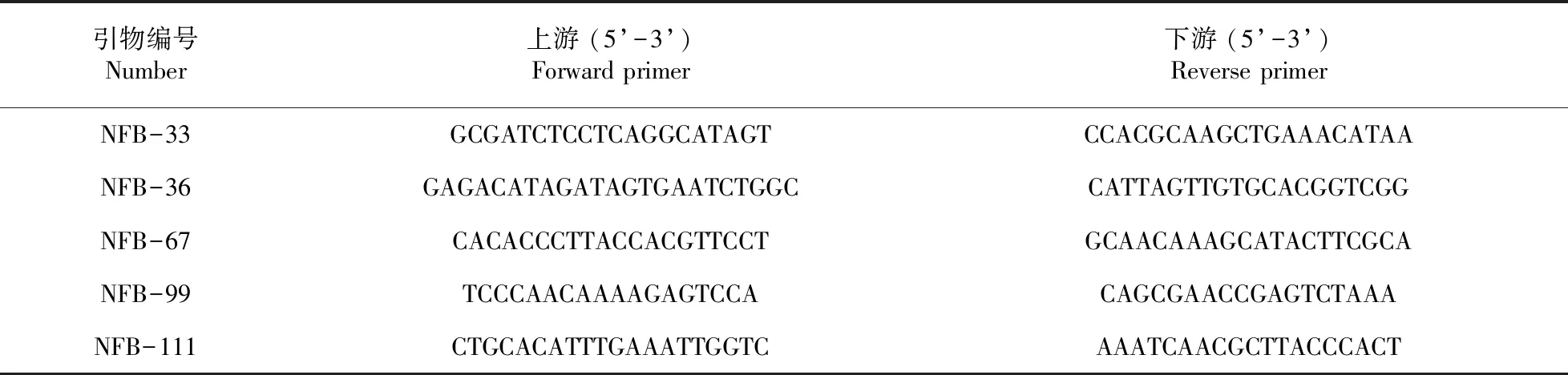
表1 油菜PCR引物Table 1 Seedrape varieties PCR primers
1.2 方 法
1.2.1 非变性PAGE胶的制备
6%聚丙烯酰胺凝胶的制备:5×TBE 5 mL,30% Acr-Bis(Acr 29 g,Bis 1 g,定容至100 mL)6.65 mL,N,N,N',N'-四甲基乙二胺(N,N,N',N'-Tetramethylethylenediamine,TEMED)15 μL,10%过硫酸铵(Ammonium persulphate,APS;0.1 g APS定容到1 mL)375 μL,ddH2O 12.75 mL。将混匀后的试剂迅速倒入玻璃板中间[面积105×185( mm)],胶液溢出短板即可,小心插入样品梳。室温下放置30 min,待胶完全凝固后再进行后续实验。
1.2.2 样品制备
油菜基因组DNA PCR扩增产物与上样缓冲液(5×TBE:三羟甲基氨基甲烷(Trizma base)54 g,硼酸(Boric acid)27.5 g,乙二胺四乙酸二钠盐二水(EDTA-2H2O-Na2)3.72 g,定容至1 000 mL)混合。在电泳槽中加入1×TBE,两块胶板中间缓冲液面超出短板即可,外槽加入适量的1×TBE。拔出样品梳,驱赶出点样孔内的气泡后点样。
1.2.3 电 泳
实验使用北京六一仪器厂生产的DYY-8C电泳仪或BIO-RAD公司生产的PowerPac Universal TM Power Supply电泳仪,设定恒压200 V。室温或冰浴电泳65 min。
1.2.4 染 色
固定和渗透:电泳结束后,首先将胶块置于固定液(无水乙醇50 mL,冰乙酸2.5 mL,定容至500 mL)中固定,摇床上缓慢摇动13 min;随后,将固定好的胶块用双蒸水漂洗3遍后加入渗透液(硝酸银1 g,定容至400 mL),摇床上缓慢摇动13 min;最后,倒去渗透液并用双蒸水漂洗3遍后。
显色:(1)不同甲醛浓度显色液的配制:5.5 g NaOH用双蒸水定容至400 mL,分别加入5 mL、4 mL和5 μL甲醛,使其浓度为1.25%、1%和0.00125%(v/v)。(2)不同NaOH浓度显色液的配制:分别称取5 g、4.5 g、4 g和3.5 g NaOH用双蒸水定容至400 mL,即其浓度为1.25%、1.125%、1%、0.875%(w/v),加入4 mL甲醛(1%)进行实验。将凝胶分别放入上述显色液,在摇床上缓慢摇动,直至条带清晰可见。
1.2.5 凝胶照像
倒去显色液,用双蒸水冲洗胶块2~3遍,放于胶片灯下观察记录数据。
2 结果与分析
2.1 甲醛用量对条带显色的影响
在银染过程中,Ag+与核酸形成稳定复合物,甲醛将复合物中的Ag+还原成银颗粒,使 DNA条带呈现黑褐色。基于前期实验结果不理想,本研究探究了甲醛用量(1.25%、1%及0.001 25%)对条带显色的影响。结果表明,当甲醛用量为1.25%时,显色快,染色时间短,但背景颜色深,部分黑褐色区域覆盖面积过大(图1A),无法判断该区域是否存在扩增条带。当用量为0.001 25%时,甲醛过低,即使长时间染色,目的条带依然模糊(图1B)。当甲醛用量为1%时,染色时间短,条带清晰(图1C),是较为合适的甲醛浓度。图1
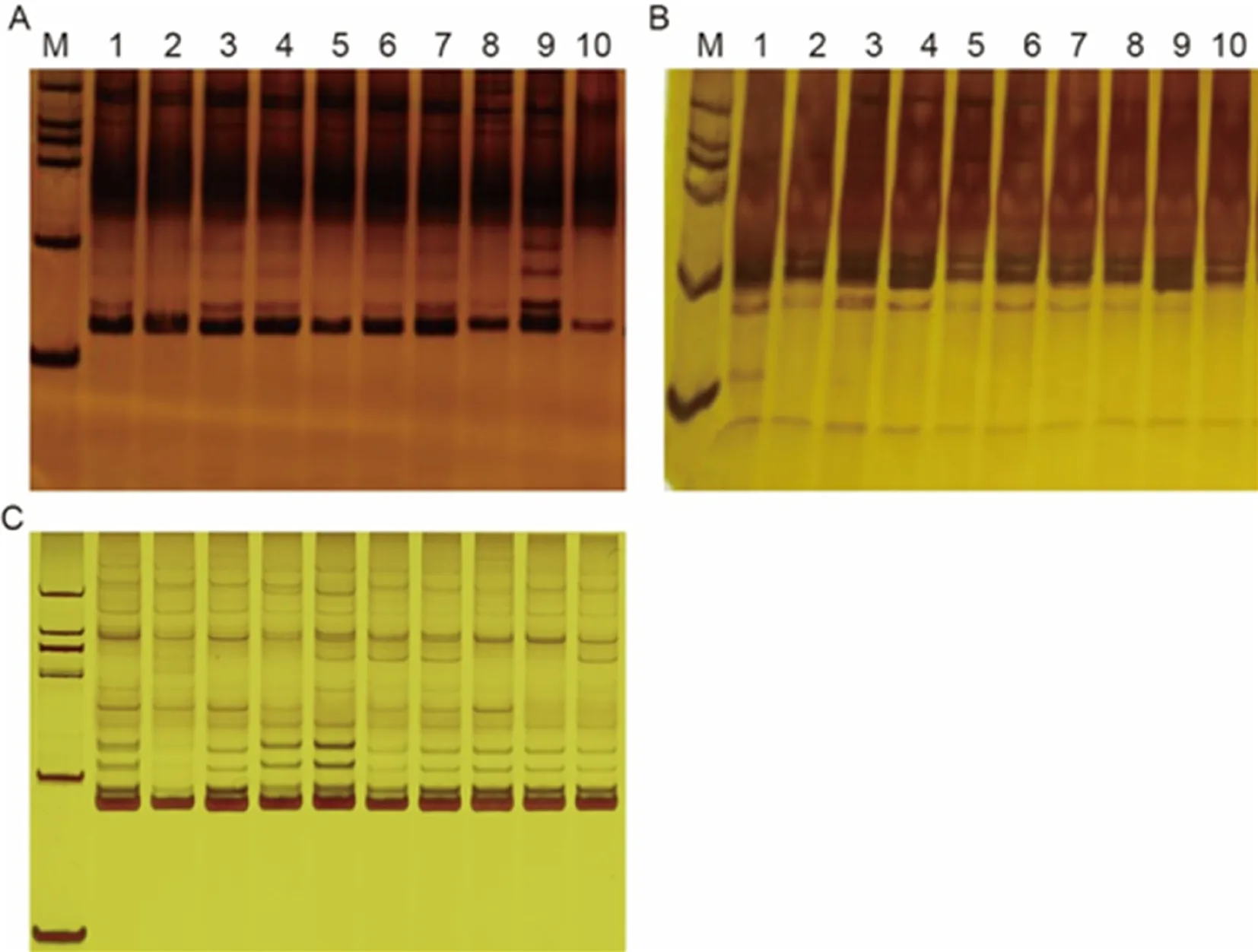
M: DL 2000 DNA Marker; A: NFB-67引物对PCR的结果, 甲醇体积比为1.25%; B: NFB-33引物对PCR结果, 甲醇体积比为0.00125%; C: NFB-33引物对PCR结果, 甲醇体积比为1%
2.2 NaOH用量对条带显色的影响
NaOH可以产生碱性环境使凝胶显色,为了探究NaOH用量对条带显色的影响,本研究在前期NaOH用量为1.375%导致染色背景较深(图1)的情况下进行了下调,当浓度分别调整为1.25%(图2 A)、1.125%(图2 B)、1%(图2 C)和0.875%(图2 D)后,凝胶颜色稍有变浅,但没有显著差异,推测需与其他因素结合考虑。图2

M: DL 2000 DNA Marker; A~D: NFB-33引物对PCR的结果, NaOH体积比分别为1.25%、1.125%、1%和0.875%
2.3 电压对电泳条带的影响
电压对电泳结果有直接影响。研究对比了不同电压值对电泳条带清晰度的影响,结果显示,当电压在较低范围时(110-130 V),导致凝胶上部出现弥散条带。之后将电压稳定到200 V并结合冰浴电泳时,每个泳道上的DNA样品条带都很清晰整齐,背景较为透明,弥散现象得到解决。图3
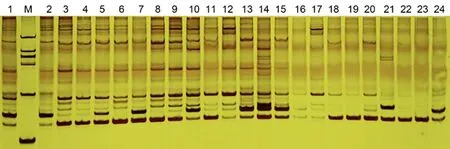
M: DL 2000 DNA Marker; 1~24: NFB-111引物对的PCR结果
2.4 温度对电泳条带的影响
研究在室温电泳时,凝胶条带泳动速率不一致导致前沿不整齐,可能是外界温度较高,电泳过程产生大量热量无法散失导致。为了防止该现象发生,我们把电泳槽放入冰浴中进行电泳,结果显示,低温下的凝胶条带未发生变形且前沿整齐一致。图4
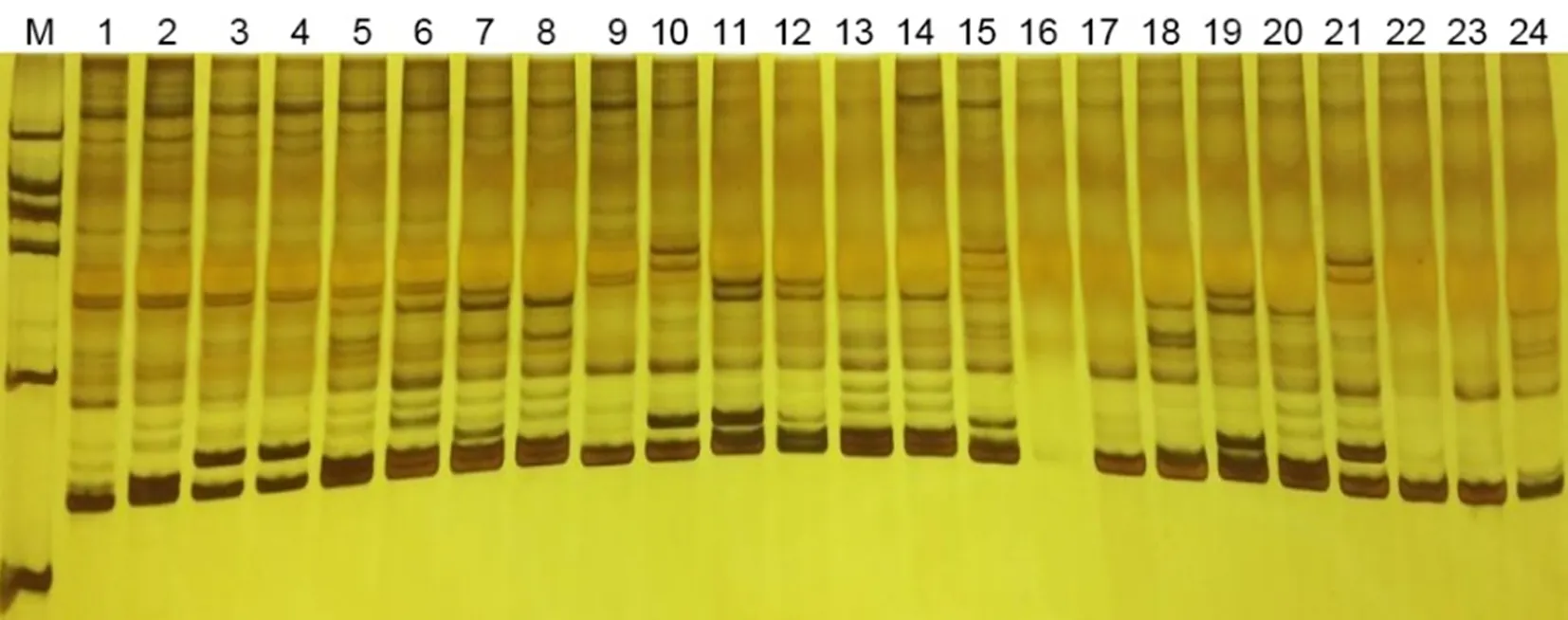
M: DL 2000 DNA Marker; 1~24: NFB-99引物对的PCR结果
2.5 气泡对电泳条带的影响
在制胶过程中如果操作不当,如加入试剂未充分混匀、凝胶不均一等因素都可能导致凝胶中产生少量气泡,这些气泡会扰乱核酸的运动轨迹,使DNA条带发生弯曲或形变,导致实验结果不利于观察。如图5泳道9和15所示。因此,在制胶和灌注过程中密切关注有无气泡产生并及时驱赶(特别是小的)气泡才能保证条带的整齐和均匀一致性。图5
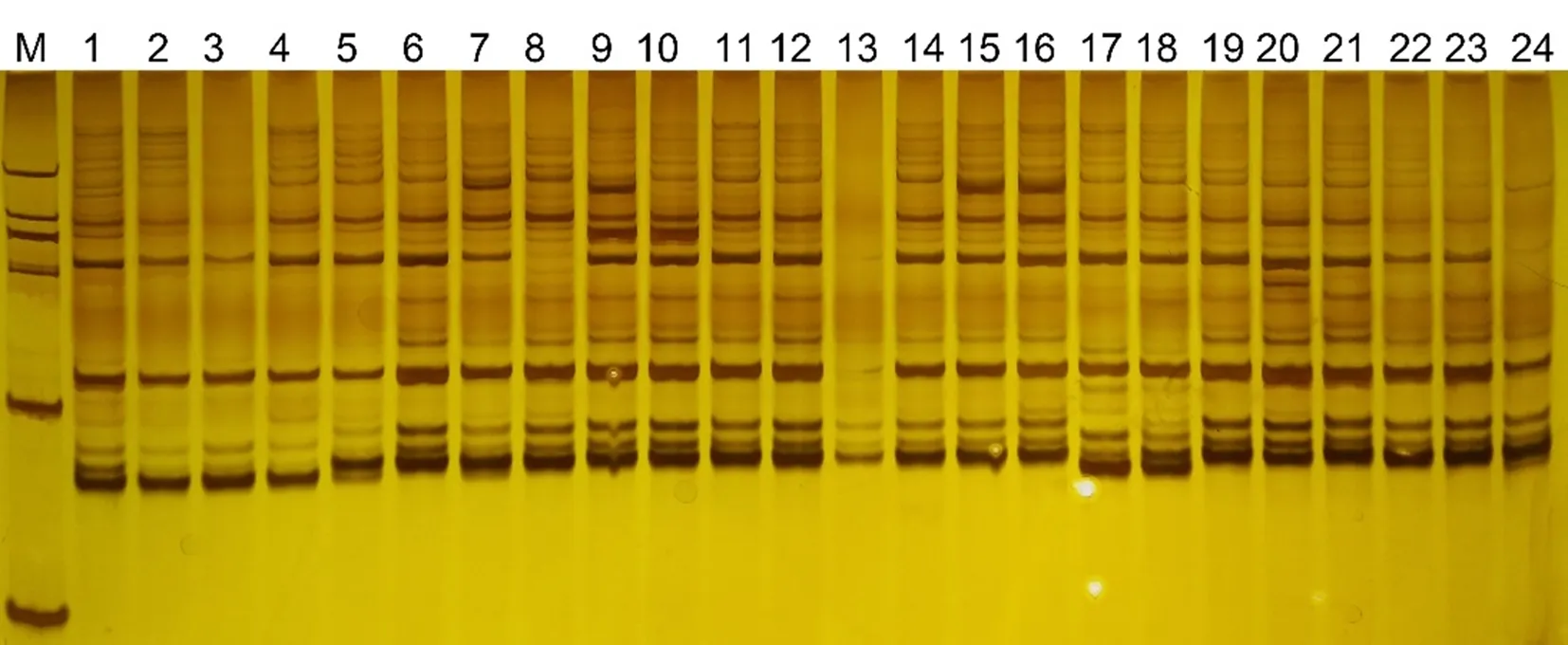
M: DL 2000 DNA Marker; 1~24: NFB-36引物对的PCR结果
3 讨 论
目前PAGE电泳技术已广泛应用于生物化学、分子生物学、细胞学、酶学、免疫学和微生物分类等研究领域[13]。例如,PAGE用于转基因成分的检出[14]、抗体纯度的鉴定[15]、糖化酶活力的快速检测[16]、小麦种子纯度的测定[17]等。尽管如此,由于PAGE技术涉及的因素较多,当实验出现问题时,必须从众多影响因素中逐一排查验证,很大程度上影响了实验的进度。目前研究显示,固定液对实验结果的影响甚微,渗透液(染色液)中硝酸银的浓度也已经多次优化[12]。基于前期结果,研究对显色液(甲醛及NaOH)成分、电压稳定性、外界温度、气泡去除等因素进行了优化,改良后的技术体系解决了背景颜色深、条带弥散、凝胶变形及条带不整齐等问题,可获得条带清晰、银染效果良好的结果。
显色液中的甲醛浓度过高时,显色速度快,但难以控制显色程度,且反差变小,使不同相对分子质量的 DNA条带不能同步显色,影响灵敏度[18]。甲醛浓度低(0.1%、0.15%、0.2%)时,显色时间长,条带不清晰且差异不大[19]。研究中甲醛浓度过高(1.25%)时,染色时间短,但凝胶背景加深;甲醛浓度过低(0.001 25%)时,染色时间长、背景色浅且条带淡。经调整后,甲醛浓度为1%时,染色时间适宜,获得了清晰条带。
甲醛需要在一定的碱性环境中发挥还原作用,NaOH可以增加染色液碱性。虽然碳酸钠也可以产生碱性环境使凝胶显色,但NaOH在显色过程中更可控且灵敏度高[18, 20]。王竹林与李西平等[11, 18]研究表明,NaOH作为显色剂时,可以缩短显影时间,但背景颜色加深,1.5%及3.0%NaOH显色时结果无差别。因此,对低浓度范围的NaOH用量进行细分后发现,0.875%、1%、1.125%、1.25%、1.375%的浓度染色效果差异并不显著。
通常PAGE电泳过程中电压高时,所需时间短;电压低则相反。在确保电泳条带良好的前提下,适当提高电压,可以缩短电泳时间,提高效率[21]。但电压过高会导致电泳温度升高,散热不均,凝胶出现“微笑效应”,即凝胶中部的样品在电场的移动比左右两侧的快,导致条带成为弧形[22]。研究针对此现象,将电泳装置放在冰浴中电泳,从而降低凝胶温度;或者降低电压并延长电泳时间,使DNA条带较为整齐。
在灌胶过程中,经常会产生大小气泡并在胶凝过程中嵌入凝胶从而影响DNA条带的迁移[23]。通常若气泡较小不易赶走时,可端起制胶架在桌平面上轻敲,使气泡上移浮出胶面;也可用注射器将气泡吸出;或及时用针一类细长的器皿将气泡赶出,从而避免影响DNA条带的迁移。若出现大量无法消除的气泡,则换干净玻璃板并重新配胶,从而减少后期的不良效果。
4 结 论
研究对银染聚丙烯酰胺凝胶电泳技术体系进行了优化,发现制胶及时赶走气泡;以稳定的200 V电压在冰浴中电泳;控制显色液中的最佳甲醛浓度(1%),NaOH浓度(0.875~1.375%)是较优的实验体系。使用优化后的体系对油菜基因组DNA扩增的产物进行聚丙酰胺凝胶电泳并染色,可取得凝胶背景浅、条带清晰、观察效果好的结果。