曲美他嗪对老年冠心病合并高血压病人血浆periostin、apelin的影响
作者单位:710061陕西省西安市,西安交通大学第一附属医院老年心内科
冠心病主要是由于脂质代谢异常导致脂质沉积在冠状动脉内膜上形成斑块,引起管腔狭窄、心脏缺血的疾病,斑块的形成和稳定性是影响冠心病预后的主要因素。60%~70%的冠心病病人同时伴有高血压,高血压可以加速心血管病变,增加心肌耗氧量,导致心绞痛[1]。高血压冠心病的发病机制尚未完全阐明,但近年来研究认为,心血管内皮功能及稳态与斑块的稳定性密切相关[2]。骨膜蛋白(periostin)是一种黏附分子,可促进血管平滑肌细胞增殖、诱导血管新生,影响新生血管内皮功能。还有文献报道其参与心脏缺血后的心肌重构,是冠心病的危险因素之一[3]。Apelin是血管紧张素受体相关蛋白的内源性配体,是心血管病的一种保护性因子,apelin高表达于心血管内皮细胞,其水平与心血管稳态平衡密切相关[4]。曲美他嗪属于心肌代谢类药物,能降低血管阻力,促进心肌功能恢复。本研究旨在观察曲美他嗪治疗老年冠心病合并高血压的临床疗效及对periostin、apelin的影响。
1 资料与方法
1.1 一般资料 选取2014年1月至2017年1月我院收治的120例冠心病合并高血压病人为研究对象,根据随机数字表法分为对照组和观察组,每组60例。2组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
纳入标准:(1)所有病人符合冠心病诊断标准[5],经冠脉造影确诊为冠心病;(2)所有病人均伴有高血压,收缩压≥140 mmHg 和(或) 舒张压≥90 mmHg;(3)年龄≥60岁;(4)依从性好,按时服药。本研究已获得病人或家属知情同意。

表1 2组病人基本资料比较(n=60)
排除标准:(1)新近心肌梗死病人;(2)对本研究药物过敏病人;(3)患有恶性肿瘤、全身感染性疾病的病人;(4)严重肝肾功能障碍病人;(5)近年发生过脑卒中的病人;(6)恶性心律失常病人。
本研究经我院伦理委员会批准,伦理批件号:XJ2014-013。
1.2 方法 对照组病人给予常规治疗,依据《中国高血压合理用药指南》和《冠心病合理用药指南》,根据病人的血压情况酌情使用降压药,包括利尿剂、血管紧张素转换酶抑制剂(ACEI)、β受体阻滞剂、抗血小板药物等,血压控制目标为低于130/80 mmHg,并给予阿司匹林(广东九明制药有限公司,国药准字H44021139)治疗,伴有心绞痛的病人酌情给予硝酸酯类药物治疗。观察组在对照组的基础上给予盐酸曲美他嗪片(北京万生药业有限责任公司,国药准字H20065167)治疗:20 mg/次,3次/d,三餐时服用。2组均连续治疗3个月。
1.3 观察指标
1.3.1 临床疗效:治疗3个月后判定临床疗效,分为显效、有效和无效[6]。显效:舒张压下降≥10 mmHg且下降至正常范围,心绞痛发作次数减少超过80%;有效:舒张压下降<10 mmHg但已经下降至正常范围,心绞痛发作次数减少50%~80%;无效:血压下降未达到上述标准,心绞痛发作次数减少<50%。总有效率=(显效+有效)/总例数×100%。
1.3.2 心功能及血压:测量2组病人治疗前后的血压,并分别于治疗前和治疗后采用飞利浦多普勒超声检测仪(ACUSON S1000)对心功能进行检测,探头频率为2.5 MHz。检测指标包括左心室射血分数(left ventricular ejection fraction, LVEF)、二尖瓣舒张早期最大速度(E峰)、二尖瓣舒张晚期最大速度(A峰)以及E峰和A峰的比值(E/A)。
1.3.3 血浆periostin、apelin水平及内皮功能:分别于治疗前和治疗后采集空腹静脉血5 mL于加有肝素的抗凝管中,37℃水浴30 min, 3000 r/min离心15 min后取上清液置入-80 ℃冰箱待检,采用ELISA法检测periostin、Apelin、内皮素(ET-1)水平,所有试剂盒由南京建成提供;应用硝酸还原酶法一次测定血浆一氧化氮(NO)水平。
1.3.4 不良反应:观察记录2组治疗期间的不良反应。

2 结果
2.1 临床疗效比较 观察组和对照组临床总有效率分别为93.33%、80.00%,差异有统计学意义(χ2=4.621,P<0.05)。见表2。

表2 2组临床疗效比较(n,n=60)
2.2 心功能及血压比较 治疗前,2组心功能和血压水平差异无统计学意义(P>0.05)。治疗后,2组E峰升高、A峰下降,E/A升高,LVEF升高,收缩压和舒张压下降,与治疗前比较,差异均有统计学意义(P<0.05);且观察组上述各指标改善程度均优于对照组(P<0.05)。见表3,4。

表3 2组治疗前后心功能各项指标比较
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05
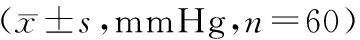
表4 2组治疗前后血压水平比较
注:与治疗前比较,*P<0.05;与对照组比较,P<0.05
2.3 血浆periostin、apelin水平及内皮功能比较 治疗前,2组Periostin、apelin、ET-1和NO水平差异无统计学意义(P>0.05)。治疗后2组血浆periostin、ET-1均显著下降,且观察组显著低于对照组,差异均有统计学意义(P<0.05);2组血浆apelin、NO水平均显著升高,且观察组显著高于对照组,差异均有统计学意义(P<0.05)。见表5。

表5 2组血浆periostin、apelin水平及ET-1、NO水平比较
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05
2.4 不良反应 治疗期间,2组均未发现明显的肝肾功能异常,未发生死亡病例,无其他明显不良反应。
3 讨论
曲美他嗪是《中国心力衰竭诊断和治疗指南》中的推荐用药,是一种长效的抗心绞痛药物,能有效改善心肌缺血,激活NO合成酶,改善内皮功能,可作为一线基础治疗的补充用药[7]。
本研究在钙通道阻滞剂(CCB)、利尿剂、β-受体阻滞剂、ACEI、血管紧张素Ⅱ受体拮抗剂(ARB)、阿司匹林等基础治疗上使用曲美他嗪治疗老年冠心病合并高血压,结果发现观察组总有效率显著高于对照组,且观察组的收缩压、舒张压均显著低于对照组,说明曲美他嗪能有助于血压控制,减少心绞痛发作次数,提高临床有效率。冠心病病人在发生心绞痛时,心肌缺血,其收缩功能和舒张功能均受到影响。一般认为,舒张功能异常发生在临床出现明显症状之前,是心脏早期损伤的敏感指标,E峰、A峰及E/A为反映舒张功能的指标;而LVEF是反映收缩功能的最常用指标。本研究发现,治疗3个月后,2组的心功能均得到了不同程度的改善,且观察组E峰显著高于对照组,A峰显著低于对照组,E/A和LVEF显著高于对照组,说明观察组的心功能改善优于对照组。分析认为,曲美他嗪是哌嗪类衍生物,能通过选择性抑制长链3-酮酰辅酶A硫解酶来抑制脂肪酸的氧化作用,同时能有效促进葡萄糖氧化,保持脂肪酸-葡萄糖的氧化平衡,维持线粒体的能量代谢,保证心肌细胞的ATP水平和电活动,改善心脏的收缩和舒张功能,有利于控制血压;曲美他嗪还可以减少心肌细胞缺血引发的氧自由基损害和酸中毒,减少心肌细胞钙超载,减少左心室僵硬,改善舒张功能,降低心脏舒张末心室压力,从而降低舒张压,达到降血压的目的[8]。
血管内皮功能损伤被证实贯穿于动脉粥样硬化、心血管疾病的全过程[9]。高血压会引起血液切应力升高、血管痉挛收缩,导致内皮细胞缺血缺氧,发生内皮损伤,导致血管舒张障碍,继而引发动脉粥样硬化[10]。NO是一种强效血管舒张因子,ET-1是一种强效血管收缩因子,两者是内皮细胞损伤的代表因子[11]。本研究发现,治疗后观察组ET-1显著低于对照组,NO显著高于对照组(P<0.05),表明曲美他嗪能有效上调NO,下调ET-1,减轻血管收缩,增加血管舒张,改善血管内皮功能。apelin是一种心血管活性肽,在血管内皮细胞和平滑肌细胞中表达丰富,能通过NO的介导,扩张血管、降低血压,被认为是治疗高血压的新靶点。apelin还参与心血管系统的调节和能量代谢,其可以通过阻断氧化应激反应参与心肌重塑,预防心肌肥厚,改善心功能[12]。本研究结果观察到,apelin与NO水平变化趋势一致,推测曲美他嗪可能通过影响aplein的表达来调节改善心肌功能,改善血管收缩-舒张功能,减轻动脉斑块的形成和聚集,降低冠心病不良预后风险。同时本研究发现,periostin与ET-1的变化趋势一致,periostin是一种粘性蛋白,能诱导平滑肌细胞增殖,具有诱导心血管生成作用,但periostin诱导生成的新生血管内壁的内皮功能不完整,各种炎症因子易通过内皮细胞影响动脉斑块,增加斑块破裂的风险。曲美他嗪可通过下调ET-1减轻血管收缩,恢复血管弹性,通过影响periostin的表达来减轻心肌细胞的生成,改善血管内皮功能,降低斑块破裂的风险[13-14]。
综上所述,曲美他嗪能够提高老年冠心病合并高血压病人的临床治疗有效率,降低血压、改善心功能,降低血浆periostin水平,提高血浆apelin水平,改善内皮功能,值得临床推广。

