蛋白转导RabGEF1减轻小鼠肝脏缺血再灌注所致的肺损伤*
方虹仪, 程 楠, 谢汉镔, 罗晨芳
(中山大学附属第三医院麻醉科, 广东 广州 510630)
肝脏缺血再灌注损伤(hepatic ischemia/reperfusion injury,HI/RI)不仅是肝移植和肝部分切除术后引起急性肝衰竭和慢性肝功能损害的主要原因[1-2],还常引起远端器官损伤,其中肝IR导致急性肺损伤增加了肝移植术后的死亡率,是一个亟待解决的临床难题[3]。肝移植术后急性肺损伤发生率约27.5%,5.5%患者出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[4],具体的机制尚未完全研究清楚。有研究认为肥大细胞激活在多种急性肺损伤过程中发挥了重要作用[5-6],但目前临床上并没有HI/RI肺损伤的有效预防措施,也没有通过抑制肥大细胞功能取得良好疗效并应用于临床的药物和方法。
Rab鸟嘌呤核苷酸交换因子1(Rab guanine nucleotide exchange factor 1, RabGEF1)是一类主要在肥大细胞中表达并参与胞吞途径的调整蛋白,与肥大细胞的激活抑制相关。Tam等[7]研究发现,与对照组比较,RabGEF1-/-基因缺陷小鼠中肥大细胞数量及组胺浓度升高,炎症损伤加重,证明RabGEF1可抑制肥大细胞激活。因此,我们提出假设:RabGEF1蛋白可能通过抑制肥大细胞激活达到减轻肝脏缺血再灌注所致肺损伤的作用。基于这一假设,前期我们构建了RabGEF1和转录反式激活因子[8](trans-activator of transcription,TAT)融合蛋白(Tat-RabGEF1),验证了该蛋白具有跨膜转导入胞的活性[9]。本项工作探讨这一蛋白在小鼠体内能否抑制组织炎症反应,从而减轻肝脏缺血再灌注所致的肺损伤,并初步分析其对肺肥大细胞的效应。
材 料 和 方 法
1 实验动物及试剂
健康雄性C57BL/6小鼠,体重21~24 g,6~8周龄,购于南方医科大学实验动物中心,SPF环境饲养,自由进食、饮水。Tat-RabGEF1(液态,无色透明,1 g/L,-80 ℃保存)在前期已由本实验室通过基因工程成功制备;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和白细胞介素1β(interleukin-1β,IL-1β)酶联免疫吸附试验(ELISA)试剂盒购于上海碧云天生物技术公司;β-氨基己糖苷酶A(β-hexosaminidase A,β-Hex A)和髓过氧化物酶(myeloperoxidase,MPO)ELISA试剂盒购于南京凯基生物科技发展有限公司;类胰蛋白酶(tryptase)抗体购于Santa Cruz。
2 方法
2.1小鼠肝IR模型的制备 术前禁食12 h,自由进水,戊巴比妥钠(45~50 mg/kg)腹腔注射麻醉小鼠,仰卧位固定于恒温加热板。取中线开腹,以无损伤血管夹夹闭通往肝左叶及肝中叶(约占整个肝脏质量的70%)的肝蒂,包括门静脉、肝动脉和胆道(此时可见肝左叶及中叶的颜色变暗灰,注意不要影响肝右叶及尾状叶血流)。无菌生理盐水纱布覆盖腹部切口。缺血90 min后撤离无损伤血管夹,恢复血流(可见缺血肝叶颜色由暗灰变为暗红),开始再灌注,逐层关腹。
2.2实验动物分组 24只C57BL/6小鼠,按随机数字表法分为假手术(sham)组、IR组和Tat-RabGEF1组,每组8只。Sham组小鼠仅接受麻醉、开腹及关腹操作;IR组及Tat-RabGEF1组小鼠建立肝脏IR模型,Tat-RabGEF1组于再灌注即刻经尾静脉注射Tat-RabGEF1(10 mg/kg),IR组经尾静脉注射等量生理盐水。
2.3标本采集 再灌注后4 h处死小鼠,用1 mL生理盐水经气管导管行左肺灌洗,共3次,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),离心取上清液,-80 ℃冻存,用于检测TNF-α、IL-6和IL-1β浓度;收集右上肺并用10%甲醛固定,常规石蜡包埋切片,HE染色,光镜下观察肺组织病理改变;右中肺用于检测肺组织湿/干重比;右下肺制备组织匀浆,用于检测β-Hex A和MPO水平以及类胰蛋白酶表达。
2.4肺组织湿/干重比 获取小鼠右中肺后,滤纸擦干肺表面液体,立即称重(湿重);再置于80 ℃恒温箱烤72 h至恒重,称量干重,计算湿/干重比。
2.5ELISA检测 肺泡灌洗液内TNF-α、IL-6和IL-1β的含量以及肺组织β-Hex A和MPO检测采用相应的ELISA试剂盒并按照说明书操作进行检测。
2.6Western blot检测 肺组织加入蛋白裂解液,在冰浴中充分匀浆后,于4 ℃、12 000×g离心30 min,转移上清液于新的EP管中,准备定量或存于-80 ℃冰箱。测定类胰蛋白酶的蛋白含量。常规配制10%凝胶并放入电泳槽中,检测样品量为30 μg。恒压90 V开始电泳,当染料前沿进入分离胶后,将电压提高到100 V,继续电泳至溴酚兰到达分离胶底部。切取含有目的条带和β-actin蛋白的凝胶,100 V、90 min转膜。将PVDF膜放入5% 脱脂奶粉/TBST 液中于37 ℃封闭2 h。1∶500稀释的抗类胰蛋白酶抗体和 1∶5 000 稀释的抗β-actin 单克隆抗体与PVDF膜孵育过夜。充分洗膜3次后,孵育Ⅱ抗。充分洗膜,并在暗室中曝光、显影、定影。
3 统计学分析
所有数据使用SPSS 13.0软件处理,计量资料以均数±标准差(mean±SD)表示。多组间比较采用方差分析,两组间比较行独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 肺损伤及评分
Sham组肺组织结构完整清晰,未见明显炎性渗出和细胞浸润;与之比较,IR组小鼠肺组织病理损伤明显,肺小血管充血,肺泡破裂、大小不一,红色渗出液增多,肺间质增厚水肿,可见大量中性粒细胞浸润弥漫;与sham组相比,IR组损伤评分和肺组织湿/干比显著升高(P<0.05);与IR组比较,Tat-RabGEF1组肺组织病理损伤减轻、损伤评分及肺组织湿/干比显著降低(P<0.05),见图1。
Figure 1.The photomicrographs of lung tissues, lung injury scores, and lung wet/dry weight ratios of the three groups. A: the photomicrographs of lung tissues (HE staining); B: lung injury scores; C: lung wet/dry weight ratios.Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsIR group.
图13组小鼠肺病理图片、损伤评分及肺组织湿/干重比
2 BALF中细胞因子水平
与sham组比较,IR后BALF中TNF-α、IL-6和IL-1β水平显著升高(P<0.05);与IR组比较,Tat-RabGEF1组TNF-α、IL-6和IL-1β水平显著降低(P<0.05),见图2。
3 肺组织中β-Hex A和MPO水平
与sham组比较,IR后肺组织β-Hex A和MPO水平显著升高(P<0.05);与IR组比较,Tat-RabGEF1组β-Hex A和MPO水平显著降低(P<0.05),见图3。
4 肺组织中类胰蛋白酶表达
与sham组比较,IR后肺组织类胰蛋白酶表达显著上调(P<0.05);与IR组比较,Tat-RabGEF1组类胰蛋白酶表达显著下调(P<0.05),见图4。
讨 论
小鼠肝部分缺血再灌注模型通过部分夹闭肝蒂,主要中断肝左叶和中叶(约占肝脏体积的70%)的血液供应,这一模型部分钳夹允许门静脉通过剩余的肝段,有助于延长缺血时间并防止严重肠系膜充血,从而减少细菌移位[10]和内毒素释放入血[11],且减少继发于肠系膜淤滞的炎症介质的干扰。它广泛应用于诸多研究,造模总体成功率可达到91.7%[12]。根据既往研究[13]及本实验室经验,选择肝脏缺血90 min、再灌注4 h的方法构建肝脏缺血再灌注损伤模型,小鼠存活率为100%,产生一定程度肺损伤的成功率约80%。肝脏缺血再灌注损伤的机制与氧自由基生成过多、促炎因子大量释放引起炎症爆发有关[14],这些产物在再灌注阶段通过血液循环进入全身多个器官,引起远端器官组织炎症和结构破坏。TNF-α[15]、IL-6[16]和 IL-1β[17]在多项研究中被证实介导了器官缺血再灌注损害后ALI和ARDS过程,其水平高低与肺损伤程度相关[18]。MPO来源于激活的中性粒细胞,是氧化应激时表达的氧化还原酶,通过催化次氯酸、硝基化自由基和氯胺促进H2O2的氧化能力[19],反映中性粒细胞浸润水平。本实验结果显示肝脏缺血再灌注4 h肝脏病理切片中肝实质细胞炎性渗出水肿明显;急性肺损伤严重,组织病理切片肺小血管充血,肺泡破裂、渗出增多,肺间质水肿、增厚,大量中性粒细胞浸润弥漫。肺湿/干重比增高,说明肝IR引起的肺损伤模型复制成功。IR组血清和BALF中促炎细胞因子水平高于正常组,与肺组织病理评分升高结果一致,进一步表明炎症反应和氧化应激是肝脏缺血再灌注后肺损伤的重要机制。对比RabGEF1组和IR组,不仅肺组织病理损伤减轻,且伴随着细胞因子和MPO水平下降,提示蛋白转导RabGEF1有助于缓解肝IR后急性肺损伤以及氧化应激/炎症爆发的程度。

Figure 2.The levels of cytokines in BALF. A: TNF-α; B: IL-6; C: IL-1β. Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsIR group.
图2BALF中细胞因子水平

Figure 3.The levels of β-Hex A and MPO in lung tissues of the three groups. Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsIR group.
图3肺组织β-HexA和MPO水平
先前研究表明,肥大细胞激活释放类胰蛋白酶和多种细胞因子参与肠[20]缺血再灌注损伤,自体原位肝移植肺损伤过程[18]和脑缺血再灌注损伤[21]。IR引起的炎症反应促使肥大细胞激活脱颗粒大量释放类胰蛋白酶[22],在炎症反应中类胰蛋白酶不仅刺激外周T细胞、单核细胞、气道上皮细胞产生释放TNF-α、IL-6、IL-1β、IL-8等,而且促进相邻肥大细胞激活,形成肥大细胞激活“瀑布”现象[23],进一步加重IR炎症反应,形成恶性循环。肥大细胞加重肺损伤其更深入的机制可能是通过释放的类胰蛋白酶或细胞因子激活蛋白酶激活受体2介导损伤,或通过促进中性粒细胞、单核细胞/巨噬细胞的细胞间黏附分子 1表达而促进白细胞的活化[24]。β-Hex A是肥大细胞和嗜碱性粒细胞脱颗粒释放的一种活性介质,相比于组胺的不稳定性,是较好的肥大细胞脱颗粒测量指标[25]。类胰蛋白酶作为肥大细胞含量最高的活性介质,只有在肥大细胞激活时大量释放,也是肥大细胞激活脱颗粒的重要标记物[22]。为进一步探讨,本实验检测肺组织类胰蛋白酶和β-Hex A释放水平,结果显示实验组显著低于IR组,这提示Tat-RabGEF1可能是通过蛋白转导入肥大细胞内,起到抑制肥大细胞激活从而减弱肝脏缺血再灌注损伤后的炎症反应进一步恶化的功效。
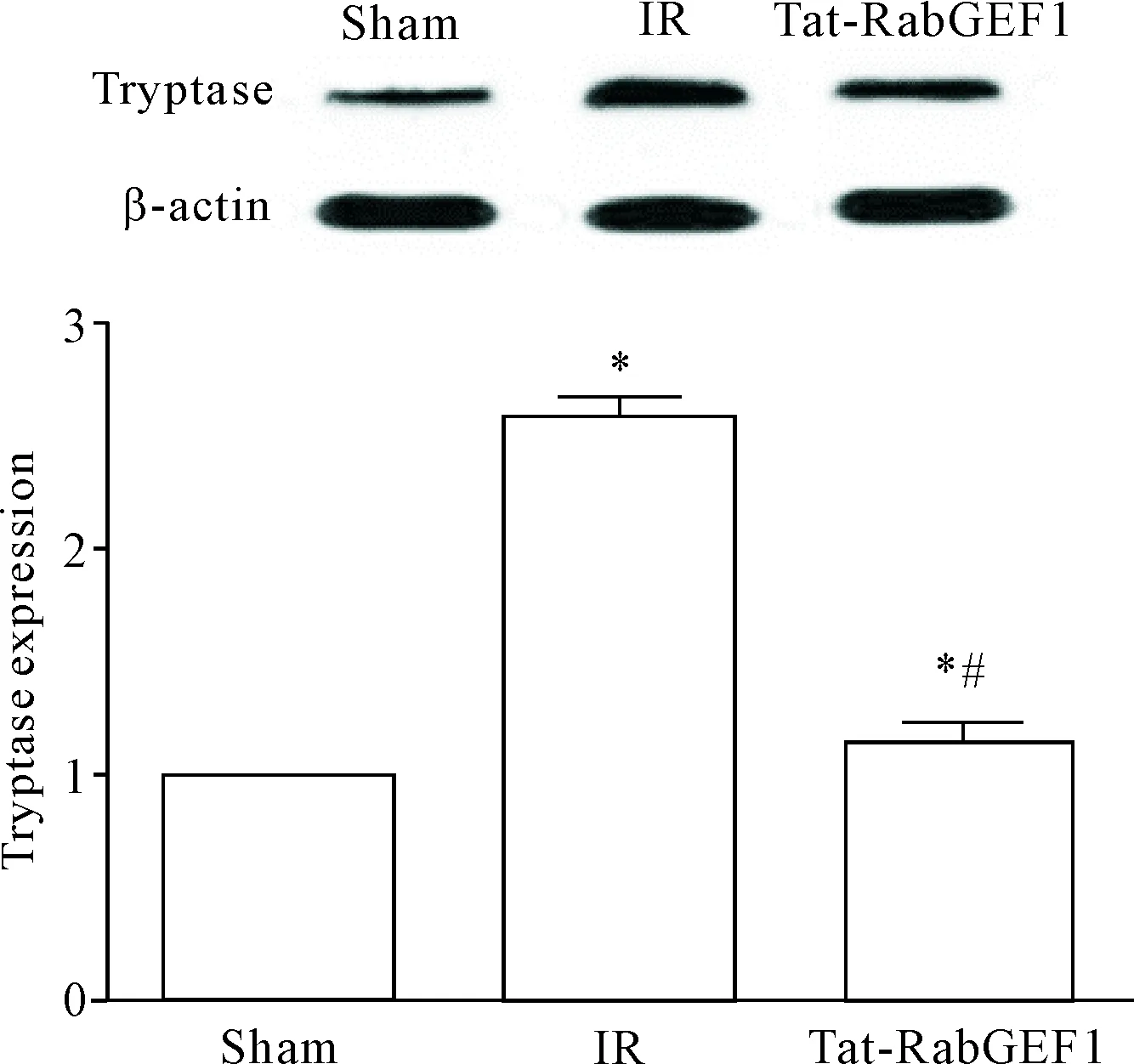
Figure 4.The expression of tryptase in lung tissue. Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsIR group.
图4肺组织中类胰蛋白酶的表达
前期已由基因工程成功构建了含Tat-RabGEF1的重组质粒并表达了高纯度融合蛋白Tat-RabGEF1,并通过免疫荧光标记证实该融合蛋白利用天然存在的Tat转导蛋白结构域在体外可安全有效跨膜转导进入肥大细胞内,不存在细胞毒性[9]。既往研究表明,RabGEF1是肥大细胞表达的一种鸟苷酸交换因子,具有抑制失活状态的GDP-RAS向激活状态的GTP-RAS转变,促进GTP-RAS转变成GDP-RAS的功能[26],这是肥大细胞激活途径中的中心环节,因此产生抑制肥大细胞激活的生物学效应。结合体内外实验结果,说明融合蛋白Tat-RabGEF1注入小鼠体内产生了肥大细胞激活的抑制效应是此蛋白对肝缺血再灌注肺损伤模型保护作用的可能机制之一。本实验尚未追踪尾静脉注射Tat-RabGEF1后蛋白在小鼠体内和肥大细胞内的位置及探讨融合蛋白对胞内信号通路的作用,有待今后深入研究。
本实验证实了蛋白转导RabGEF1可以有效减轻小鼠肝缺血再灌注急性肺损伤程度,减少多种炎症因子和细胞因子的表达;其机制可能与RabGEF1转导进入肥大细胞内抑制肥大细胞激活途径有关;这一蛋白在体内的作用机制和安全性,值得深入研究以帮助防治肝移植或肝部分切除术后肺损伤新型药物的开发。

