尘螨抗原对P815肥大细胞维生素D受体和炎症介质分泌的影响及 1,25(OH)2D3的免疫调节作用
李如霞 白小莉 俞棋英 孙妍 李巧玲 李孟荣
机体对过敏原的易感性是引起过敏性疾病的重要危险因素,近几十年世界各地过敏性疾病发生率呈逐年增长趋势[1]。尘螨抗原(Der p)是诱发过敏性哮喘和鼻炎最常见的室内过敏原[2]。肥大细胞作为免疫系统的中间细胞及效应细胞,主要分布于与外界过敏原密切接触的组织表面,并在过敏性疾病的发病机制中发挥核心作用[3]。1,25(OH)2D3是维生素D的活性形式,有研究报道能下调登革热病毒感染的巨噬细胞Th2型细胞因子IL-4的表达,高剂量1,25(OH)2D3能上调IL-10分泌[4]。目前关于1,25(OH)2D3对肥大细胞生物学作用的研究甚少。本研究通过观察Der p以及1,25(OH)2D3联合Der p直接作用于P815肥大细胞后维生素D受体(VDR)表达及 IL-4、IL-10分泌的变化,探讨1,25(OH)2D3的免疫调节作用。
1 材料和方法
1.1 主要仪器和试剂 CO2培养箱(Heal Force 90,美国Thermo),RT-PCR仪(美国Roche),电泳槽(Dycp-31BM,北京市六一仪器厂),生物电泳图像分析(FR-980),倒置显微镜(日本NIKON),荧光显微镜(日本OLYMPUSCX21FS1),图像分析软件(美国Image-Pro plus 6.0)。小鼠肥大细胞瘤细胞P815(中国科学院上海生命科学研究所细胞资源中心),纯化尘螨提取液(有效成分Der p,丹麦ALK-Abello),1,25(OH)2D3(美国Sigma);抗维生素D受体抗体(ab3508,英国Abcam),异硫氰酸荧光素(FITC)标记的羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司),高糖培养基(DMEM)、FBS(美国Gibco),RT-PCR 试剂盒(美国 Fermentas),Trizol抽提试剂、聚偏二氟乙烯膜(PVDF)(美国 Invitrogen),核苷酸胶体染料(SYBR Green I Stain)(美国 Roche),核酸染色剂(Gold View)、蛋白定量试剂盒(BCA)(中国 SalarBio),甘油醛-3-磷酸脱氢酶(GAPDH)(美国 Bioworld),小鼠IL-4、IL-10 ELISA试剂盒(杭州联科生物MULTI SCIENCES);其他生化试剂均为进口分装或国产分析纯。所用引物由上海基康生物技术有限公司合成,引物序列见表1。
1.2 细胞培养与分组 P815肥大细胞置于含10%FBS的DMEM培养基,并放入37℃、5%CO2培养箱中隔天传代一次。计数2×105/ml细胞并培养24h后,分别用Der p(0、0.000 1、0.001、0.01、0.1μg/ml)及 1,25-(OH)2D3(10-12、10-10、10-8mol/L) 单独或联合作用 P815 肥大细胞,其中联合作用分组情况如下:0μg/ml Der p+0mol/L 1,25(OH)2D3为Ⅰ组,0.1μg/ml Der p 为Ⅱ组,0.1μg/ml Der p+10-12mol/L 1,25(OH)2D3为Ⅲ组,0.1μg/ml Der p+10-10mol/L 1,25(OH)2D3为Ⅳ组,0.1μg/ml Der p+10-8mol/L 1,25(OH)2D3为Ⅴ组;分别于 2、6、12、24、36h终止反应,室温离心10min后收集上清液,置于-80℃保存备用。
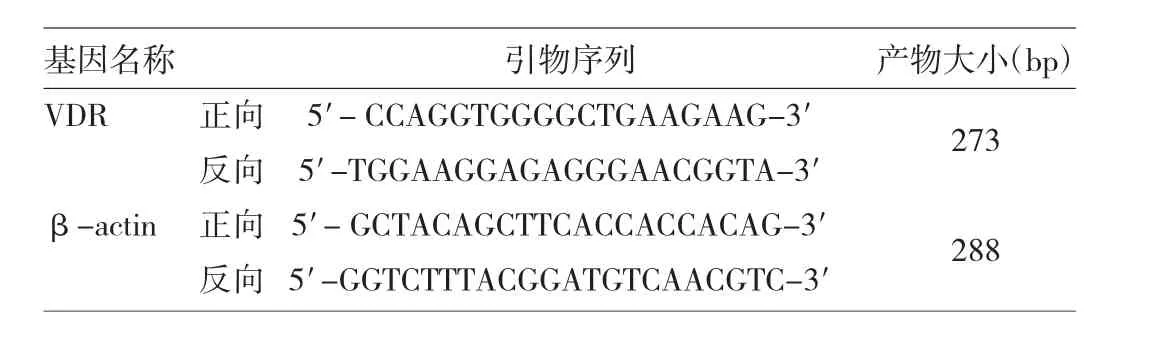
表1 引物序列
1.3 免疫荧光细胞染色及琼脂糖凝胶电泳验证P815肥大细胞上表达VDR (1)免疫荧光细胞染色:小鼠肥大细胞经4%多聚甲醛固定15min后,PBS洗5min,Triton-X 100穿孔 15min,PBS洗 5min×3次,用 5%BSA 封闭30min,加入1%BSA稀释的一抗,放入湿盒,4℃过夜,PBS洗5min×3次,加入1%BSA稀释的荧光二抗,置于 37℃避光孵育 60min,PBS洗 5min×3次,制片,在荧光显微镜下观察肥大细胞VDR表达。(2)琼脂糖凝胶电泳:配制2%的琼脂糖凝胶,胶膜中放好梳子,将凝胶倒入胶膜中,室温下静置30min,使胶充分冷却并凝固,移去梳子,将凝胶放入电泳槽。加入0.5×TBE电泳缓冲液,使液面高出凝胶约1mm,取需检测基因PCR产物4μl,加入5×上样缓冲液1μl充分震荡混匀,加入加样孔中,留出一孔加入 DNA Marker 5μl,120V恒压电泳,使DNA向阳极方向泳动。40min后停止电泳,取出凝胶,用FR-980生物电泳图像分析系统获取凝胶图像。
1.4 肥大细胞中VDR mRNA表达的检测 采用RTPCR法。收集培养的肥大细胞,使用Trizol Reagent提取细胞总RNA,使用多功能酶标仪测定RNA含量及纯度。根据RT-PCR试剂盒说明书进行cDNA合成,逆转录条件如下:42℃ 1h,72℃ 5min。每个反应体系包括5μl的 SYBR Green I Stain,1μl的 10μmol/L 引物,1μl的cDNA,加双蒸水至总体积为10μl;扩增条件:95℃10min,95℃ 15s,60℃ 30s,72℃ 30s;共 45 个循环;反应结束后用Roche Light Cycler 480软件进行数据分析,目标基因表达差异以经过处理的样本相对于未经处理的样本的倍数表示,即检测基因的差异=2-ΔΔCt(ΔΔCt=ΔCt处理组-ΔCt未处理组)。
1.5 肥大细胞中VDR蛋白表达的检测 采用Western blot法。收集培养的肥大细胞,用蛋白裂解液提取细胞总蛋白,用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离VDR蛋白,湿式电转移进行转膜,再以5%%脱脂奶粉室温封闭2h,4℃摇箱中一抗孵育过夜,一抗浓度 1∶1 000,等渗缓冲溶液(TBST)洗 5min×3次,室温下孵育二抗2h,二抗浓度1∶5 000,TBST洗15min×3次,滴加化学发光检测试剂,用Gel-Pro凝胶分析软件分析。蛋白相对表达水平=目的蛋白条带累积光密度/内参条带累积光密度。
1.6 肥大细胞上清液中IL-4、IL-10浓度的检测 采用ELISA法。使用小鼠IL-4、IL-10 ELISA试剂盒检测上述实验收集的肥大细胞悬液上清液中IL-4、IL-10浓度,按说明书进行操作。
1.7 统计学处理 应用SPSS 17.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 VDR在P815肥大细胞上的表达 免疫荧光细胞染色及琼脂糖凝胶电泳结果显示,P815肥大细胞上表达VDR,见图1(插页)和图2。

图1 免疫荧光细胞染色验证P815肥大细胞上表达VDR(a:不加VDR单克隆抗体;b:加VDR单克隆抗体,绿色荧光为阳性表现;c-d:DAPI染色后显示的细胞核;×400)
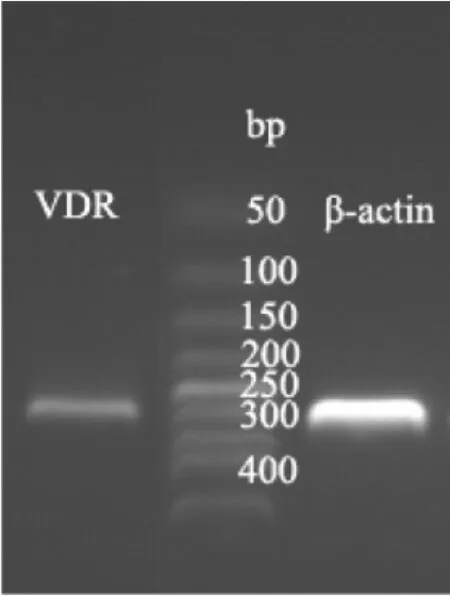
图2 P815肥大细胞上VDR表达的电泳图
2.2 Der p对P815肥大细胞VDR表达的影响 不同浓度 Der p 作用 P815 肥大细胞 2、6、12、24、36h 后,VDR mRNA表达均有不同程度下降,在12、24h作用组,VDR mRNA表达呈浓度依赖性下降(均P<0.05),见图3。不同浓度Der p作用P815肥大细胞36h后,VDR蛋白表达呈浓度依赖性下调,见图4。

图3 不同浓度Der p作用P815肥大细胞2、6、12、24、36h后VDR mRNA表达
2.3 1,25(OH)2D3对P815肥大细胞VDR表达及IL-4、IL-10分泌的影响 与0mol/L组比较,10-12、10-10mol/L的1,25(OH)2D3作用后P815肥大细胞VDR mRNA表达差异均无统计学意义(均P>0.05);10-8mol/L的1,25(OH)2D3作用后P815肥大细胞VDR mRNA表达明显升高,差异有统计学意义(P<0.05)。与0mol/L组比较,10-12mol/L的1,25(OH)2D3作用后 P815肥大细胞VDR蛋白表达差异不明显;10-10mol/L、10-8mol/L的1,25(OH)2D3作用后P815肥大细胞VDR蛋白表达均明显上调,见图5。不同浓度1,25(OH)2D3作用P815肥大细胞36h后,IL-4浓度变化不明显(P>0.05);而10-10mol/L、10-8mol/L 的 1,25(OH)2D3作用后 P815 肥大细胞上清液中IL-10浓度较0mol/L组均明显升高(均P<0.05),见图 6。

图4 不同浓度Der p作用P815肥大细胞36h后VDR蛋白表达的电泳图(a:0μg/ml;b:0.0001μg/ml;c:0.001μg/ml;d:0.01μg/ml;e:0.1μg/ml)
2.4 Der p联合1,25(OH)2D3作用P815肥大细胞36h后对VDR表达及IL-4、IL-10分泌的影响 与Ⅰ组比较,Ⅱ组P815肥大细胞VDR mRNA表达明显下降(P<0.05);与Ⅱ组比较,Ⅲ、Ⅳ、Ⅴ组P815肥大细胞VDR mRNA表达均明显升高(均P<0.05)。Ⅱ组P815肥大细胞VDR蛋白表达较Ⅰ组明显下调;Ⅱ组与Ⅲ组P815肥大细胞VDR蛋白表达变化不明显;Ⅳ、Ⅴ组P815肥大细胞VDR蛋白表达明显上调。与Ⅰ组比较,Ⅱ组P815肥大细胞上清液中IL-4浓度明显升高(P<0.05),IL-10浓度差异无统计学意义(P>0.05);与Ⅱ组比较,Ⅲ、Ⅳ、Ⅴ组P815肥大细胞上清液中IL-4浓度均明显下降(均P<0.05),且 1,25(OH)2D3浓度越高,IL-4浓度下降越明显,而IL-10浓度差异无统计学意义(P >0.05),见图7-8。

图5 不同浓度1,25(OH)2D3作用P815肥大细胞36h后VDR mRNA 及蛋白表达(a:0mol/L;b:10-12mol/L;c:10-10mol/L;d:10-8mol/L)

图6 不同浓度1,25(OH)2D3作用P815肥大细胞36h后上清液中 IL-4、IL-10浓度变化(n=6)
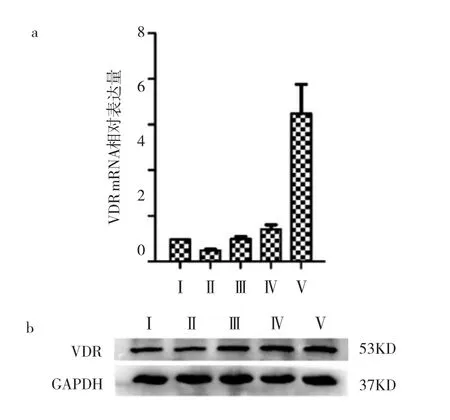
图7 Der p联合1,25(OH)2D3作用P815肥大细胞 36h后VDR mRNA及蛋白表达

图8 Der p联合1,25(OH)2D3作用P815肥大细胞36h后上清液中 IL-4、IL-10浓度变化(n=6)
3 讨论
过敏性疾病包括支气管哮喘、变应性鼻炎、变应性结膜炎、变应性皮炎、食物及药物过敏等,目前关于过敏的产生机制尚未完全阐明,但是过敏原和易感个体的存在以及两者之间的相互作用是导致过敏性疾病发生必不可少的因素。肥大细胞是过敏反应的效应细胞,在先天性和获得性免疫应答中也发挥着重要作用。
国内研究结果显示,引起人类变态反应性疾病的尘螨主要包括屋尘螨和粉尘螨,其抗原有多种亚型,不同Der p具有交叉反应性,Der f1和Der p1均能诱导交叉反应和产生种属特异性抗体[5-6]。针对Der p2和Der f2的IgE抗体,几乎呈完全交叉反应;而且Der p2和Der f2在尘螨过敏性疾病患者皮试阳性中占极高的比例[7]。有文献证明,Der f直接作用于P815肥大细胞,可以导致其表达 TNF-α、IL-1β、IL-4、IL-6、IL-9 和 IL-13 增加[8]。本研究结果发现,不同浓度Der p作用于P815肥大细胞不同时间后,VDR mRNA及蛋白表达均减少,但无明显浓度及时间依赖性变化,低浓度Der p对VDR表达的影响不明显。0.1μg/ml Der p作用于P815肥大细胞36h后,上清液中IL-4浓度明显升高,但IL-10浓度无明显变化。因P815肥大细胞不表达IgE受体I(FcεRI),且本实验未加入Der p特异的IgE抗体,故以上结果表明Der p对肥大细胞的直接作用可能是通过下调VDR表达,促进IL-4的分泌,破坏Th1/Th2平衡,导致了Th2型免疫应答增强,从而发挥其致炎作用。
Th1/Th2平衡是免疫应答调节中的关键环节,Th1和Th2彼此相互抑制,呈动态平衡;如果这一平衡向Th2偏移,会使Th2型细胞因子(如IL-4、IL-5、IL-13等)水平升高,而Th1型细胞因子(如IL-12、INF-γ等)水平降低[9]。IL-4是主要的抗原类别转换因子,其可以引导被抗原激活的B淋巴细胞IgE抗体的产生增加,而IgE依赖的肥大细胞的激活在速发型超敏反应中起核心作用[10]。IL-4还可以促进组织肥大细胞及嗜酸性粒细胞增长[11]。此外,IL-4可以激活并且维持Th2细胞对过敏原的应答反应。本研究结果发现,0.1μg/ml Der p处理P815肥大细胞36h后,IL-4浓度较对照组明显升高,提示Der p可通过促进肥大细胞IL-4分泌,促进Th2型免疫应答的产生。IL-10是一种具有强抗炎作用的细胞因子,因其可抑制Th1和Th2免疫应答,故其对免疫介导的各种疾病,包括过敏性疾病、移植排斥反应以及自身免疫性疾病等具有潜在的治疗作用[12-13]。IL-10通过调节Th1/Th2型细胞因子的分泌、减少IgE的产生、诱导机体对过敏原产生免疫耐受等途径减轻过敏性炎症反应[9]。已有研究结果发现,外周血衍化的CD3+、CD4+T细胞在1,25(OH)2D3作用下,IL-10 分泌呈浓度依赖性增加[14]。
维生素D通过它的活性形式1,25(OH)2D3发挥作用,其不仅对骨盐代谢有调节作用,也能调节先天性和获得性免疫应答[15]。近几十年来,很多动物实验和临床研究证实维生素D在治疗过敏性疾病中的有效性。最近一项临床研究结果显示,补充维生素D可以明显改善患儿的湿疹症状[16]。补充维生素D的哮喘小鼠,其气道高反应、气道重塑以及支气管肺泡灌洗液(BALF)中嗜酸性粒细胞数和前炎症细胞因子均明显减少,而BALF中IL-10浓度及T调节细胞数明显增多[17]。脂多糖可以诱导小牛树突状细胞IL-10的分泌,而维生素D对其有促进作用[18]。
本研究对细胞悬液上清液中IL-4、IL-10浓度的检测结果显示,不同浓度1,25(OH)2D3作用P815肥大细胞36h后,IL-4浓度无明显变化,而IL-10浓度较对照组明显升高,且1,25(OH)2D3浓度越大,IL-10浓度升高越明显。0.1μg/ml Der p处理P815肥大细胞36h后,IL-4浓度较对照组明显升高,但IL-10浓度与对照组比较差异无统计学意义。将1,25(OH)2D3、Der p同时处理P815肥大细胞36h后,IL-4浓度较Der p处理组明显下降,且1,25(OH)2D3浓度越高,IL-4浓度下降越明显。可见,Der p单独作用于P815肥大细胞可增加IL-4的分泌,但对IL-10水平无明显影响;1,25(OH)2D3单独作用于P815肥大细胞对IL-4水平无影响,但可增加IL-10的分泌,并抑制Der p的促IL-4释放作用;而Der p可抑制1,25(OH)2D3的促IL-10释放作用。笔者认为,1,25(OH)2D3对Der p引起的肥大细胞炎症反应的干预作用可能是通过抑制IL-4的合成和分泌,从而抑制Th2型免疫应答的。
综上所述,Der p直接作用于P815肥大细胞,使VDR表达下调及IL-4分泌增加,对IL-10分泌无明显影响;高浓度1,25(OH)2D3单独作用可上调VDR表达及促进IL-10分泌,但对IL-4分泌无明显影响;1,25(OH)2D3可以下调Der p引起的IL-4分泌,从而抑制Th2免疫应答;1,25(OH)2D3可通过上调肥大细胞VDR表达,促进IL-10分泌,从而发挥抗炎作用。关于1,25(OH)2D3对肥大细胞VDR表达的调节及引起细胞因子分泌的机制,目前尚不能完全解释清楚,有待进一步研究。

