NEU3对人前列腺癌DU145细胞生物学行为的影响*
王晨霄, 王梦秋, 李 思, 冯 颖, 马 芳, 吴衣论, 王 琳, 马 学
(1四川大学华西医院小儿泌尿外科, 2四川大学华西第二医院出生缺陷与相关妇儿疾病教育部重点实验室, 3四川大学华西基础医学与法医学院, 四川 成都 610041)
前列腺癌是一种发病隐匿、起病缓、对人体健康造成极大威胁的恶性肿瘤,居我国男性恶性肿瘤发病率的第6位,虽然其发病率及死亡率尚不及一些西方国家,但近年来发病率和死亡率有逐渐上升的趋势[1]。前列腺癌在我国的筛查和治疗技术也尚未发展完善[2]。大多数前列腺癌生长进程缓慢,然而,有些肿瘤细胞可从前列腺扩散到身体的其它部位,尤其是骨骼和淋巴结,对全身各系统都有不可逆转的损伤。因此对于前列腺癌细胞凋亡和侵袭力的深入研究,有利于进一步了解前列腺癌的致病机制。
唾液酸酶(sialidase;又称神经氨酸酶,neuraminidase,NEU)是一种可以通过水解α-糖苷键而切断唾液酸与糖蛋白或糖脂上糖复合物连接的糖苷酶,广泛分布在脊椎动物和微生物中,包括病毒、细菌、真菌、支原体和原生动物等[3]。近年来,唾液酸酶在人体中的作用愈发受到关注[1]。除了参与调节生理过程外,唾液酸酶还与很多疾病的发生发展相关,如参与调控肿瘤细胞的增殖分化、侵袭转移以及凋亡过程[4]。研究显示哺乳动物体内的唾液酸酶可被分为4种不同的类型,即神经氨酸酶1(NEU1)、神经氨酸酶2(NEU2)、神经氨酸酶3(NEU3)和神经氨酸酶4(NEU4)。不同类型的唾液酸酶在肿瘤细胞内的分布和功能不尽相同,它们在亚细胞定位、酶学性质及染色体定位上有不同,并以组织特有的方式表达[5]。NEU3定位于细胞的浆膜上,调节细胞凋亡和神经分化。在结肠癌等肿瘤细胞中,NEU3的表达明显上调[6],而这种异常增加与肿瘤细胞的生物学行为密切相关。已知的研究表明,在一些细胞中,NEU3可以增强细胞的增殖能力,增强肿瘤细胞的侵袭能力,抑制细胞凋亡,其它3种唾液酸酶的作用则与之相反[4]。因此,NEU3可能是肿瘤起始、促进和进展一个显著的决定因素,是治疗的一个潜在靶点。然而有关前列腺癌发生发展中,唾液酸酶,尤其是NEU3的作用还未见报道。本文以人前列腺癌DU145细胞为研究对象,探讨NEU3与人前列腺癌DU145细胞的活力、侵袭和凋亡的关系。
材 料 和 方 法
1 实验试剂
人前列腺癌细胞系DU145购自上海博谷生物科技有限公司。DMEM、Opti-MEM和MEM培养基(Gibco);胎牛血清(ScienCell);胰蛋白酶(Invitrogen);2-脱氧-2, 3-二脱氢-N-乙酰神经氨酸(2-deoxy-2, 3-didehydro-N-acetylneuraminic acid,DANA; Santa Cruz Biotechnology);siRNA(锐博生物);Lipofectamine 3000(Thermo Fisher Scientific);TRIzol(Life Technologies);CCK-8和凋亡检测试剂盒(Dojindo);抗NEU3兔单克隆抗体、抗基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)鼠单克隆抗体和抗凋亡抑制因子Bcl-2兔单克隆抗体(Zen BioScience);HRP化学发光底物、Transwell小室和Matrigel(Millipore);丝裂霉素(Sigma);hBcl-2和hNEU3引物(成都擎科梓熙生物技术公司);逆转录试剂盒(TaKaRa)。
2 实验方法
2.1细胞培养与分组处理 DU145细胞在含10% 胎牛血清的DMEM完全培养基中培养,培养箱恒温37 ℃,含5% CO2,饱和湿度。每日观察细胞生长情况,1~2 d换液,待细胞长满至6孔板80%(1.5×105个)左右传代,取生长状态良好的对数生长期细胞进行实验。分为空白对照(blank)组、DANA组和siRNA组,空白对照组用正常培养基培养,DANA组用含1 mmol/L DANA的培养基培养48 h, siRNA组加入NEU3 siRNA转染处理。
2.2RNA干扰靶向沉默NEU3 配制siRNA组培养基:siRNA组培养基每100 μL含siRNA(50 nmol/L) 0.25 μL、Buffer(v2)6 μL、Lipofectamine 3000 0.3 μL、Opti-MEM 5.95 μL和MEM培养基87.5 μL。前后摇动细胞板混合均匀,37 ℃孵育24 h。
2.3CCK-8法检测细胞活力 各组细胞培养于96孔板中,加药处理48 h后,每孔加CCK-8 10 μL,37 ℃避光孵育1~4 h。酶标仪450 nm波长下测定吸光度(A)值,其中每个样品设3复孔。根据公式绘制出标准曲线,计算出各组细胞的活力。
2.4Western blot法检测NEU3、MMP2和Bcl-2蛋白的表达水平 BCA法测蛋白浓度,将蛋白样本与5×Loading Buffer以4∶1的比例配制上样终液,95 ℃变性5 min,配胶(10%分离胶,5%浓缩胶)后进行SDS-PAGE分离(80~100 V,2 h),恒压(70 V,30 min)转膜后将PVDF膜夹至封闭液(5%脱脂牛奶)中,室温封闭1 h。加入 I 抗,4 ℃摇床过夜。回收 I 抗,然后TBST摇动洗膜4次,每次10 min。然后在低速摇床上进行 II 抗孵育1 h,TBST摇动洗膜4次,每次10 min。发光底物按1∶1的比例配制,加入有膜的孵育盒,吹打1 min后,转移到湿润保鲜膜上。用胶带粘于暗盒中进行曝光。Western blot结果应用ImageJ软件进行灰度分析。
2.5Transwell法检测细胞侵袭能力 Transwell小室放入24孔板中,在小室内铺上用PBS 1∶8稀释的Matrigel(50 mg/L),细胞用丝裂霉素处理30 min后消化细胞,细胞计数,铺板于小室内,每孔1.5×104个细胞,小室内无血清培养基,24孔板为30%血清培养基,37 ℃孵育48 h(干扰表达实验)或24 h(过表达实验)后,4%多聚甲醛室温固定10 min,PBS清洗数次,结晶紫染色5 min,PBS清洗后,使用Nickon EclipseTi-U显微镜拍照。
2.6qPCR法检测2种处理方式对凋亡蛋白Bcl-2 mRNA水平的影响 参照TRIzol说明书提取细胞总RNA,随后DNA酶处理去除DNA的影响。逆转录试剂盒合成cDNA。程序为: 37 ℃ 15 min、85 ℃ 5 s、4 ℃ 保存。合成引物进行qPCR扩增,hNEU3的上游引物序列为5’-AATGTGAAGTGGCAGAGGTGA-3’,下游引物序列为5’-TCACAGAGCTGTCGACTCAGG-3’;hBcl-2的上游引物序列为5’-GGTGGGGTCATGTGTGTGG-3’,下游引物序列为5’-CGGTTCAGGTACTCAGTCATCC-3’;hGAPDH的上游引物序列为5’-AACTTTGGTATCGTGGAAGG-3’,下游引物序列为5’-GCCAGTAGAGGCAGGGATGA-3’。用cDNA作为模板,采用SYBR染料荧光标记,Life 7500定量PCR仪检测。
2.7流式细胞术检测2种处理方式对细胞凋亡水平的影响 用PBS洗细胞2次,胰蛋白酶消化细胞,1 000 r/min离心3 min,弃上清。加入PBS后1 000 r/min离心3 min,重复1次后加入1×Annexin V Binding Solution,制成终浓度为1×109/L的细胞悬液。在EP管中加入细胞悬液5 μL和Annexin V-FITC,再加入5 μL的PI Solution。室温下避光培养15 min,加入500 μL 1×Annexin V Binding Solution,1 h内上流式细胞仪检测。
3 统计学处理
所有实验均重复3 次,实验数据用均数±标准差(mean±SD)表示,使用Prism 6 制图和进行数据分析。多组间比较应用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 DANA处理和NEU3沉默后对人前列腺癌DU145细胞NEU3表达的影响
DANA处理和转染NEU3 siRNA后,用Western blot法检测DU145细胞中NEU3蛋白的表达,结果显示,DANA处理前后NEU3蛋白水平变化差异无统计学显著性,而siRNA转染后,NEU3蛋白的表达量明显下降(P<0.01),见图1。因为DANA是在胞外结合蛋白达到抑制效果,不会减少蛋白数量,而siRNA的原理是干扰蛋白表达,故此结果可说明实验的转染效果较好。

Figure 1.The effects of DANA andNEU3 silencing on the protein level of NEU3 in the prostate cancer DU145 cells. Mean±SD.n=3.**P<0.01vsblank group.
图1DANA和NEU3沉默对前列腺癌DU145细胞NEU3蛋白水平的影响
2 DANA处理和NEU3沉默对DU145细胞活力的影响
采取CCK-8法分别观察DANA处理和NEU3沉默处理后DU145细胞活力的变化,结果显示DANA处理与NEU3沉默后细胞活力均增加,且沉默后细胞活力的增加趋势更加显著,两处理组与空白对照组相比差异均有统计学意义(P<0.05或P<0.01),见图2。
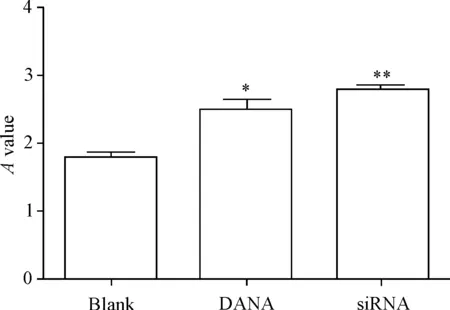
Figure 2.The effects of DANA andNEU3 silencing on the viability of prostate cancer DU145 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsblank group.
图2DANA和NEU3沉默对前列腺癌DU145细胞活力的影响
3 DANA处理和NEU3沉默对DU145细胞MMP2表达的影响
根据Western blot结果,与空白对照组相比,DANA处理后DU145细胞的MMP2表达下降(P<0.05),NEU3 siRNA处理对MMP2蛋白表达的影响差异无统计学显著性,见图3。
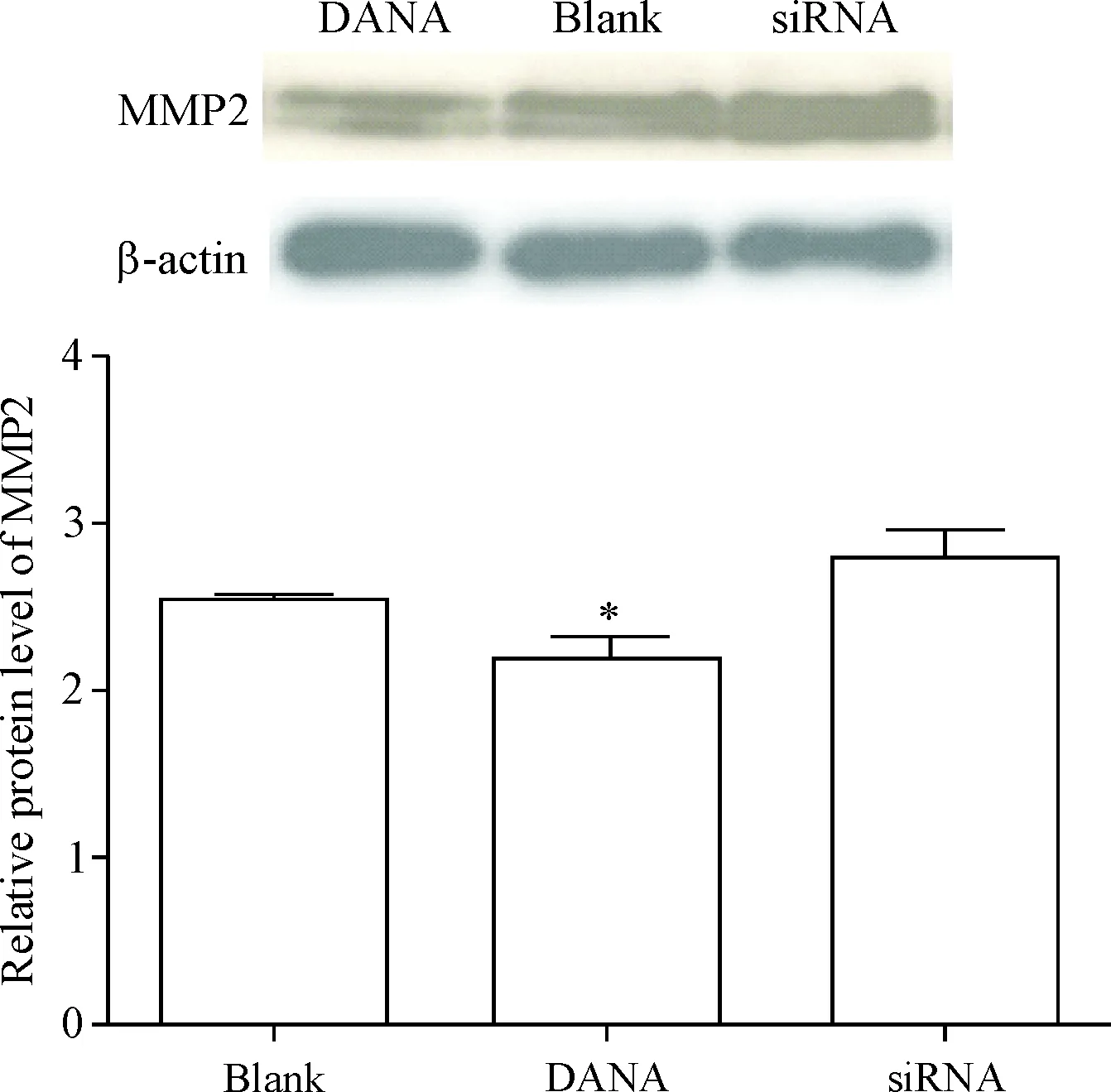
Figure 3.The effects of DANA andNEU3 silencing on the protein level of MMP2 in the prostate cancer DU145 cells. Mean±SD.n=3.*P<0.05vsblank group.
图3DANA和NEU3沉默对前列腺癌DU145细胞MMP2蛋白水平的影响
4 DANA处理和NEU3沉默对DU145细胞侵袭能力的影响
用Transwell实验检测DU145细胞的侵袭能力,与空白对照组相比,用DANA处理后的DU145细胞侵袭力明显降低(P<0.01);NEU3 siRNA处理后细胞侵袭力稍有降低,但差异并无统计学显著性,说明抑制NEU3活性可以抑制细胞侵袭,而抑制NEU3表达则对细胞的侵袭无明显影响,见图4。
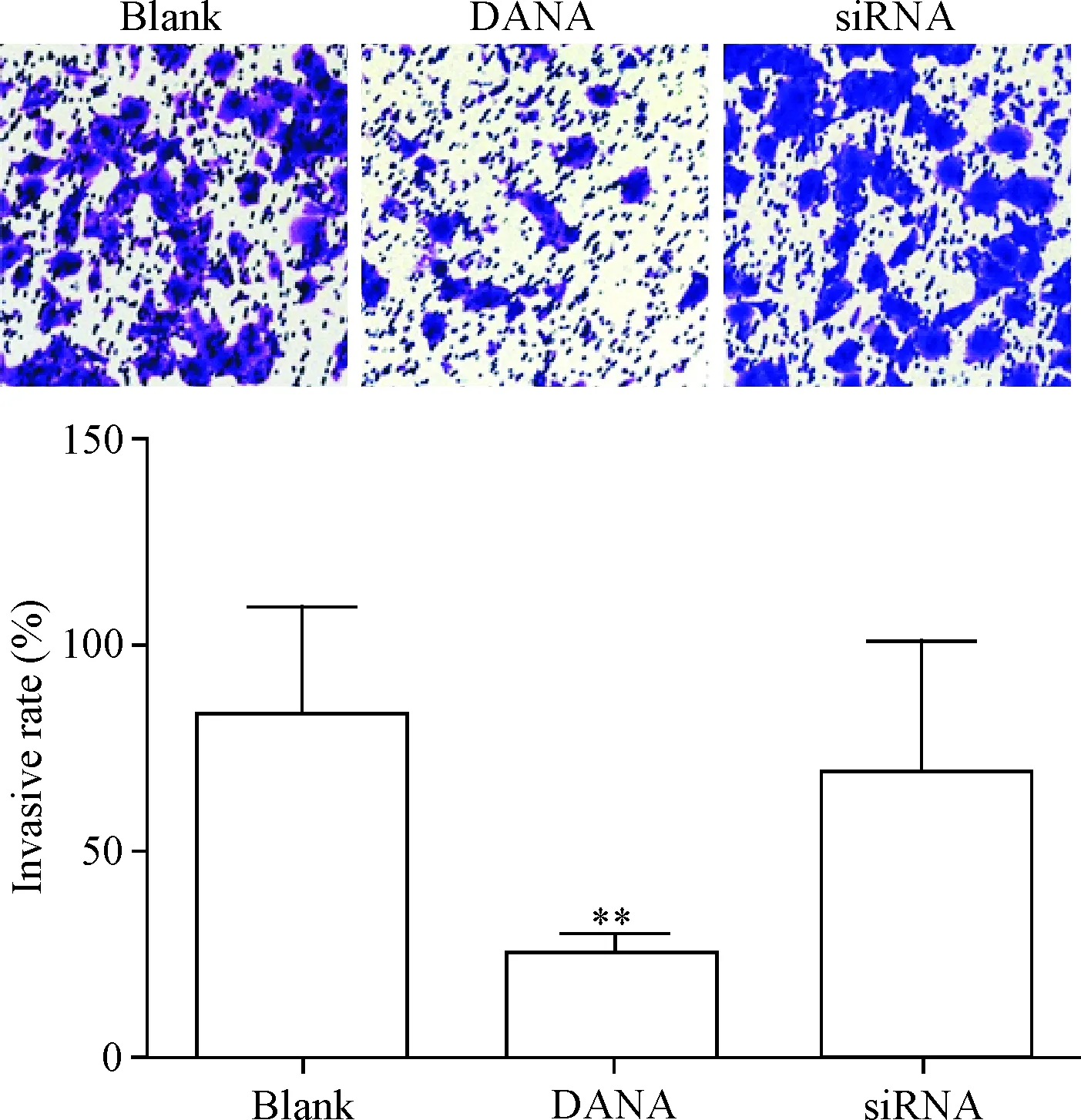
Figure 4.The effects of DANA andNEU3 silencing on the invasion ability of prostate cancer DU145 cells (×200). Mean±SD.n=3.**P<0.01vsblank group.
图4检测DANA和NEU3沉默对前列腺癌DU145细胞侵袭能力的影响
5 DANA处理和NEU3沉默对DU145细胞凋亡能力的影响
Annexin V-FITC/PI双染标记后采取流式细胞术检测各组的前列腺癌细胞凋亡水平,DANA处理后细胞的凋亡水平无明显变化,而经过siRNA处理后细胞凋亡比例明显升高(P<0.05),见图5。
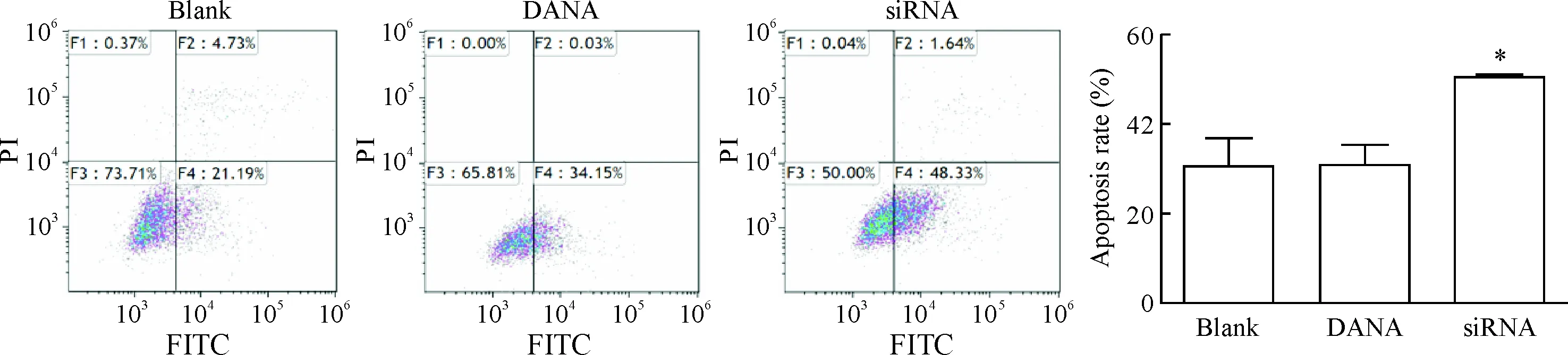
Figure 5.The effects of DANA andNEU3 silencing on the apoptosis of prostate cancer DU145 cells analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vsblank group.
图5DANA和NEU3沉默对前列腺癌DU145细胞凋亡水平的影响
6 DANA处理和NEU3沉默对DU145细胞Bcl-2 mRNA和蛋白水平的影响
应用qPCR方法检测Bcl-2的mRNA水平,DANA处理和RNA干扰后Bcl-2 的mRNA水平均有下降趋势,且DANA处理组更显著(P<0.05)。与空白对照组相比,DANA处理后DU145细胞Bcl-2蛋白表达受到明显抑制,NEU3 siRNA处理对Bcl-2蛋白的表达有下调作用(P<0.05),与qPCR结果一致,见图6。
讨 论

Figure 6.The effects of DANA andNEU3 silencing on the expression of Bcl-2 at mRNA and protein levels in the prostate cancer DU145 cells. A: the mRNA expression of Bcl-2 was detected by qPCR; B: the protein expression of Bcl-2 was determined by Western blot. Mean±SD.n=3.*P<0.05vsblank group.
图6DANA和NEU3沉默对前列腺癌DU145细胞Bcl-2mRNA和蛋白水平的影响
作为一种遗传因素和环境因素共同作用的复杂疾病,肿瘤的确切病因及致病过程还不甚明朗。目前针对肿瘤致病机理的研究多集中在基因水平,癌基因的激活或者抑癌基因的失活以及其它相关调节基因的突变等均是目前研究的焦点[7]。随着人们对生命科学的认识不断深入,糖与人体各种生理和病理过程,特别是肿瘤的相关性越来越受到关注。有关非小细胞肺癌细胞的研究显示,NEU3可通过表皮生长因子受体(epidermal growth factor receptor,EGFR)直接作用于细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路,并且在Akt途径上对EGFR起作用[8];在患头颈部鳞状细胞癌的患者体内,肿瘤组织中的NEU3含量相较正常组织中明显上调,并且MMP9表达增高,提示NEU3提高了头颈部鳞状细胞癌细胞的活性与侵袭力[9]; NEU3作为神经节苷脂的关键调节分子,通过调控Wnt信号通路,与结肠癌的癌变过程有关。研究显示,NEU3在受体水平调节Wnt信号通路,可能在结肠癌细胞干细胞特性的维持过程中发挥重要作用,对Ras/丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路的信号调节可能与肿瘤侵袭水平相关[10];关于HeLa细胞外泌体(exosome)的研究显示,NEU3通过调节负电荷和改变糖蛋白的位阻,提高HeLa细胞exosome的动力生物学特性,因此,exosome表面的NEU3有望成为exosome的检验标志物之一,并且作为细胞间信息与物质传递的重要载体,exosome在生理、病理过程中发挥的作用尚不明确,NEU3可以成为进一步研究exosome的有力工具[11]。
肿瘤之所以对人体有着极大的威胁,与其侵袭能力强及凋亡受抑制等特性有着密不可分的关系,故本次实验将焦点放在NEU3对前列腺癌细胞活力、侵袭及凋亡等生物学行为的影响上。从目前关于NEU3与肿瘤细胞的研究看来,不同部位、不同来源的肿瘤细胞似乎对NEU3的反应不尽相同。本次实验采用DANA处理和siRNA沉默NEU3,采用CCK-8法检测细胞活力,Transwell方法检测细胞侵袭能力,qPCR方法检测Bcl-2的mRNA水平,流式细胞术检测细胞凋亡水平,Western blot方法检测细胞凋亡抑制蛋白Bcl-2和MMP2的蛋白表达水平,结果显示siRNA组细胞活力增强,Bcl-2的mRNA和蛋白表达均减少,而侵袭能力和MMP2水平无变化。根据结果推测,NEU3可以减弱前列腺癌细胞的活力,抑制凋亡能力,而对侵袭能力没有明显的影响,这与基于其它肿瘤细胞的实验结果不完全相同,原因可能与实验选取的细胞株特性有关,也可能与NEU1、NEU2、NEU3和NEU4 4种唾液酸酶的相互作用有关。DANA可以同时抑制4种唾液酸酶的酶活性[12],通过与DANA处理后的结果对比发现,抑制唾液酸酶活性可以抑制DU145细胞的侵袭力,这说明唾液酸酶在肿瘤的侵袭过程中也发挥着重要作用,但其中主导的不是NEU3。其它3种唾液酸酶与肿瘤侵袭能力的关系仍需进一步探索。对于细胞活力,单独抑制NEU3和抑制总的唾液酸酶活性趋势一致,说明NEU3在影响前列腺癌活力的过程中,可能在4种唾液酸酶中起主要作用。根据流式细胞术的检测结果,NEU3沉默后前列腺癌细胞的凋亡水平上升,而同时抑制4种唾液酸酶的活性时无明显变化,显示NEU3在细胞的凋亡过程中起抑制作用,而NEU1、NEU2和NEU4的整体效果与NEU3相反,因此4种唾液酸酶同时作用时对凋亡的影响不明显。而后,我们针对凋亡通路进行了初步探究,肿瘤细胞凋亡抑制蛋白Bcl-2的表达在DANA和NEU3沉默后均明显下降,这与流式细胞术的结果不完全相符。造成此结果的原因可能是外源性细胞凋亡途径或内质网应激凋亡途径等不同通路的相互作用,具体机制仍需进一步进行探究。
哺乳动物的唾液酸酶在各种细胞功能中的作用在很大程度上仍未被探索,部分原因是相对于其它蛋白质的低表达水平和内源性唾液酸酶的不稳定性[13],例如,除了最高度表达的NEU1形式外[14],甚至所有的生理亚细胞定位都尚不清楚。虽然通过cDNA的转染研究提供了亚细胞位点的证据,但重组蛋白的过度表达通常会导致人工干预的失败。因此,进一步明确唾液酸酶的性质与功能,阐明其与肿瘤的关系,具有继续探究的必要性与可行性。

