敲减HMGB1表达对TNF-α诱导的乳腺癌细胞侵袭能力的影响*
马海明, 强 玲, 刘晓康, 张宝轩△
[1广饶县人民医院肿瘤科, 山东 东营 257300; 2山东省肿瘤防治研究院乳腺淋巴瘤科(内十科), 山东 济南 250117]
肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)具有广泛的抗肿瘤作用,而对于其在肿瘤生物学中的作用仍然存在争议。TNF-α是目前常用的肿瘤生物治疗因子,其参与生物机体内的炎症反应和细胞凋亡等过程[1]。研究报道显示,TNF-α可以诱导乳腺癌细胞的凋亡,促进乳腺癌细胞的侵袭和转移[2-3]。高迁移率族蛋白B1(high mobility group box-1,HMGB1)能够调控细胞的DNA重组、细胞自噬和炎性损伤等,并且与肿瘤细胞的多种生物学特性有关,下调HMGB1表达可以减弱乳腺癌MCF-7细胞的侵袭和迁移能力,并诱导乳腺癌细胞凋亡,下调HMGB1在乳腺癌中发挥抑制作用[4-5]。本研究拟通过体外细胞实验,以乳腺癌细胞MDA-MB-231为对象,用小干扰RNA(small interfering RNA, siRNA)敲减乳腺癌细胞中HMGB1的表达,探讨HMGB1对TNF-α诱导的乳腺癌细胞侵袭和迁移能力的影响,为明确HMGB1在免疫微环境中对乳腺癌的作用提供实验依据。
材 料 和 方 法
1 主要材料
HMGB1 siRNA和阴性对照siRNA(siRNA negative control, siRNA-NC)购自Abbexa;荧光定量PCR试剂盒购自TaKaRa;Lipofectamine 2000购自Invitrogen;TNF-α购自Peprotech;胰蛋白酶购自Amresco;兔抗Bax抗体和兔抗HMGB1抗体购自Saierbio;兔抗上皮钙黏素(E-cadherin)抗体购自Novus Biologicals;兔抗基质金属蛋白酶2(matrix metalloprotease 2,MMP-2)抗体、兔抗神经钙黏素(N-cadherin)抗体、兔抗基质金属蛋白酶9(matrix metalloprotease 9,MMP-9)抗体和HRP标记的II抗购自Santa Cruz;GAPDH引物和HMGB1引物为南京金斯瑞合成;细胞凋亡检测试剂盒购自北京索莱宝。
2 方法
2.1细胞分组处理 乳腺癌MDA-MB-231细胞(购自ATCC,用10%胎牛血清的RPMI-1640培养基培养,0.25%胰蛋白酶传代)分为对照(control)组、TNF-α组、siRNA-NC+TNF-α组、HMGB1 siRNA+TNF-α组、siRNA-NC组和HMGB1 siRNA组,其中TNF-α组、siRNA-NC+TNF-α组和HMGB1 siRNA+TNF-α组的细胞于实验开始时在培养液中添加15 μg/L的TNF-α;HMGB1 siRNA+TNF-α组和HMGB1 siRNA组为转染HMGB1 siRNA后的MDA-MB-231细胞; siRNA-NC+TNF-α组和siRNA-NC组为转染siRNA-NC后的MDA-MB-231细胞;control组和TNF-α组为不做转染的MDA-MB-231细胞;control组细胞的培养液中不添加TNF-α。MDA-MB-231细胞转染按照Lipofectamine 2000脂质体转染试剂说明书操作。
2.2实时荧光定量PCR测定HMGB1的mRNA水平 Control组、siRNA-NC组和HMGB1 siRNA组细胞培养24 h以后收集细胞,用细胞总RNA提取试剂盒提取细胞中的总RNA。用分光光度计测定各组样品中的RNA的浓度。以GAPDH为内参照,按照实时荧光定量PCR试剂盒说明书,首先合成cDNA的第一链,然后以cDNA为模板,进行PCR扩增。PCR程序为:95 ℃ 10 min; 95 ℃ 15 s、 60 ℃ 60 s, 40个循环。用2-ΔΔCt法计算各组样品中的HMGB1水平。HMGB1的上游引物序列为5’-GCGAAGAAACTGGGAGAGATGTG-3’,下游引物序列为5’-GCATCAGGTTTCCTTTAGCTCG-3’;GAPDH的上游引物序列为5’-TCATTGACCTCAACTACATGGTTT-3’,下游引物序列为5’-GAAGATGGTGATGGGATTTC-3’。
2.3Western blot测定HMGB1蛋白水平 Control组、siRNA-NC组和HMGB1 siRNA组细胞培养24 h后,加入含PMSF的蛋白裂解液,在冰上放置5 min,使蛋白充分裂解;用细胞刮刀收集细胞,转移到离心管中,放在4 ℃的低温离心机中,14 000 ×g离心20 min。用BCA法对各组蛋白样品进行定量检测。用10%的分离胶进行蛋白电泳,电泳前按照每个泳道中添加40 μg的样品将各组蛋白样品煮沸变性,在浓缩胶中以80 V的电压电泳,当蛋白进入到分离胶以后,用120 V的电压继续电泳至结束。100 V的条件下,在冰上将凝胶上的蛋白电转移到PVDF膜上,封闭,与1∶800稀释后的 I 抗反应以后,与1∶3 000稀释的 II抗结合,以ECL发光,用Quantity One对各自蛋白条带定量分析(GAPDH为内参照)。
2.4流式细胞术测定细胞凋亡 Control组、TNF-α组、siRNA-NC+TNF-α组和HMGB1 siRNA+TNF-α组细胞按照上述方法处理培养24 h后,PBS洗细胞2次,用胰蛋白酶消化各组细胞后,收集细胞沉淀,加入结合缓冲液重悬细胞,再依次添加Annexin V-FITC和PI后,把各组细胞放在避光条件下结合15 min以后,在1 h内上机检测。
2.5Transwell小室法测定细胞的侵袭能力 Control组、TNF-α组、siRNA-NC+TNF-α组和HMGB1 siRNA+TNF-α组细胞按照上述方法处理,用不含血清的培养液把细胞浓度都调整为1×108/L,分别吸取500 μL的各组细胞悬浮液加入基质胶湿化以后的Transwell小室的上室,并且在其下室中添加600 μL含有血清的培养液,培养24 h后,乙醇固定、HE染色以后,在400倍的显微镜下随机选5个视野对侵袭细胞进行计数。
2.6细胞划痕实验测定迁移能力 Control组、TNF-α组、siRNA-NC+TNF-α组和HMGB1 siRNA+TNF-α组细胞融合度超过90%以后,按照2.5方法处理,在长满的细胞底上画一条细痕,并用PBS洗涤2次。添加新鲜的细胞培养液,24 h后,用Image-Pro Plus测定划痕的距离,结果取平均值。以迁移的距离占划痕初始宽度的百分比表示迁移率。
2.7Western blot测定E-cadherin、MMP-2、N-cadhe-rin、MMP-9和Bax的蛋白水平 Control组、TNF-α组、siRNA-NC+TNF-α组和HMGB1 siRNA+TNF-α组细胞按照上述方法处理培养24 h后,用Western blot方法测定E-cadherin、MMP-2、N-cadherin、MMP-9和Bax蛋白水平,方法同2.3。
3 统计学分析
实验数据均采用SPSS 21.0分析。计量资料以均数±标准差(mean±SD)表示。多组间差异的比较用单因素方差分析,多重比较均采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 转染后细胞中HMGB1的表达
转染HMGB1 siRNA后,MDA-MB-231细胞中HMGB1的mRNA和蛋白水平均明显下降(P<0.05),而转染siRNA-NC对乳腺癌细胞中HMGB1的mRNA和蛋白水平没有影响,见图1。
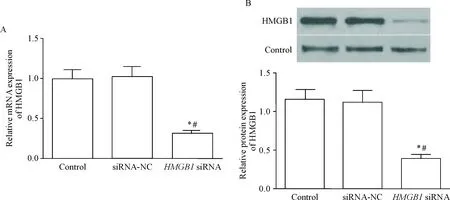
Figure 1.The expression of HMGB1 at mRNA (A) and protein (B) levels in transfected breast cancer cells determined by RT-qPCR and Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC group.
图1RT-qPCR和Westernblot测定转染后的乳腺癌细胞中HMGB1的表达水平
2 敲低HMGB1表达增加TNF-α对乳腺癌细胞凋亡的诱导作用
MDA-MB-231细胞经过TNF-α作用以后,与对照组相比凋亡率明显升高(P<0.05),说明TNF-α可以诱导乳腺癌细胞凋亡;转染HMGB1 siRNA后经TNF-α处理,细胞凋亡率更高(P<0.05),敲减HMGB1表达和TNF-α刺激可以共同诱导乳腺癌细胞凋亡,见图2。
3 敲减HMGB1表达减弱TNF-α对乳腺癌细胞侵袭的诱导作用
MDA-MB-231细胞经TNF-α处理后侵袭细胞的数目较对照组明显增多(P<0.05),说明TNF-α诱导乳腺癌细胞侵袭;转染HMGB1 siRNA后经TNF-α诱导的侵袭细胞数目减少(P<0.05),说明HMGB1 siRNA可以减弱TNF-α诱导的乳腺癌细胞的侵袭能力,见图3。
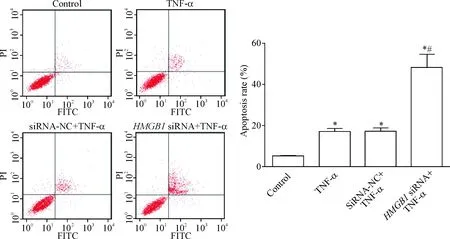
Figure 2.The apoptosis rate in each group analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC+TNF-α group.
图2流式细胞术测定各组细胞的凋亡水平
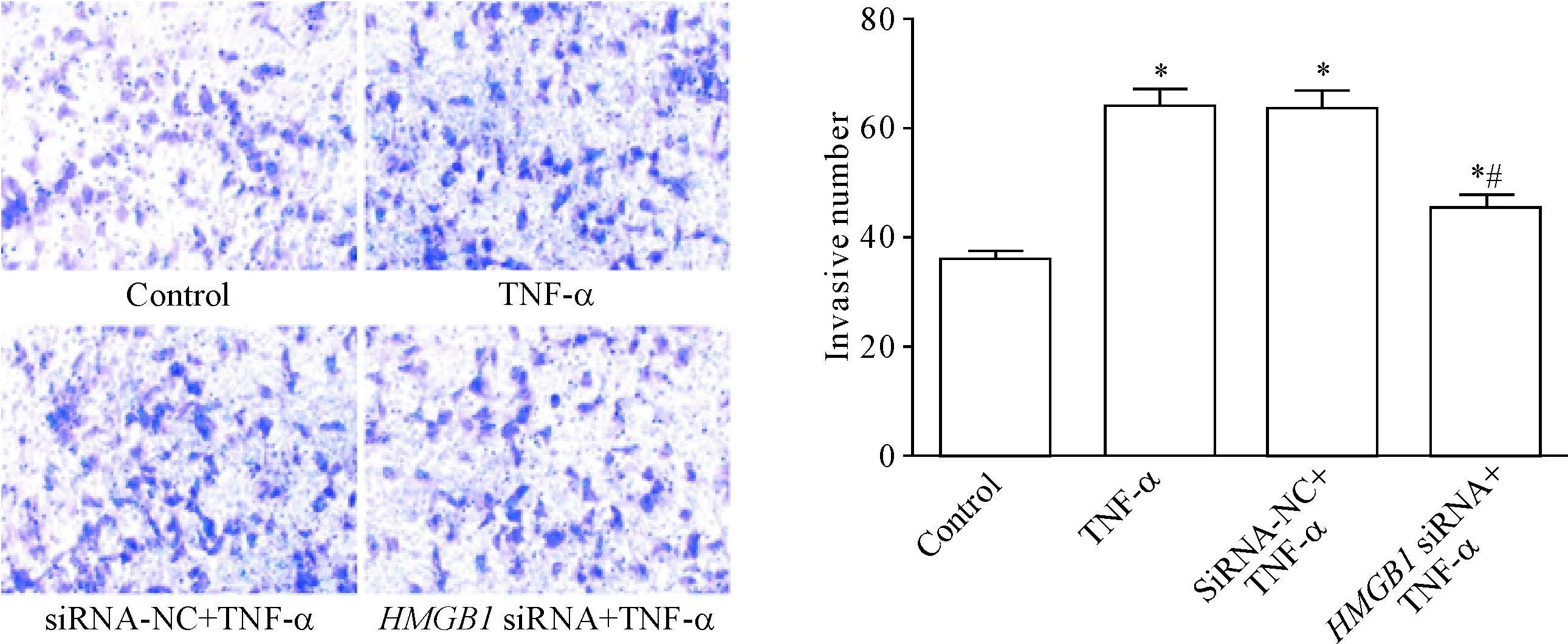
Figure 3.Transwell chamber determination of the invasion ability of breast cancer cells in each group (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC+TNF-α group.
图3Transwell小室测定各组乳腺癌细胞的侵袭能力
4 敲减HMGB1表达减弱TNF-α对乳腺癌细胞迁移的诱导作用
MDA-MB-231细胞经TNF-α处理后的迁移率明显升高(P<0.05),说明TNF-α诱导乳腺癌细胞迁移;转染HMGB1 siRNA后经TNF-α诱导的细胞迁移率降低(P<0.05),说明HMGB1 siRNA可以降低TNF-α诱导的乳腺癌细胞的迁移能力,见图4。
5 敲减HMGB1表达减弱TNF-α对乳腺癌细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)的诱导作用
经TNF-α处理后MDA-MB-231细胞中的上皮细胞标志蛋白E-cadherin表达下调,而间充质细胞标志蛋白N-cadherin表达升高(P<0.05),提示TNF-α诱导乳腺癌细胞EMT;转染HMGB1 siRNA后经TNF-α诱导的细胞中上皮细胞标志蛋白E-cadherin表达升高,而间充质细胞标志蛋白N-cadherin表达降低(P<0.05),说明HMGB1 siRNA可以抑制TNF-α诱导的乳腺癌细胞EMT,见图5。
6 敲减HMGB1表达对TNF-α作用的乳腺癌细胞MMP-2、MMP-9和Bax蛋白表达的影响
MDA-MB-231细胞经TNF-α处理后MMP-2、MMP-9和Bax蛋白的表达水平升高(P<0.05);转染HMGB1 siRNA后经TNF-α处理细胞中的MMP-2和MMP-9蛋白表达水平降低,而Bax蛋白表达水平升高(P<0.05),说明HMGB1 siRNA对TNF-α处理后的乳腺癌细胞的作用与MMP-2、MMP-9和Bax蛋白表达有关,见图6。
Figure 4.The migration ability of breast cancer MDA-MB-231 cells in each group detected by cell scratch test (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC+TNF-α group.
图4细胞划痕实验测定各组乳腺癌细胞的迁移能力

Figure 5.The expression of EMT marker proteins E-cadherin and N-cadherin in breast cancer MDA-MB-231 cells of each group determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC+TNF-α group.
图5Westernblot测定各组乳腺癌细胞中EMT标志蛋白E-cadherin和N-cadherin的表达

Figure 6.The protein expression of MMP-2, MMP-9 and Bax in the breast cancer MDA-MB-231 cells of each group determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC+TNF-α group.
图6Westernblot测定各组乳腺癌细胞中MMP-2、MMP-9和Bax的蛋白水平
讨 论
TNF-α是一种主要由免疫细胞分泌的抗肿瘤因子,其属于跨膜蛋白,在肠炎、关节炎和牛皮癣等自身免疫疾病中具有关键作用[6-7]。肿瘤小鼠模型经过脂多糖或微生物等处理后,TNF-α是主要的免疫反应因子,其可以引起炎症[8-9]。肿瘤的发生过程中,混乱的基因表达和转录引起肿瘤细胞对TNF-α的敏感度增加,导致肿瘤细胞凋亡增多[10-12]。在多种体外实验中发现,外源性的TNF-α可以促进肿瘤的转移,而在体内实验中发现自身接种TNF-α可以减少黑色素瘤小鼠模型的肿瘤转移[13]。李晓敏等[14]的研究报道显示,给予乳腺癌细胞外源性的TNF-α刺激以后,Transwell小室实验中的乳腺癌细胞穿膜数目增加。侯娟[15]在探讨TNF-α对乳腺癌化疗敏感性的研究中发现,TNF-α可以诱导乳腺癌细胞的凋亡,增加其化疗敏感性。本实验结果表明,TNF-α可以诱导乳腺癌细胞MDA-MB-231的凋亡,促进乳腺癌细胞的侵袭和迁移,这与上述实验报道相符。
HMGB1含有一个可以调控转录的C端和2个可以与DNA结合的结构域,其能够与Toll样受体结合,调控多种炎症因子的释放[16]。在细胞受到外界环境的作用后,HMGB1可以促进TNF-α和内毒素等的释放,介导炎性损伤[17]。在肝癌和乳腺癌等多种肿瘤中已经发现HMGB1过度表达,并且可以调控肿瘤细胞的凋亡、侵袭和迁移过程,影响肿瘤细胞释放免疫因子[18-20]。Ni 等[4]通过细胞转染化学合成的HMGB1 siRNA构建下调HMGB1的乳腺癌MCF-7细胞,通过检测HMGB1表达及细胞增殖、凋亡和迁移水平,结果发现,HMGB1沉默抑制人乳腺癌细胞的侵袭和迁移,促进细胞凋亡,提示HMGB1沉默可能是一种潜在的治疗靶点。本实验表明,HMGB1敲低后的乳腺癌细胞经过TNF-α诱导以后,细胞的凋亡水平进一步增加,而细胞的侵袭和迁移能力下降,这说明HMGB1敲低可以与TNF-α共同发挥抗肿瘤的作用,综合上述实验报道,下调HMGB1不仅具有抗乳腺癌作用,还能够与TNF-α协同共同抑制乳腺癌发生。
肿瘤细胞的侵袭、迁移和凋亡等多种生物学特性都受到细胞内多种蛋白的严格调控。Bax是Bcl-2家族中的促凋亡蛋白,其在肿瘤组织中表达下调,而促进其表达后可以诱导肿瘤细胞的凋亡[21-24]。在肿瘤的转移中,肿瘤细胞能够降解细胞外基质的蛋白酶,为肿瘤细胞突破组织屏障提供条件,MMP-2和MMP-9是目前研究发现的能够降解细胞外基质的主要蛋白酶,在多种肿瘤组织中表达升高[25-27]。在肿瘤转移过程中,肿瘤细胞的上皮细胞特性逐渐消失,而间充质细胞特性逐渐增加,这成为肿瘤细胞的EMT,E-cadherin是上皮细胞的标志性蛋白,而N-cadherin是间充质细胞的标志蛋白,E-cadherin在肿瘤组织中表达下调,而N-cadherin在肿瘤组织中表达升高[28-30]。本实验结果显示,TNF-α处理后的乳腺癌细胞中E-cadherin表达水平下降,N-cadherin表达水平升高,TNF-α诱导乳腺癌细胞EMT,并且细胞中的Bax表达升高,MMP-2和MMP-9水平也升高,而下调HMGB1可以抑制TNF-α诱导乳腺癌细胞EMT,降低细胞中MMP-2和MMP-9水平,促进Bax的表达,这提示下调HMGB1可以通过调控细胞EMT及Bax、MMP-2和MMP-9蛋白表达影响TNF-α对乳腺癌细胞的凋亡、侵袭和迁移的影响。

