多囊卵巢综合征患者不同预处理对冻融胚胎移植临床疗效的影响
成海英,谭小军,彭婀娜,蒋云山,许慧,刘佶,朱捷,成小燕,黄向红
(湘潭市中心医院,湘潭 411100)
多囊卵巢综合征(PCOS)患者为了避免重度卵巢过度刺激综合征(OHSS)的发生而取消新鲜周期移植常需行冷冻胚胎移植(frozen/thawed embryo transfer,FET)助孕。而PCOS患者的血清FSH/LH水平多呈倒置状态,高LH水平使子宫内膜提前发生蜕膜化,影响FET时子宫内膜容受性[1]。研究显示,PCOS患者采用性腺激素释放激素激动剂(GnRH-a)或者口服避孕药(Oral contraceptives,OC)达英-35预处理均可以有效地降低LH水平[2-3]。但两种药物均存在优势和缺点:GnRH-a的药物花费相对昂贵,而OC价格便宜但所含孕激素也可能会对内膜容受性产生不利影响[4]。本文将通过比较PCOS患者使用GnRH-a和OC预处理后FET的临床疗效,探讨适合PCOS患者的最佳FET方案。
资料与方法
一、研究对象
选取2015年1月至2017年12月在我院生殖中心行FET助孕的PCOS患者共285例,按内膜准备方案不同分为3组:GnRH-a+HRT组,达菲林调节后联合雌孕激素替代准备内膜,共121例;OC+HRT组,达英-35预处理联合雌孕激素替代准备内膜,共95例;OC+COS组,达英-35预处理后联合控制性促排卵准备内膜,共69例。纳入标准:按照2003年鹿特丹标准[5]诊断的PCOS;所有患者均LH/FSH>2;均为第一次FET移植。排除标准:双方中的一方存在染色体异常;女方存在宫腔粘连、子宫内膜异位症、输卵管积水等器质性疾病者。
二、方法
1.内膜准备方案:GnRH-a+HRT组:(1)GnRH-a降调节:月经周期或者黄体酮撤药后阴道出血第2~3天给予注射用醋酸曲普瑞林(达菲林,3.75 mg/支,益普生,法国)1.875 mg,注射后14 d复查血性激素及阴道B超,若达到降调节标准,即雌二醇(E2)<159 pmol/L、FSH<5 U/L、LH<5 U/L、子宫内膜厚度<5 mm、卵泡直径<5 mm,采用常规雌孕激素替代准备内膜(具体同下)。若未达到降调节标准,则再次给予达菲林1.5 mg,注射后14 d再次复查直到达到降调节标准。(2)雌孕激素替代(HRT)法:降调后给予口服戊酸雌二醇 (补佳乐,1 mg/片,拜耳,德国)3 mg 2次/d,连续5 d,5 d后阴道B超监测子宫内膜,如子宫内膜厚度>8 mm时,继续原剂量服用3 d;如子宫内膜厚度<8 mm时,增加补佳乐至4~5 mg,2次/d,连续5~10 d,复查B超内膜厚度达8 mm转化内膜。转化时阴道给药黄体酮软胶囊(0.1 g/粒,法杏制药,法国)0.4 g/d,连续2 d,后改为0.6 g/d服用1 d,同时口服地屈孕酮 (达芙通,10 mg/片,苏威制药,荷兰)20 mg/d,连续2 d,后改为30 mg/d服用1 d,3 d后行FET。
OC+HRT组:(1)OC预处理:在月经周期或者黄体酮撤药后阴道出血第2~3天给予炔雌醇环丙孕酮片(达英-35,拜耳,德国),连续口服21 d,停药后月经来潮第3天复查血性激素及阴道B超,若LH/FSH≤1、卵泡直径<5 mm、子宫内膜厚度<5 mm时,采用常规雌孕激素替代准备内膜。若未达到预处理标准,则再次给予达英-35,停药后月经来潮第3天复查直到达到预处理标准。(2)后续HRT法同GnRH-a+HRT组。
OC+COS组:(1)OC预处理法同OC+HRT组;(2)控制性促排卵(COS)法:月经周期或者黄体酮撤药后阴道出血第3天开始口服来曲唑2.5 mg/d,1次/d持续5 d,月经第8天开始B超监测卵泡发育和子宫内膜情况,酌情加用尿促性素,当主导卵泡直径达16 mm,每天抽血查LH、E2、P,当卵泡直径达18 mm或LH≥10 U/L,肌肉注射HCG 10 000 U,排卵后给予支持黄体,3 d后行FET。
2.胚胎冻融方法及评分标准:可利用胚胎均采用快速玻璃化冷冻方法进行冷冻保存,于FET日上午复苏胚胎,胚胎培养4~5 h后移植。解冻后胚胎存活的细胞数>50%总细胞数,认为胚胎存活,可进行移植。本中心优质胚胎标准:复苏后卵裂球细胞数≥7、卵裂球大小一致、胞质均匀,细胞碎片<20%的胚胎。
3.妊娠判定:胚胎移植14 d后查血HCG确定是否妊娠,移植后28 d阴道超声检查,有孕囊者诊断为临床妊娠。
三、统计学分析
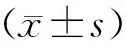
结 果
一、患者一般资料比较
三组患者间年龄、不育年限、BMI、基础性激素水平均无统计学差异 (P>0.05),但GnRH-a+HRT组激素替代日LH/FSH值、E2水平显著低于OC+HRT组和OC+COS组 (P<0.001)(表1)。
表1 三组患者一般情况比较
注:与其他两组相比,*P<0.001
二、三组患者的临床结局
统计结果显示,三组间黄体酮转化日内膜厚度、平均移植胚胎数、移植优胚率、种植率、临床妊娠率、早期流产率、异位妊娠率均无显著性差异(P>0.05);但OC+HRT组因子宫内膜薄,周期取消率显著高于GnRH-a+HRT组和OC+COS组(P<0.05);GnRH-a+HRT组使用雌激素增殖内膜的天数、预处理加内膜增殖药物总费用显著高于OC+HRT组和OC+COS组(P<0.05);另外OC+COS组出现2例轻度卵巢过度刺激综合征,均为移植术后出现轻度腹胀(表2)。
三、OC预处理时间对妊娠结局的影响
为比较OC预处理对妊娠结局的影响,将OC+HRT组根据OC处理的周期长短,又分成了三组,组间统计分析结果显示,OC治疗≥3个周期因子宫内膜薄周期取消率显著高于OC治疗1个周期和2个周期(P<0.001);OC治疗≥3个周期临床妊娠率低于OC治疗1个周期和2个周期,但差异无统计学意义(P>0.05)(表3)。

表2 三组临床结果比较
注:△取消周期率=因子宫内膜薄取消移植周期数/进入内膜准备周期数。与其他两组相比,*P<0.05
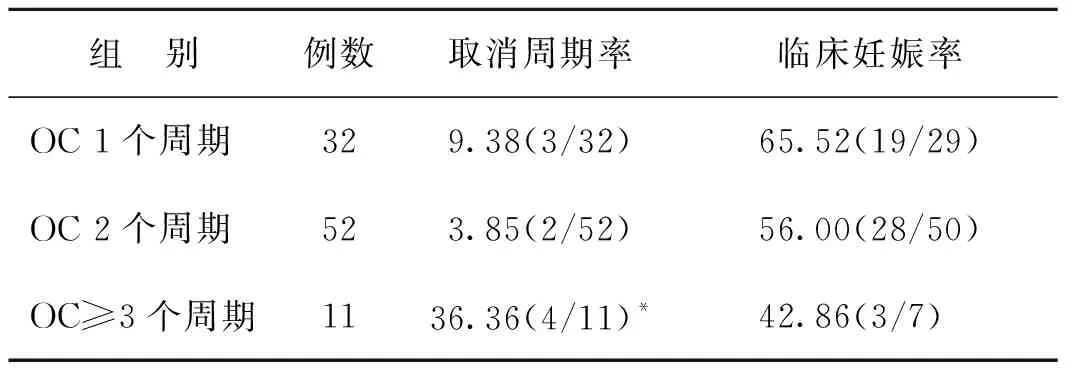
表3 OC+HRT组不同预处理时间临床结果比较(%)
注:与其他两组相比,*P<0.001
讨 论
PCOS患者在超促排卵过程中多个卵泡发育,获卵数和胚胎数偏多,在FET移植时往往有优质胚胎(本研究中所有患者均至少有1个优质胚胎移植),故选择合适的内膜准备方式对于改善子宫内膜容受性,进而影响FET成功率具有重要意义。PCOS患者由于月经周期不规律、排卵障碍,常采用HRT和促排准备内膜,而PCOS患者的血清FSH/LH水平多呈倒置状态,高水平LH可激活腺苷酸环化酶和磷酸酶C信号通路,使得子宫内膜提前发生蜕膜化,影响子宫内膜容受性[5]。在本研究中,使用GnRH-a和OC均使患者LH水平显著下降,改变血清FSH/LH水平倒置状态,可以改善PCOS患者高LH对内膜容受性的损害。
一、GnRH-a降调节对PCOS患者FET的影响
大量研究表明,GnRH-a可改善子宫内膜容受性[6],主要机制为:(1)整合素αVβ3通过介导滋养层细胞与子宫内膜上皮细胞之间的作用参与胚胎黏附,而GnRH-a可以增加子宫内膜整合素αVβ3的分泌[7];(2)研究发现,转化生长因子(TGF)可抑制滋养细胞的侵袭,而GnRH-a能够通过干扰TGF-β受体信号转导途径,阻止了TGF引起的脱膜细胞凋亡[8];(3)研究显示,使用超长方案治疗后IVF患者的着床率提高,考虑因较长时间的闭经使子宫内膜中胞饮突数量增多[9]。
本研究中GnRH-a作用14 d左右可以达到有效的垂体降调节,相对以往大部分研究中作用28~35 d后HRT,本研究明显缩减了FET周期内膜准备的时间,方便患者。本研究中三组患者早期流产率无统计学差异,说明即使在注射1.5 mg GnRH-a后垂体功能需要40~45 d恢复正常,但充足的黄体支持后降调节对早期妊娠未造成不利影响。
本研究结果显示,达菲林降调节后血清LH/FSH值、E2水平明显低于达英-35治疗后,提示多囊卵巢综合征患者使用达菲林预处理改变LH/FSH比例失调的效果明显优于口服避孕药。考虑到达菲林组过低的E2水平不利于胚胎着床[10],采用了雌激素递增方法,而低水平的雌二醇导致GnRH-a+HRT组使用雌激素增殖内膜的天数明显增多OC+HRT组,且预处理加内膜增殖药物总费用更昂贵。但GnRH-a+HRT组患者因子宫内膜薄取消移植周期率明显低于OC+HRT组,提示GnRH-a处理后子宫内膜对雌激素反应性更好,内膜生长更佳。
二、OC的预处理对PCOS患者FET的影响
研究发现口服避孕药达英-35同时有抗雄激素和孕激素作用,提高血浆性激素结合蛋白水平从而降低游离雄激素,改善PCOS患者子宫内环境及全身内分泌状态[11]。因此PCOS患者行IVF-ET前应用OC预治疗,虽然延长了治疗周期,但是由于改善了PCOS内分泌紊乱状态,同时由于卵巢反应性的改善,Gn用量的减少,也使得OHSS风险明显降低,用药费用也大大降低[12],从而认为,PCOS患者行IVF-ET前应用OC预处理是一种简单、经济、有效的方法。但Grow等[13]研究发现,患者应用OC后较自然周期子宫内膜变薄,可能导致着床失败。而Duvan等[14]的研究提示年龄大的妇女在促性腺激素释放激素拮抗剂方案IVF-ET前使用OC可导致子宫内膜变薄,而对年轻的妇女子宫内膜的厚度并无影响。因此,是否应用口服避孕药预处理目前仍有争议。
在本研究中,虽然三组比较子宫内膜厚度无明显差异,但OC+HRT组因子宫内膜薄周期取消率明显高于GnRH-a+HRT组、OC+COS组,提示口服避孕药后采用雌激素替代治疗子宫内膜反应不佳,在OC治疗≥3个周期更为明显。可能的机制为:OC治疗后次月周期中,胚胎种植窗的子宫内膜血管内皮细胞的体积百分比下降,自身内膜的体积百分比下降,推测停用OC的短期内,避孕药中某些成分对子宫内膜生长过程的影响尚未消除,使用周期时间越久影响越大[15]。本研究中口服避孕药对子宫内膜生长的不利影响在OC+COS组并未体现,考虑为本研究对象均为PCOS患者,促排时大多数患者为多卵泡发育,雌激素水平较高,抵消了避孕药中某些成分对子宫内膜生长过程的影响。
综上所述,对于PCOS患者行FET时采用GnRH-a降调节后替代周期和达英-35预处理后替代周期或促排方案准备内膜,均可获得满意的种植率和临床妊娠率。但达英-35预处理影响了下周期HRT子宫内膜的增长,增加因子宫内膜薄的周期取消率。而使用促排卵方案有移植后卵巢过度刺激风险。因此,GnRH-a降调节虽然价格昂贵,但可作为PCOS患者更有效、安全的冻融胚胎移植内膜准备方案。

