先天性子宫囊肿的临床病理学特征分析
程晓彤,田秦杰,邓姗*
(1.中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730;2. 沈阳市妇婴医院,沈阳 110011)
女性胚胎发育中,由于卵巢不能分泌副中肾管抑制因子(Müllerian inhibiting factor,MIF)和睾酮,导致副中肾管发育而中肾管退化,两侧副中肾管的上段形成双侧输卵管,中下段融合形成子宫、宫颈及阴道上段。中肾管或副中肾管的胚胎残迹可在多部位形成囊肿[1],先天性子宫囊肿(congenital uterine cyst)即为其中一种表现形式,在1850年首次报道,十分罕见,至今文献仍为散发病例报道[2-4]。本文对2010年7月至2018年6月北京协和医院妇产科收治的6例先天性子宫囊肿手术患者的临床资料进行回顾性分析,以进一步了解其临床特点和病理学特征,为临床诊治提供线索。
临床资料与结果
一、方法
应用关键词“子宫囊肿”、“子宫体囊肿”、“子宫肌壁囊性肿物”、“子宫浆液性囊腺瘤”对2010年7月至2018年6月北京协和医院妇科住院手术患者病历进行检索。共检索出19份相关病历;详细查阅病历内容及病理结果,其中6例为子宫肌瘤囊性变、3例为囊性子宫腺肌病、2例为子宫间皮囊肿、1例为子宫壁子宫内膜异位囊肿、1例为子宫切口瘢痕憩室,排除上述13例病例,剩余6例病理符合先天性子宫囊肿。分析其临床特征、手术方式及病理结果。
二、结果
6例患者均为绝经前女性,中位年龄35.5岁,均已生育、未绝经。除1例患者以“左下腹隐痛”为主诉外,其余均无显性临床症状。超声检查均提示盆腔或附件区无回声,部分可见分隔,无丰富血流。CA125均在正常范围,中位值19.1 U/ml。
除1例术前诊断为子宫体部囊肿外,其余术前考虑为非特异性附件肿物的有4例、子宫肌瘤变性1例。术中证实子宫囊肿位于宫体部,均不与宫腔相通。除病例1合并子宫畸形(左侧单角子宫,右侧残角子宫)(图1E)外,均未发现泌尿生殖系统畸形。6例患者均行腹腔镜下子宫囊肿切除术(表1)。术后电话随访3月~8年,均未发现子宫囊肿复发。
术后病理诊断子宫中肾管来源囊肿(图1A)3例,副中肾管来源囊肿(图1B)3例。中肾管来源囊肿位于在子宫侧方或侧后方,单发,可多房(2例多房,1例单房)(图1C);副中肾管来源囊肿位置不固定,单发或多发,均为单房(图1D);囊肿最大径线4.0~7.0 cm,中位值5.5 cm,囊肿均壁薄,光滑,内为清亮液体。
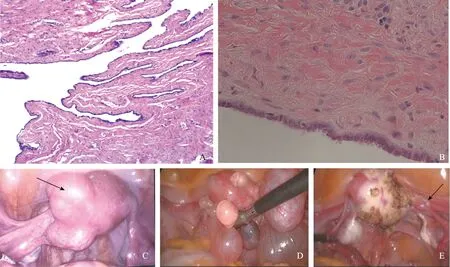
A:中肾管来源:单层立方或矮柱状上皮,间质内平滑肌组织(HE染色 ×100);B:副中肾管来源:纤毛柱状上皮,间质内平滑肌组织(HE染色 ×400);C:子宫左侧壁近宫角处单发多房囊肿(箭头示);D:病例1子宫囊肿布满子宫前后壁;E:病例1 囊肿切除后见右侧残角子宫(箭头示)图1 先天性子宫囊肿术后病理及术中所见
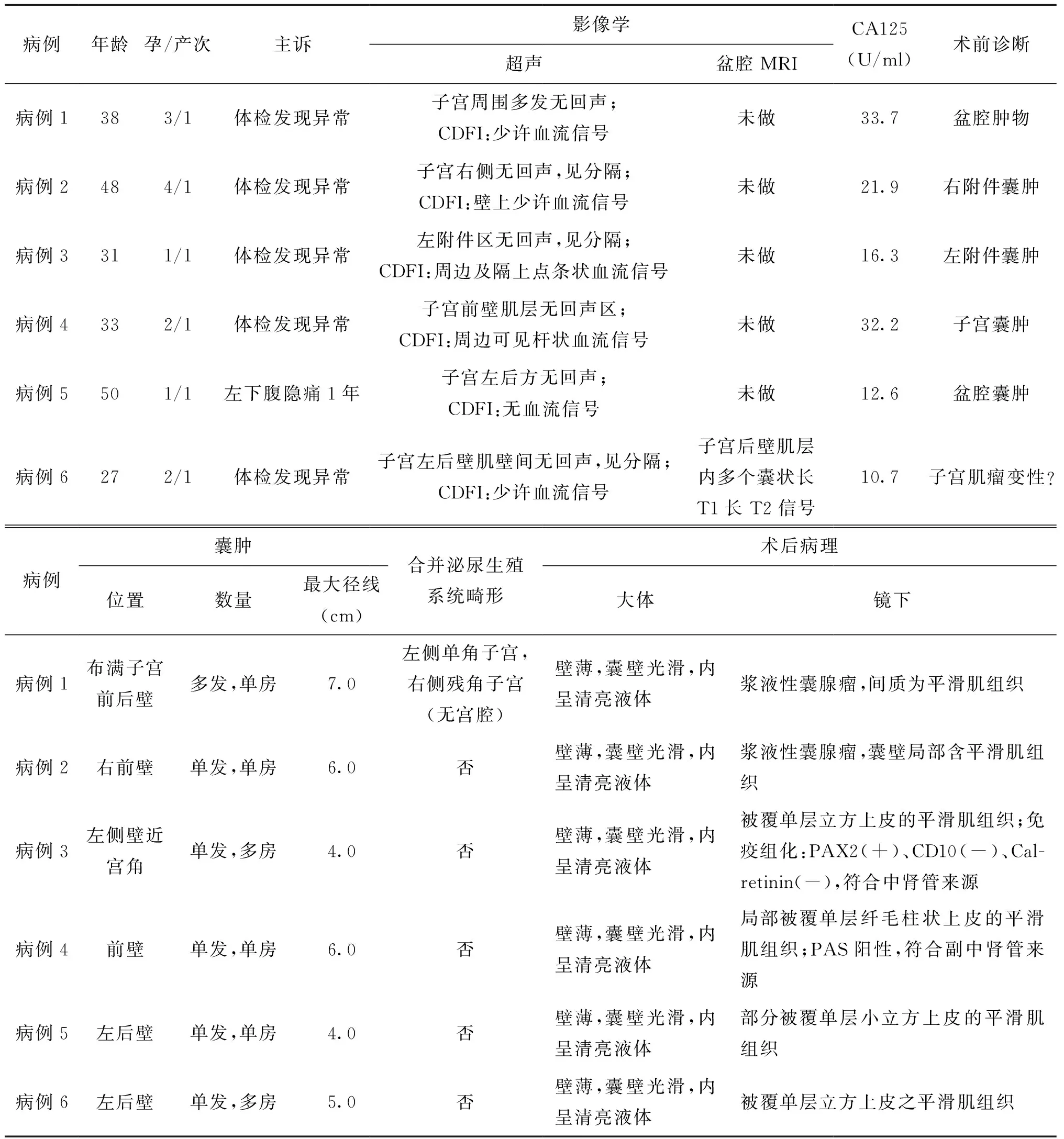
病例年龄孕/产次主诉影像学超声盆腔MRICA125(U/ml)术前诊断病例1383/1体检发现异常子宫周围多发无回声;CDFI:少许血流信号未做33.7盆腔肿物病例2484/1体检发现异常子宫右侧无回声,见分隔;CDFI:壁上少许血流信号未做21.9右附件囊肿病例3311/1体检发现异常左附件区无回声,见分隔;CDFI:周边及隔上点条状血流信号未做16.3左附件囊肿病例4332/1体检发现异常子宫前壁肌层无回声区;CDFI:周边可见杆状血流信号未做32.2子宫囊肿病例5501/1左下腹隐痛1年子宫左后方无回声;CDFI:无血流信号未做12.6盆腔囊肿病例6272/1体检发现异常子宫左后壁肌壁间无回声,见分隔;CDFI:少许血流信号子宫后壁肌层内多个囊状长T1长T2信号10.7子宫肌瘤变性?病例囊肿位置数量最大径线(cm)合并泌尿生殖系统畸形术后病理大体镜下病例1布满子宫前后壁多发,单房7.0左侧单角子宫,右侧残角子宫(无宫腔)壁薄,囊壁光滑,内呈清亮液体浆液性囊腺瘤,间质为平滑肌组织病例2右前壁单发,单房6.0否壁薄,囊壁光滑,内呈清亮液体浆液性囊腺瘤,囊壁局部含平滑肌组织病例3左侧壁近宫角单发,多房4.0否壁薄,囊壁光滑,内呈清亮液体被覆单层立方上皮的平滑肌组织;免疫组化:PAX2(+)、CD10(-)、Cal-retinin(-),符合中肾管来源病例4前壁单发,单房6.0否壁薄,囊壁光滑,内呈清亮液体局部被覆单层纤毛柱状上皮的平滑肌组织;PAS阳性,符合副中肾管来源病例5左后壁单发,单房4.0否壁薄,囊壁光滑,内呈清亮液体部分被覆单层小立方上皮的平滑肌组织病例6左后壁单发,多房5.0否壁薄,囊壁光滑,内呈清亮液体被覆单层立方上皮之平滑肌组织
讨 论
一、先天性子宫囊肿的组织学来源
女性生殖系统的发育过程分为性未分化和性分化2个阶段[5]。胚胎第6周近尿囊处的原始生殖细胞逐步迁移至生殖腺嵴,此时两性胚胎同时含有中肾管(Wolffian管)及副中肾管(Müllerian管)两种内生殖器始基,此为性未分化阶段[6]。由于女性胚胎缺少Y染色体及其上的睾丸决定因子(testicular determining factor,TDF),未分化性腺向卵巢方向分化,由于没有来自睾丸支持细胞的副中肾管抑制因子(Müllerian inhibiting factor,MIF)的抑制作用,副中肾管自动分化发育形成双侧输卵管、子宫、宫颈及阴道上1/3。缺乏来自睾丸间质细胞分泌的睾酮,导致中肾管不发育。中肾管及副中肾管发育过程中的残迹在极少见的情况下内皮仍然活跃,并继续增殖形成囊肿[7],先天性子宫囊肿作为其一种表现形式,在组织学上亦可分为中肾管及副中肾管来源。在女性胚胎中,大部分中肾管会退化,但部分导管组织仍残留于女性生殖系统内,在输卵管系膜中沿子宫、宫颈及阴道两侧壁走行,止于处女膜[8],因此中肾管囊肿多沿子宫、宫颈两侧分布;由于在胚胎发育过程中,中肾管退化和后肾泌尿系统发育毗邻,中肾管囊肿常与异位输尿管、单侧肾缺如或发育不良共存[9]。副中肾管来源的先天性子宫囊肿的发生机制尚不清楚,有学者假设在两侧副中肾管互相融合过程中,部分上皮卷入原始间质中形成憩室,并逐渐与上皮层脱离后演变而来[4],故囊肿通常位于子宫前、后肌壁或子宫底部近中线处[10],但少数报道位于子宫峡部、宫颈或浆膜下有蒂[11],可为单发或多发[1]。双侧副中肾管融合过程中遗留残迹同时亦可发生分化融合异常,形成单角子宫、残角子宫[12]等内生殖器发育异常,本文中例1即为罕见的一例。
二、先天性子宫囊肿的临床病理特征及处理原则
先天性子宫囊肿十分罕见,目前文献均为散发病例报道,发病率尚不明确。多无明显临床表现,多在体检或手术中偶然发现,极少病例因囊肿体积增大出现压迫症状[10]。本文6例患者中5例为体检发现有非特异的异常临床表现,无临床症状,仅1例因左下腹隐痛就诊,术前均未考虑先天性子宫囊肿的诊断。由于先天性子宫囊肿可合并泌尿生殖系统发育异常,因此术前需常规进行相应影像学检查予以明确。先天性子宫囊肿超声表现为低或无回声囊性肿物;盆腔CT表现为囊性薄壁肿块,囊液以低密度为主;盆腔MRI表现为囊壁等T1等T2信号,囊液T1WI为高信号,T2WI信号多变,可以为低信号、等信号或高信号,由囊内蛋白含量多少决定[13]。本文6例患者盆腔超声及例6的MRI结果与之大致相符,但影像学检查多无特征性表现,故术前难以明确诊断。本文中除1例术前考虑子宫体囊肿诊断外,其余均未明确诊断,明确诊断需结合术中情况及病理结果。因组织学来源不同,中肾管来源子宫囊肿多分布于子宫两侧壁,副中肾管来源囊肿通常位于子宫前、后肌壁或子宫底部近中线处,但少数多发,位置不固定,可位于浆膜下或有蒂,本文6例先天性子宫囊肿分布位置符合上述特征。本病可同时合并泌尿生殖系统发育异常,故术中应仔细探查,本文中例1即为多发副中肾管来源先天性子宫囊肿,同时合并左侧单角子宫及右侧残角子宫。
目前,先天性子宫囊肿的病理诊断仍沿用1962年Sherrick和Vega提出的诊断标准[14],见表2。若镜检标本不典型,可通过免疫组化进一步明确:中肾管来源组织免疫组化表现为PAX2(PAX2基因编码中肾管发育必需的转录因子)(+);副中肾管来源组织免疫组化表现为ER、PR(+)、WT-1(Wilms’tumor gene,卵巢、输卵管上皮表达,宫颈、子宫内膜上皮不表达)(+)、PAX8(对Müller管的发育起重要作用)(+)。

表2 先天性子宫囊肿诊断标准[14]
临床处理需根据患者年龄、生育要求及合并症等进行个体化治疗,可行腹腔镜或经腹子宫囊肿切除术或子宫切除术。本文6例患者均为绝经前女性,且无合并需切除子宫的疾病,故手术方式均为子宫囊肿切除术。
三、先天性子宫囊肿的鉴别诊断
先天性子宫囊肿多无明显临床表现及影像学特征,术前极易误诊,应注意与子宫肌瘤囊性变、囊性子宫腺肌病鉴别;另有一些罕见疾病(如输卵管内膜异位症、子宫间皮囊肿)亦无明显症状,且术中所见与先天性子宫囊肿非常相似,需病理明确诊断,亦应注意鉴别。
1.子宫肌瘤囊性变(Fibroid cystic degeneration):子宫肌瘤失去原有的组织结构,肌细胞液化坏死局部形成囊腔。多无明显临床表现,少数合并感染可出现发热及下腹疼痛。超声影像学表现为子宫肌层或邻近位置无或低回声,盆腔MRI显示T1WI、T2WI均为低信号。CA125多在正常范围。术中见肌瘤变软,瘤内出现大小不等的囊腔,与宫腔不相通,内为清亮液体或呈胶冻状。病理表现为玻璃样变的肌瘤组织,内壁无上皮覆盖。
2.囊性子宫腺肌病(Cystic adenomyosis):指子宫内膜异位组织侵入子宫肌层形成直径≥5 mm的充满异位内膜组织和血性液体的囊腔。可发生在13~54岁之间,但以青少年及≤30岁成年女性多见,临床表现除痛经、月经过多、慢性盆腔痛外部分患者可无症状。影像学检查盆腔超声提示子宫肌层内低或无回声,盆腔MRI提示子宫肌层内囊腔,T1WI高信号,T2WI中高信号。CA125大多明显升高。术中见子宫可呈部分突出或均匀增大,病灶直径多为3~5 cm,囊壁厚约5~8 mm,囊腔不与宫腔相通,切开病灶可见巧克力样液体流出,病理表现为囊壁上皮由子宫内膜腺体及间质组成,周围被覆平滑肌组织[15]。
3.输卵管内膜异位症(Endosalpingiosis):这一概念由Sampson于1930年首次提出[16],此病变常伴随子宫内膜异位症及子宫颈内膜异位,因此被称为苗勒系统非肿瘤病变三联征[17],常涉及腹膜和腹膜后淋巴结,少见情况下可位于输卵管外壁、子宫骶韧带、道格拉斯凹和子宫[18]。可见于育龄期及绝经后女性[19]。通常无症状,相关的盆腔症状可能是由同时存在的子宫内膜异位症引起。与先天性子宫囊肿不同,输卵管内膜异位症位于子宫浆膜表面,极少位于子宫肌层,病灶通常很小,偶可为囊性,镜下为多个单纯的腺体,排列单层类似正常输卵管上皮,腺腔内及邻近的间质内常见砂粒体,PAS染色见基底膜完整[20],而副中肾管来源先天性子宫囊肿基底膜不完整,无砂粒体,囊壁包含子宫平滑肌组织。
4.子宫间皮囊肿(Uterine mesothelial cyst):为间皮包含囊肿(mesothelial inclusion cyst,MIC)的一种,非常罕见。MIC在浆膜表面形成,主要见于腹膜,少数位于精索、腹股沟、子宫圆韧带[21]、阔韧带、胸膜及心包腔,极少报道位于肝、脾、子宫[22]。见于20~50岁女性,大多数病例无明显症状,在体检或手术中偶然发现。术中见囊肿位于子宫浆膜表面,可单发或多发,基底多较宽,少数带蒂,而先天性子宫囊肿多位于肌壁间,极少出现在浆膜下。镜检囊肿内衬单层扁平或立方间皮细胞,免疫组化CK(+)、calretinin(+)、ER/PR(-),据此可与先天性子宫囊肿鉴别。大部分MIC病理良性,仅个别病例报道显示细胞有丝分裂活跃或细胞异形性。手术多以囊肿切除为主,但术后可表现为多重复发倾向,需严密随访[23]。
先天性子宫囊肿十分罕见,术前常难以诊断。先天性子宫囊肿通常来源于胚胎期中肾管或副中肾管的残迹,多表现为位于肌壁间内衬单层上皮的清亮囊液的囊肿,病理学均为良性,因症状隐匿发病年龄并不很小,似乎不影响生育。术中诊断后切除局部囊肿即可达到治疗目的,结合文献复习极少复发。免疫组化通常是辅助病理学诊断的重要手段。

