不同亚型抗心磷脂抗体和抗β2糖蛋白1抗体与体外受精结局的关系
许咏乐,王家雄,韩慕天,杨慎敏,王玮,李红
(南京医科大学附属苏州医院,苏州市立医院生殖与遗传中心,苏州 215002)
随着辅助生殖技术(ART)的发展,女性患者的妊娠率得到了极大提高,但分娩率却仅有20%左右,其重要原因之一是较高的流产率[1]。流产,尤其是反复流产困扰着众多适孕年龄的女性,然而流产病因十分复杂,超过50%的病例病因不明[2]。已知病因可分为非免疫类,如胚胎染色体或流产夫妇染色体异常、生殖道解剖异常、内分泌异常和感染等病因,而另一类,就是如今逐渐被大家重视的免疫因素引起的流产[3]。免疫因素流产还可以再被细分为自身免疫因素和同种异体免疫因素,自身免疫因素中最常见的就是抗磷脂综合征(antiphosphoplipid syndrome,APS),实验室常用的检测指标有:抗心磷脂抗体(anticardiolipin antibody,ACA)、抗β2糖蛋白1抗体(anti-β2 glycoprotein 1 antibody,anti-β2GP-1)、狼疮抗凝因子(lupus anticoagulant,LAC)[4]。虽然临床检测按免疫分型将ACA与anti-β2GP-1检测细分为IgA、IgM和IgG三种分型,但具体分型与流产的相关性研究很少报道,ACA与anti-β2GP-1具体分型与体外受精(IVF)结局的研究也鲜有报道。本研究通过统计患者623个周期的ACA与anti-β2GP-1不同分型与临床辅助生殖参数,探讨这两种抗体与流产以及IVF结局的关系。
资料与方法
一、研究对象
回顾性分析2016年6月至2017年12月在我院本部生殖与遗传中心就诊、因“不明原因不孕”行IVF治疗的563对夫妇(共623个周期)的临床资料。
二、研究方法
1. 常规IVF程序:促排卵采用本中心常规促排卵方案,冻融胚胎移植采用自然周期或人工周期准备内膜,选择1~2个体外受精后第3或5天胚胎进行移植,移植后常规黄体支持,移植日后12 d测外周血β-HCG,如β-HCG 阳性者移植后35 d左右行阴道B超检测确定临床妊娠。
2. 分组:根据周期类型,将样本分为鲜胚移植周期组和冻融胚胎移植周期组,各组再根据所做的项目不同,分为 ACA IgA组、ACA IgM组、ACA IgG组与anti-β2GP-1 IgA组、anti-β2GP-1 IgM组、anti-β2GP-1 IgG组,观察各项指标与抗体数值的相关性。各组内按其妊娠结局再分为妊娠失败组、流产组与活产组,比较抗体数值组内差异。
3. 观察指标:比较各组间年龄、不孕年限、体重指数(BMI)、基础内分泌等一般情况;对于鲜胚移植周期,观察优质胚胎率、临床妊娠率、流产率、活产率等临床指标;对于冻融胚胎移植周期,着重观察流产率、活产率等指标。
4. ACA与Anti-β2GP-1测定:对入组的行IVF的患者在治疗前抽外周血检测ACA与Anti-β2GP-1,避免IVF治疗过程对抗体数值的影响,ACA与Anti-β2GP-1测定均采用QUANTA Flash©试剂盒(Inova Diagnostics,美国),利用BIO-FLASH 仪器(Inova Diagnostics,美国),采用化学发光免疫分析法对女方血清中的两种抗体进行检测,检测前利用标准品进行定标。
三、统计学分析
结 果
一、一般资料比较
各组间年龄、BMI、不孕年限、基础FSH、基础LH 、基础E2、基础T及基础PRL均无显著性差异(P>0.05)。
二、入选患者不同周期及不同结局分组抗体检测数值比较
冻融胚胎移植周期患者的ACA IgM、IgG组及anti-β2GP-1 IgG组中,流产患者的抗体检测数值均显著高于其余两组患者(P<0.05);虽然鲜胚移植周期患者纳入统计的周期数较少,但ACA IgG组和anti-β2GP-1 IgG组中的抗体检测数值均显著高于其余两组(P<0.05)(表1、2)。
三、鲜胚移植周期患者辅助生殖参数与抗体检测数值相关性分析
将抗体分型检测数值与各项辅助生殖参数进行相关性分析发现,ACA IgA与辅助生殖治疗过程中的Gn持续天数呈负相关(P<0.05),而ACA IgG与获卵数呈显著负相关(P<0.05),抗体数值与其他参数均无显著相关性(P>0.05)(表3)。
四、多因素Logistic回归分析
以妊娠失败为因变量,以女方年龄、男方年龄、不孕年限、平均获卵数、女方BMI、ACA以及anti-β2GP-1为自变量做多因素Logistic回归分析,结果显示女方年龄、男方年龄、不孕年限、获卵数、女方BMI与流产的发生均无统计学关联;而ACA IgM、IgG以及anti-β2GP-1 IgG的升高对流产的发生有统计学关联(P<0.05),即这三个指标高时观察到流产的概率较高(表4)。
表1 冻融胚胎移植周期患者的抗体分型检测数值比较(-±s)
注:与同类抗体其他组比较,*P<0.05
表2 鲜胚移植周期患者的抗体分型检测数值比较(-±s)
注:与同类抗体其他组比较,*P<0.05
表3 鲜胚移植周期患者的生殖参数与抗体检测数值相关性分析(-±s)
注:与其他组比较,*P<0.05
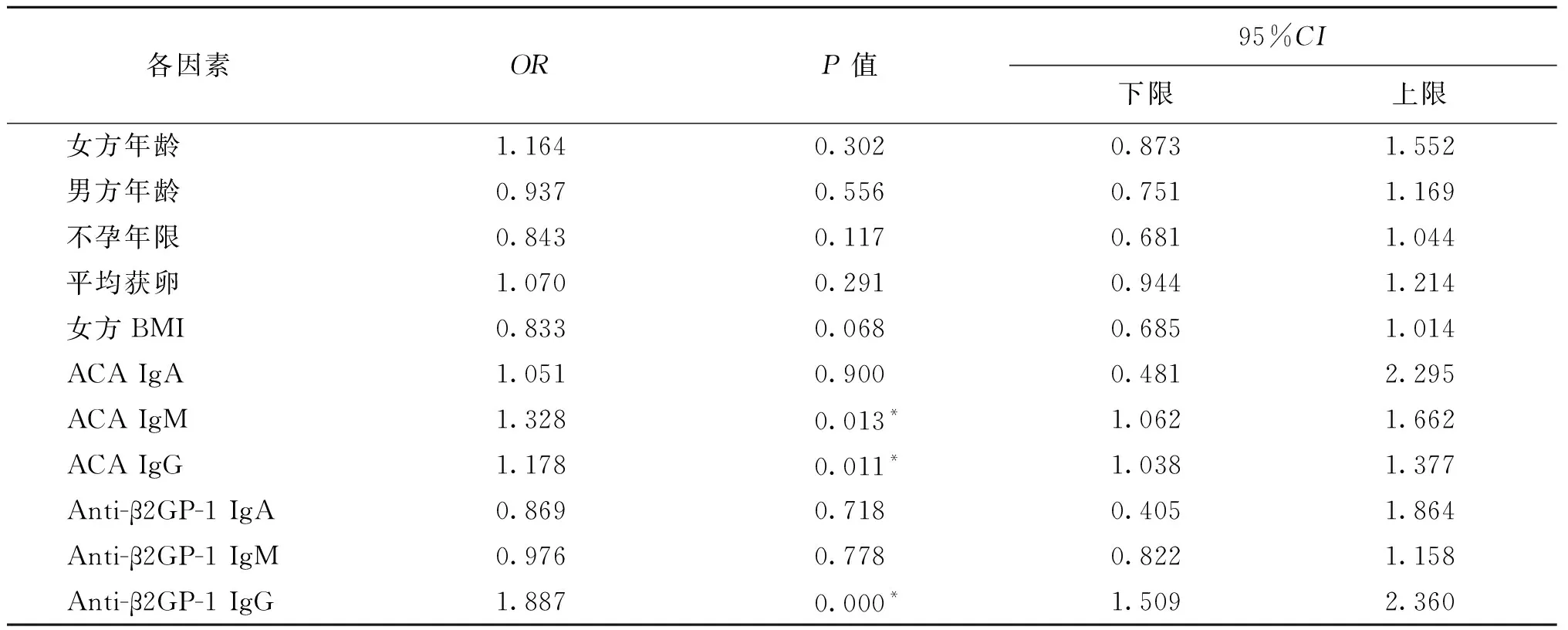
表4 多因素Logistic回归分析各因素对流产的影响
注:*P<0.05
讨 论
抗磷脂抗体(anti-phospholipid antibodies,aPL)是一组能与多种含有磷脂结构的抗原物质发生反应的自身抗体,其中临床检测常用的为ACA和anti-β2GP-1。aPL与不孕症的关联假定在80年代首次被提出,时至今日,在没有明显的关联或有效治疗的情况下,该假定仍然存在很大的争议[5]。最近一篇文献评估了31项研究,统计了女性不孕与aPL的阳性关联,其中45%的研究证实了ACA阳性与不孕之间的关联,当排除了LA测试结果的影响时,这一比率降低至31%,而只有4项研究评估了抗β2GP1抗体,3项报告其与不孕症呈相关[6]。我们此次的研究针对行IVF治疗的不孕女性,对ACA与Anti-β2GP-1的具体分型与IVF结局进行了统计分析,发现冻融胚胎移植周期ACA IgM、IgG组,anti-β2GP-1 IgG组中,流产患者的抗体检测数值均显著高于其余两组患者,而鲜胚移植周期ACA IgG组、anti-β2GP-1 IgG组中的抗体检测数值均显著升高。这一结果得到了国外研究的文献支持,Qublan等[7]发现,相较于其他血栓形成因子,ACA和LA抗体在重复IVF失败的女性中更常见。
虽然通过一系列的动物模型试验,流产胎盘免疫检测以及临床队列等研究已逐渐证实aPL可导致流产,但目前研究者们尚未确定aPL可能诱发流产以及不孕的精确病因机制[8]。对于不孕,一些专家假设aPL可能在分泌到卵泡液后破坏卵母细胞的发育,另一种理论设想aPL可能会干扰子宫蜕膜化,导致植入障碍并最终导致不孕[5]。但我们此次的研究未发现种植率与两个免疫指标的相关性。而对于aPL引发流产的机制,目前已有研究观察到aPL在体外与子宫内膜内皮细胞结合,损害血管生成[9]。同时体内模型也获得了aPL破坏蜕膜组织的证据,aPL IgG处理后的小鼠显示出蜕膜坏死,同时伴有明显的血管内蜕膜IgG和纤维蛋白的沉积[10]。另外还有一些报告认为血栓性紊乱在部分流产患者的病程中也起了重要作用[11]。体外实验证明,anti-β2GP-1能抑制内源性的凝集通路及抑制血小板上的凝血酶原酶的活性,从而引起血栓,继而引发流产[12]。
虽然此次研究没有进一步发现ACA与anti-β2GP-1与其他辅助生殖参数的关系,但是有趣的是,我们发现ACA IgG的数值与获卵数呈负相关。迄今为止,关于APS女性生育率的研究中只有两项评估了aPL阳性和APS的女性卵巢储备的关系[5]。2014年,一项横断面研究评估了18例APS女性和24例健康对照者的卵巢储备,发现APS患者显示出与对照受试者相似的AMH,FSH,LH和E2水平,但诊断为APS的女性,其窦卵泡超声计数较低[13],这与我们的数据相符。另一项研究则是发现ACA、anti-β2GP-1、LA与aPS的三种免疫分型与AMH存在显著关联,而AMH是卵巢储备的重要标志,从而间接推测aPL对卵巢储备的影响。虽然此次我们还发现了ACA IgA对Gn持续天数的影响,但是这并未得到过往文献的支持,其意义仍有待后续实验验证。
anti-β2GP-1是临床检测免疫因素引发的流产的重要指标,检测其不同免疫分型可以避免漏筛隐匿性的自身免疫因素。此次研究发现对于流产的预示作用,IgG分型似乎最好,IgM也有其重要作用,而IgA作为补充,预示作用不及另两个免疫型,这从三种抗体免疫亚型的特征上也很好解释。据文献报道,反复流产患者和不孕症患者的ACA 多以IgG 和IgM 形式存在,IgM型ACA 患者易患血栓症显著高于IgG 型ACA 患者,若同时检出ACA IgA,一般预示病情较重[14]。
目前虽然APS在复发性流产病例中所占比例仅为2%~15%左右[4],但因其病因难以诊断,治疗难以开展,导致后果十分严重,必须引起临床的高度重视。针对自身免疫引起的流产,临床采用免疫抑制疗法[3]和抗凝疗法[15],效果也较为理想,但仍有学者对其持保守态度,虽然此次我们的实验结果与以往的一样,支持流产与aPL之间的关联,但我们同样认为需要更多研究、更有说服力的数据,通过国际诊断共识标准的确定或标准化核心实验室检测结果的发布,进一步的确定检测和治疗方案。

