高脂高糖饮食暴露诱导大鼠多囊卵巢综合征研究
古兰·托合提木拉提,叶尔努尔·吐苏甫汗,马玉兰,玛依努尔·尼亚孜
(1.新疆自治区人民医院,乌鲁木齐 830001;2.新疆医科大学第二附属医院,乌鲁木齐 830001)
肥胖与女性的生殖功能障碍和不孕有关,肥胖女性比正常体重的女性更容易出现多囊卵巢综合征(PCOS)、月经不调等问题。PCOS是女性不孕症最常见的原因,研究发现约40%~80%的PCOS患者肥胖[1]。肥胖和PCOS均存在多种合并症,如高胰岛素血症、胰岛素抵抗以及其他代谢紊乱等[2]。此外,研究表明肥胖可进一步加剧PCOS患者的这些症状[3]。目前低热量和低脂肪饮食是改善PCOS肥胖女性代谢和卵巢功能的有效疗法[4],但很少有研究将饮食本身作为PCOS的潜在病因。有研究发现高脂肪饮食可损害生殖健康并降低啮齿动物的生育能力[5],而因此将高脂饮食与药物诱导PCOS动物模型相结合,但很少有研究单独检测饮食对PCOS及肥胖的发展的影响及两者直接的联系。本研究拟通过高脂肪高糖(high fat and high sugar,HFHS)饮食诱导雌性大鼠PCOS,评估大鼠代谢和生殖特征,以探讨HFHS饮食对PCOS产生和发展的影响。
材料与方法
一、实验动物
23日断奶SPF级Sprague Dawley(SD)雌性大鼠36只购置于新疆医科大学实验动物中心(许可证号:SYXK(新)2013-0003)。饲养温度(22±2)℃,相对湿度(55±5)%,12 h昼夜交替,清洁饲养,自由饮水,环境安静,饲养环境符合SPF要求。
二、试剂与仪器
普通颗粒饲料(100%基础饲料;含65%碳水化合物、21.5%蛋白质、4%脂肪和9.5%其他)和高脂肪饲料(24%基础饲料、18%猪油、18%豆油、32%蔗糖、6%酪蛋白、2%其他)购自于新疆医科大学实验动物中心。
ACS-1.51A电子秤购自于上海友声衡器有限公司。XS205分析天平购自于瑞士梅特勒-托利多仪器(上海)有限公司。血糖仪购自于德国罗氏诊断有限公司。全自动生化分析仪购自于美国Beckman公司。
三、实验方法
1.动物分组及模型制作:23日龄SD大鼠随机分为对照组(n=18)和HFHS组(n=18)。对照组采用普通颗粒饲料,HFHS组采用高脂高糖饲料,分别连续喂养14周。
2.大鼠体重及动情周期监测:每周称重两组大鼠体重并记录。喂养第6~14周对每只大鼠进行阴道涂片检查,用生理盐水(0.9% NaCl)清洗阴道收集阴道壁上的细胞并涂抹在玻片上。在显微镜下检查玻片上的有核上皮细胞、角化上皮细胞和白细胞的相对丰度,观察大鼠动情周期变化。通过发情期、发情间期、发情前期各个阶段持续天数除以整个发情周期天数,计算发情周期各个阶段所占时间比例。
3.卵巢重量及组织学检查:饮食暴露14周后,处死大鼠并分离卵巢。称取卵巢重量后,以卵巢最大平面作为待检面,将其包埋在石蜡中,切成4~5 μm的切片,随后用苏木精-伊红染色后观察。计数每个卵巢囊性卵泡(cyst)和黄体(Corpora lutea,CL)数量。
4.空腹血糖、空腹胰岛素、胰岛素抵抗指数、血清血脂及性激素检测:每组大鼠在同一个发情周期中,分别于禁食过夜后,次日空腹采尾静脉血。使用血糖仪测定空腹血糖(Fasting glucose,FG);采用放射免疫法检测空腹胰岛素(Fasting insulin,FI)。稳态模型胰岛素抵抗指数(HOMA-IR)计算:HOMA-IR =FI×FG/22.5。
采用全自动生化分析仪检测血清总胆固醇(Total Cholesterol,TC)和三酰甘油(Triglycerides,TG);采用放射免疫法测定血清LH、FSH、E2、孕酮(P)、睾酮(T)水平。
四、统计学分析
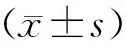
结 果
一、两组体重增长曲线
HFHS组大鼠体重至第3周起显著高于对照组(F=80.17,P<0.001)(图1)。第14周喂养结束时,HFHS组大鼠体重显著高于对照组[(379.0±11.1)g vs. (315.0±6.2)g,P<0.001]。
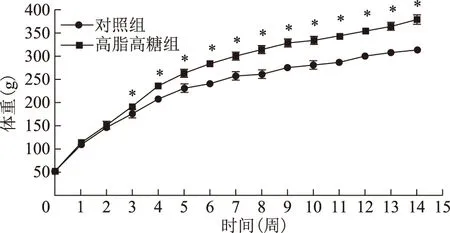
同时段两组比较,*P<0.001图1 两组体重增长曲线
二、两组发情周期变化
阴道涂片评估发情周期发现,HFHS组出现不规则的发情周期和无排卵。第14周喂养结束时,HFHS组发情期持续时间显著长于对照组(P<0.001),而发情前期和发情间期持续时间则显著短于对照组(P<0.001)(表1)。
三、两组卵巢重量和卵巢组织形态学变化
HFHS组的卵巢重量与对照组无统计学差异(P>0.05)。HFHS组卵巢平均囊性卵泡数显著多于对照组,而卵巢平均黄体数显著低于对照组(P<0.001)(表2、图2)。
四、两组空腹血糖、胰岛素、HOMA-IR、血脂及激素水平变化
HFHS组空腹胰岛素和HOMA-IR显著高于对照组(P<0.001),提示HFHS组大鼠也表现出胰岛素抵抗;HFHS组TC显著高于对照组(P<0.001)(表3)。发情间期HFHS组LH和E2水平显著低于对照组(P<0.05),T水平显著高于对照组(P<0.001)(表4)。发情前期HFHS组LH和P水平显著低于对照组(P<0.05),T和E2水平显著高于对照组(P<0.001)(表5)。
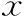
表1 两组发情周期各阶段在发情周期中的时间占比(-±s)
注:与对照组比较,*P<0.001
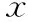
表2 两组卵巢重量和卵巢组织形态学比较(-±s)
注:与对照组比较,*P<0.001
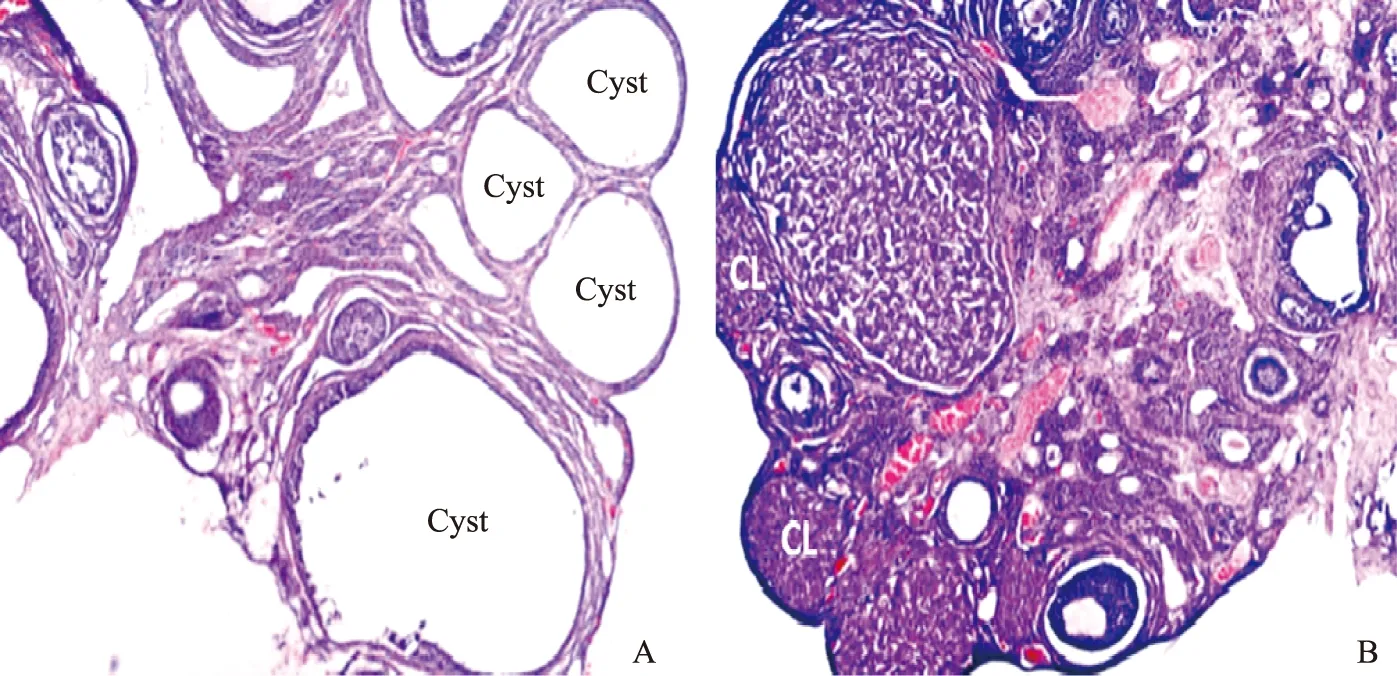
A:HFHS组;B对照组;Cyst:囊性卵泡;CL:黄体图2 两组卵巢组织形态学变化(HE染色 ×100)
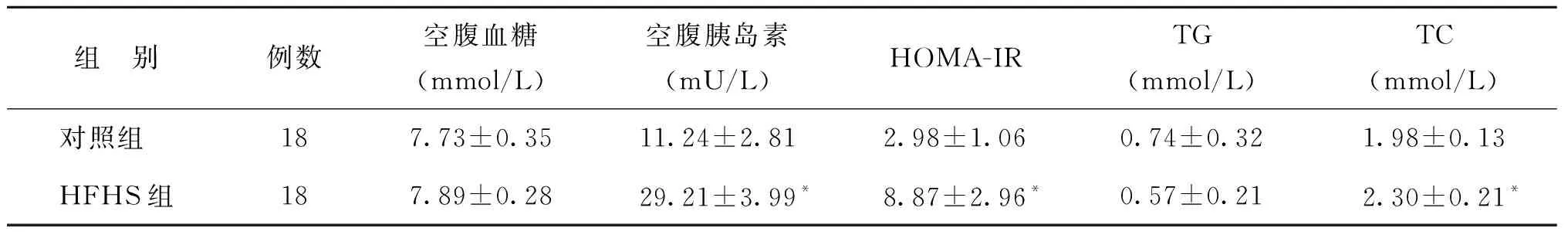
组 别例数空腹血糖(mmol/L)空腹胰岛素(mU/L)HOMA-IRTG(mmol/L)TC(mmol/L)对照组 187.73±0.3511.24±2.812.98±1.060.74±0.321.98±0.13HFHS组187.89±0.2829.21±3.99*8.87±2.96*0.57±0.212.30±0.21*
注:与对照组比较,*P<0.001
表4 两组发情间期激素水平比较(-±s)
注:与对照组比较,*P<0.05,#P<0.001
表5 两组发情前期激素水平比较(-±s)
注:与对照组比较,*P<0.05,#P<0.001
讨 论
饮食诱导的肥胖与女性生殖疾病的发展密切相关。PCOS是一种以生殖障碍和代谢紊乱为特征的妇科疾病。PCOS患者往往体重过重,而且肥胖与PCOS存在一些合并症。此外,饮食本身可能在PCOS发病机制中也发挥重要作用。本研究通过HFHS饮食诱导雌性大鼠肥胖和PCOS,探究HFHS饮食是否能导致PCOS及其相关的代谢紊乱和生殖特征。PCOS诊断的标准为无排卵、高雄激素血症和多囊卵巢。本研究中,HFHS饮食的动物表现出无排卵、多囊卵巢。本研究中睾酮水平在发情前期和发情间期均升高,提示高雄激素血症在此PCOS动物模型中也可能出现。与前人使用雄激素诱导的PCOS动物模型不同,本研究建立的PCOS模型或许更接近人类PCOS疾病病因学。
本研究中HFHS饮食对动物的生殖健康有明显的影响。在动情周期监测期间,HFHS饮食动物表现出异常发情周期,每日阴道涂片显示这些动物已进入持续角化状态。而且HFHS动物在发情期持续时间比对照组长。这种无发情规律的无排卵状态与PCOS患者一致,而且多项研究中也将阴道涂片持续角化状态认为是PCOS啮齿动物不规则发情周期和无排卵的标志物[6]。HFHS动物在发情间期和发情前期持续时间显著比对照组短,表明这些动物的排卵活性降低。此外,HFHS饮食动物的卵巢结构也发生了形态学变化。组织学分析显示多囊卵巢的形成伴随着黄体形成减少,表明排卵活性降低。黄体的形成减少与以前的啮齿动物PCOS模型一致[7]。尽管两组的卵巢重量无统计学差异,但HFHS动物组织中存在大量囊性卵泡,这一结果与以往PCOS动物模型的结果不同,其他多种PCOS动物模型中卵巢重量显著增加[8],这可能与HFHS饮食有关。总之,HFHS饮食不仅会导致动物进入不规则的发情周期,其特征表现在发情期持续时间增加,而且还可通过影响卵泡发育来诱导卵巢结构的变化。
本研究中HFHS组体重显著高于对照组,且表现出高胰岛素血症,这类似于PCOS患者的代谢特征。HFHS可诱导高胰岛素状态具有重要意义,研究显示胰岛素水平升高可导致卵巢卵泡膜细胞的雄激素产生增加[9]。雄激素水平升高与无排卵有关[10],并与异常卵泡成熟和加速大鼠卵泡闭锁有关[11]。尽管过量的雄激素促进了卵泡的早期生长,但它在发育的后期也诱导卵泡发育停滞[12]。雄激素过量可能是由于高胰岛素血症引起的胰岛素信号传导增加或卵巢内类固醇生成改变引起的[13]。本研究中HFHS饮食诱导高胰岛素血症发生,且观察到雄激素水平也增加,与前人研究一致[8]。睾酮水平升高可能是高胰岛素血症发展的继发效应,并在HFHS饮食诱导的PCOS的疾病发生发展中出现。在胰岛素抵抗和高胰岛素血症动物中囊肿发生率高,睾酮水平升高,卵巢内胰岛素信号的增加可能导致卵巢形态改变和卵巢产生雄激素增加[14]。虽然PCOS患者可能发展成胰岛素抵抗,但卵巢仍然对胰岛素信号产生反应以产生雄激素[15]。因此,睾酮水平的升高可能是胰岛素诱导多囊卵巢形成的结果,而胰岛素可能会导致或加速PCOS症状的出现。
受损的胰岛素信号转导可能是高胰岛素血症的副产物,也与LH释放有关。HFHS大鼠在发情前期LH显著降低、E2显著增加。E2水平异常可能与LH波动的破坏有关。这可能表明排卵前期正反馈循环受损。本研究中HFHS大鼠发情前期P水平显著降低。研究表明排卵前的P分泌对调节LH激增诱导的排卵至关重要[16],提示P对LH分泌的反馈非常重要。大鼠排卵前P水平较低可能会阻止LH激发启动排卵。因此,HFHS大鼠的卵巢形态改变可能是卵泡发育晚期激素失衡的结果。
总之,本研究通过HFHS饮食诱导雌性大鼠PCOS的特征,而非由外源激素诱导或通过改变类固醇生成途径诱导,这提示HFHS饮食也可能诱导人PCOS,从而导致生殖健康受损及代谢紊乱。本研究为阐明肥胖与PCOS之间的潜在机制提供了一种可利用的动物模型。

