棉花GhCAD6基因表达及其功能分析研究
胡文冉, 李晓东, 周小云, 李晓荣, 杨 洋, 李 波
1.新疆农业科学院核技术生物技术研究所, 新疆农作物生物技术重点实验室, 乌鲁木齐 830091;2.新疆维吾尔自治区水产科学研究所, 乌鲁木齐 830000
新中国成立以来,我国棉花(Gossypiumhirsutum)产量和品质都得到了大幅度的提高。但还存在着纤维比强度偏低及纤维品质诸指标搭配不合理等问题,难以满足国内外市场和纺织工业的多种需求[1]。新疆作为我国最大的优质棉生产基地也存在着同样的问题,严重影响着我国棉花在国际上的竞争力[2]。由于缺乏优异种质和亲本材料,所以在常规育种方面棉花纤维品质改良效果并不明显。目前棉花纤维改良的途径已从常规育种转向常规育种与生物技术育种相结合,其中转基因研究是棉纤维品质改良的一个重要方面。
棉花纤维是由胚珠外珠被表皮层的单细胞分化发育而成,在发育过程中主要经历纤维原始细胞分化和突起、纤维细胞的伸长、次生壁增厚和棉纤维脱水成熟4个阶段[3]。棉花纤维发育过程也是其纤维品质形成的过程。棉花纤维品质的主要恒定指标包括纤维长度、比强度、马克隆值、色泽等。目前利用基因工程技术将调控棉花纤维发育相关的基因导入棉花以提高棉花纤维品质方面的研究也已经取得了初步进展。主要表现以下几个方面:①与纤维伸长相关的基因:如伸长蛋白基因(Expansin)[4]、木聚葡糖内糖基转移酶/水解酶(XTH)[5]、E6启动子驱动的兔角蛋白基因(keratin)[6]、蚕丝心蛋白基因(fibroin)[7]、棉纤维特异表达启动子GAE6-3A驱动的蚕丝芯蛋白轻链基因(FBN)[8];②棉纤维细胞植物激素合成及信号途径相关基因:被报道对棉纤维发育具有明显影响并获得转基因棉花植株的有油菜素内酯(BR)相关基因GhBRII[9,10]、编码类固醇5α还原酶活力基因GhDET2[11]、赤霉素(GA)相关基因棉花赤霉素G20氧化酶1基因GhG20ox1[12]、棉花阿拉伯半乳糖蛋白基因GhAGP4[13]、细胞激动素(CK)相关基因GhCKX[14];③棉花纤维中细胞骨架结构蛋白及其调节因子:棉花肌动蛋白基因GhCAT1[15,16]、棉花切割蛋白基因GhKTN1[17]、棉花肌动蛋白解聚因子GhADF1[18]、芥末膜连蛋白基因(AnnBj1)[19]、棉花膜联蛋白基因GbAnn9[20];④影响糖类物质代谢的基因:纤维素合酶基因acsA和acsB基因[21,22]、蔗糖磷酸化合酶SPS基因[23]、蔗糖合酶基因Sus[24,25]、尿苷二磷酸葡萄糖焦磷酸化酶的基因GhUGP1[26];⑤苯丙烷代谢相关基因:棉花苯丙烷类化合物木质素合成基因GhLIM2[27]。这些基因转入受体棉花后,分别获得了比受体纤维品质有所提高的转基因后代株系,另外还有许多和棉纤维品质相关的基因仍在研究之中。
现有研究表明苯丙烷类代谢是棉花纤维中仅次于纤维素代谢的第二大代谢途径,苯丙烷代谢和棉花纤维细胞壁发育密切相关,其代谢产物苯丙烷类化合物和棉花纤维品质密切相关[28~31]。肉桂酸脱氢酶(cinnamyl alcohol dehydrogenase, CAD)是苯丙烷代谢途径上一个重要的基因家族,在形成细胞壁交联结构、细胞壁的延伸停止、次生壁发育起始及次生壁的发育中起重要作用。ChCAD6基因是CAD基因家族中重要的功能基因,该基因的表达量与棉花纤维的次生壁发育同步[28]。本团队从发育的棉花纤维中克隆出调节细胞壁交联结构形成的相关主效基因GhCAD6(GenBank序列号为:EU281305.1),将GhCAD6基因利用农杆菌介导法转化到棉花受体,获得了转化GhCAD6基因的阳性植株[32]。本研究在此基础上进一步研究外源GhCAD6基因在棉花基因组中的表达及其在不同发育阶段棉纤维中的表达量,为研究外源GhCAD6改良棉花纤维品质的机理提供理论支撑。
1 材料与方法
1.1 试验材料
利用农杆菌介导法将GhCAD6基因转入陆地棉新陆早36号,将收获的转基因棉籽种植后,在每年的选育过程中每代都选择抗卡那霉素后代植株,并结合纤维品质测试结果选择纤维品质变化明显的转基因材料作为下一次种植的材料,连续种植6代后获得转基因株系作为本试验中的转基因材料(T6)。对照为未转基因的新陆早36号(CK)。试验材料于2016年种植于新疆玛纳斯分子育种试验基地。
苗期再次对T6代转基因植株进行卡那霉素的抗性筛选,分别采摘抗卡那霉素的转基因植株和对照棉样的叶片液氮中迅速冷冻,于-80℃保存备用。
在棉花盛花期标记抗卡那霉素植株当天开花的棉铃,按5 DPA、10 DPA、15 DPA、20 DPA和25 DPA共5个时期采集棉铃,5 DPA采集20~30个、10 DPA 20~25个、15 DPA 15~20个、20 DPA采集10~15个、25 DPA采集5~10个,采摘后立即迅速用镊子去除棉壳,用预先准备好的锡箔纸包好,每包1~2个棉铃,做好标记,将包裹棉铃的锡箔纸迅速投入液氮中速冻,-80℃冰柜中保存备用;对照棉样相同发育时期的棉铃也采用和转基因植株相同的处理。
1.2 试验方法
1.2.1目的基因及功能片段的PCR检测 按植物基因组DNA提取试剂盒(购自天根公司)使用说明提取棉花幼嫩叶片中的DNA。根据基因序列用Primer 5.0软件分别设计引物,然后送由北京六合华大基因科技有限公司合成。其中抗性标记基因NPTⅡ-F:5′-GCACAACAGACAATCGGC-TGCTC-3′,NPTⅡ-R:5′-GCCATGGGTCACGAC-GAGATCC-3′,扩增片段大小为496 bp;目的基因GhCAD6-F:5′-TGTGCAGGGGTGACAGTTTAC-3′,GhCAD6-R:5′-CCCAATAAAACTCCCTGTAATCG-3′,扩增片段大小为501 bp。
分别对抗卡那霉素植株进行卡那霉素基因NPTⅡ和GhCAD6基因的PCR检测。并以对照叶片基因组DNA为阴性对照,以E6-pCAMBIA-2300-GhCAD6质粒为阳性对照,无菌水为空白对照,提取的转基因棉花基因组DNA为模板,反应体系(20 μL):DNA(100 ng/μL) 1 μL,2×PCR Mix 10 μL,引物(10 μmol/L) 0.75 μL,ddH2O补足。扩增条件:94 ℃预变性5 min;94℃变性45 s,52℃退火30 s,72℃延伸45 s, 35个循环;72℃延伸 10 min,4℃保存。PCR产物置1.5%琼脂糖中电泳,并用紫外凝胶成像仪观察检测结果。
1.2.2PCR阳性植株基因组的Southern杂交检测 以PCR检测为阳性的植株叶片基因组DNA为模板,CK叶片基因组DNA为阴性对照,质粒E6-pCAMBIA-2300-GhCAD6 DNA为阳性对照。用限制性内切酶BamHⅠ和XbaⅠ酶切基因组及质粒DNA,酶切体系:18 μL DNA(1 μg/μL),限制性内切酶XbaⅠ 2 μL, 10×buffer 5 μL,无菌水补足至50 μL,37℃酶切18 h。上述1.2.1中得到的目的基因GhCAD6的PCR产物采用天根通用型DNA纯化回收试剂盒纯化,按照地高辛标记的杂交试剂盒Ⅰ(Roche公司)说明书标记探针。按照地高辛试剂盒说明书和分子克隆实验指南(第二版)[33]配制药品,进行Southern杂交检测。
1.2.3不同发育阶段棉纤维中GhCAD6的荧光定量PCR检测 ①棉花纤维RNA的提取及反转录。热硼酸-蛋白酶K法[34]提取经Southern杂交检测出现杂交信号的转基因植株发育5 DPA、10 DPA、15 DPA、20 DPA、25 DPA的棉纤维中的RNA,采用北京全式金生物技术有限公司的反转录试剂盒将其反转录成cDNA。
对预测模型正负样本比例、特征量、算法核心参数进行调优,针对性提高预测结果的正确率及预测精度。整体调优参数如下:
②实时荧光定量PCR检测。选择GhUBQ7作为内参基因,在NCBI数据库中查找内参基因和目标基因的序列信息,使用NCBI引物设计工具,Primer-Blast进行设计,并使用相关程序对引物序列进行特异性检验,由上海生物工程公司合成引物。引物序列如下:GhCAD6-F:5′-GTTCCTGGGCATGAAGTGGT-3′,GhCAD6-R:5′-TGCAACATCCAACAAGACAACC-3′;GhUBQ7-F:5′-AGA-GGTCGAGTCTTCGGACA-3′,GhUBQ7-R:5′-GCTTGATCTTCTTGGGCTTG-3′。
以稀释后的棉花纤维cDNA为模板,以GhCAD6-F和GhCAD6-R为引物,选用棉花纤维的GhUBQ7为内参基因,GhUBQ7-F和GhUBQ7-R为内参基因引物,进行荧光定量PCR,反应体系(20 μL)为:SYBR© Select Master Mix (2X) 10 μL,Forward Primer (10 μmol/L) 0.40 μL,Reverse Primer(10 μmol/L) 0.40 μL,cDNA 1 μL,RNase-free 水补足到20 μL。反应条件为:UDG Activation AmpliTaqDNA,50℃ 2 min;Polymerase, UP Activation,95℃ 2 min;95℃,15 s,60℃,1 min,40个循环。得到各自的Ct值(循环阈值)。所有反应包括3次生物学重复。
③成熟棉花纤维品质检测。分别收获转基因单株和受体(CK)自然成熟棉花纤维,用小型轧花机脱籽,纤维送农业部品质监督检验测试中心采用大容量纤维测试仪(HVI)检测棉花纤维品质。
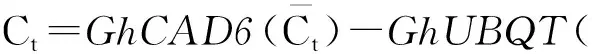
2 结果与分析
2.1 转基因后代PCR检测
利用能够起到筛选作用的新霉素磷酸转移酶基因(NPTⅡ)作为检测基因, PCR产物大小为496 bp,结果如图1所示,结果初步说明检测基因已经转入棉花基因组中。
经上步检测之后,在已经筛选出的部分阳性克隆中,利用能够扩增GhCAD6基因的特异性引物进行转基因后代的PCR检测,PCR产物大小501 bp,结果如图2所示,结果初步说明目的基因已经转入棉花基因组中。
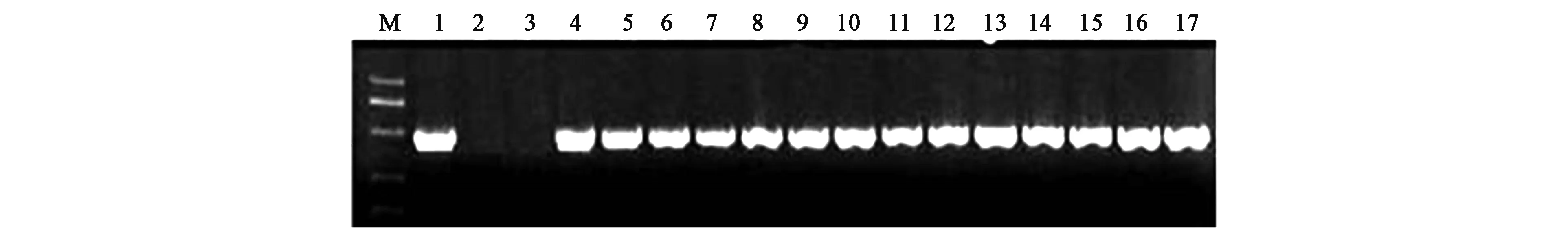
图1 转基因后代NPTⅡ引物PCR检测结果Fig.1 PCR amplification with NPTⅡ primers for generation of transgenic cotton.注:M. DL2000 Marker; 1.阳性对照; 2.非转基因对照; 3.阴性对照; 4~17.转基因后代(T6)棉花样品。
图2 转基因后代GhCAD6引物PCR检测结果Fig.2 PCR amplification with GhCAD6 primers for generation of transgenic cotton.注:M. DL2000 Marker; 1~14.转基因后代(T6)棉花样品; 15.非转基因对照; 16.阴性对照; 17.阳性对照
根据卡那霉素筛选和PCR检测结果可以发现转GhCAD6基因的植株经过6代筛选后,已基本保持稳定,只有极少数非转基因植株。
2.2 转基因后代植株叶片Southern杂交检测
使用目的基因GhCAD6重组质粒为模板进行PCR扩增,得到的PCR产物进行纯化回收后作为探针。图3为目的基因的Southern杂交结果,其中未转化植株CK-没有出现杂交信号,而转基因植株1~4均出现了明显的杂交信号,表明GhCAD6基因以单拷贝的形式整合到受体棉花基因组中。
2.3 转基因后代植株纤维荧光定量PCR检测
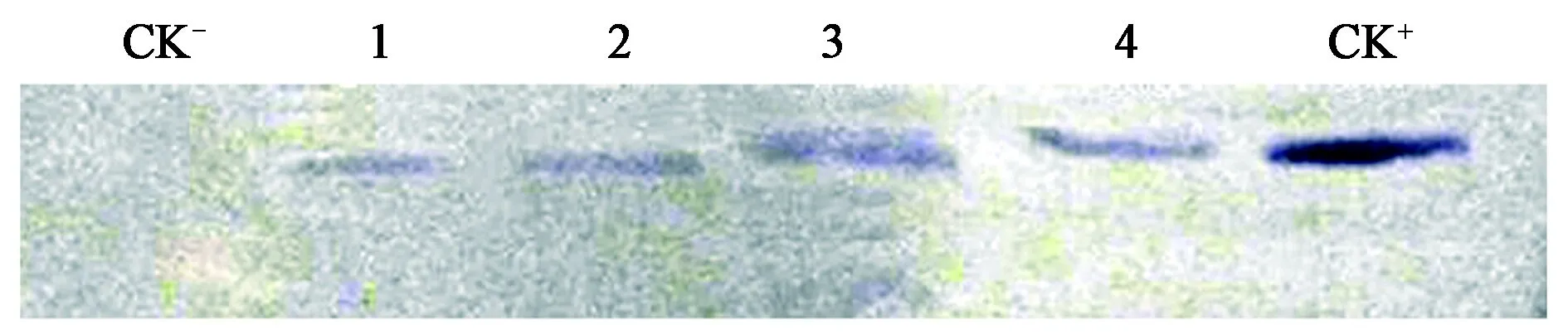
图3 转GhCAD6基因棉花后代部分材料的Southern杂交结果Fig.3 The Southern blotting results of some GhCAD6 transgenic cotton offspring.注:CK-:阴性对照;1~4.转基因植株;CK+:阳性对照。
的总RNA,利用紫外分光光度仪测定其吸光度,其OD260/OD280在1.81~2.06,说明总RNA的纯度较高。总RNA的电泳检测结果如图4所示,28 S与18 S条带清晰,且28 S条带亮度约为18 S条带亮度的2.0倍,说明样品的RNA保存完好,可用于后续试验。下方还能观察到一个更小稍微扩散的条带,主要是由低分子量的RNA(tRNA和5S核糖体RNA等)组成。
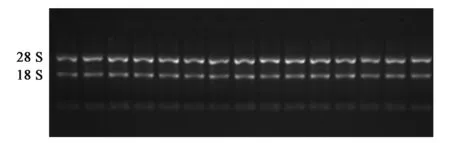
图4 纤维总RNA电泳图Fig.4 Electropherogram of total RNA in cotton fiber.
2.3.2扩增曲线与熔解曲线分析 经分析得知,目的基因GhCAD6的Ct值范围为27~32,内参基因GhUBQT的Ct值范围为23~27。基因GhCAD6和内标基因GhUBQT的熔点峰分别出现在79℃和83.5℃,曲线平稳,试验的结果是单一的峰型,峰尖且窄,而且每个峰的位置基本一致,说明试验条件合适,引物设计合理,在PCR扩增过程中没有非特异性扩增出现,是非常理想的熔解曲线,可进行后续的数据分析。
2.3.3GhCAD6基因在不同纤维发育阶段的表达量 棉纤维不同发育阶段中GhCAD6基因的表达量结果见图5,从图5中可以看到在非转基因棉花纤维中GhCAD6基因的整体表达趋势是先升高再降低,随着棉花纤维的发育在开花后20天(20 DPA)时GhCAD6基因的表达量达到最高,但在25 DPA时表达量又迅速下降。而在转基因棉花植株,GhCAD6的表达量在纤维发育15 DPA时出现降低趋势,其他时期的表达趋势与其对照相似,其中10 DPA和20 DPA时表达量与15 DPA间存在显著差异,15~20 DPA与10 DPA间存在显著差异,25 DPA与20 DPA间存在显著差异。而5~20 DPA是棉花纤维伸长的关键时期,由此说明GhCAD6基因在纤维伸长期起着十分重要的作用。从图5中可以看出转GhCAD6基因的后代材料中GhCAD6基因的表达量明显低于其对照材料,其中15~25 DPA时转基因材料和其对照间GhCAD6基因的表达量存在极显著差异。
2.4 GhCAD6基因对棉纤维品质的影响
表1是部分转GhCAD6基因单株纤维品质检测结果,从表中可以看出将GhCAD6基因导入棉花后,后代植株纤维上半部平均长度、比强度和整齐度都比对照有所增加,其中对照纤维长度为27.72 mm,转基因植株纤维平均长度在29.38~31.28 mm之间,平均值为30.40 mm,和对照相比增幅在6%~13.9%之间;对照断裂比强度为26.1 cN/tex,转基因断裂比强度在28.0~33.2 cN/tex之间,平均值为30.17 cN/tex,和对照相比增幅在7.3%~27.2%之间,整齐度增高,马克隆值增大,伸长率下降。

图5 纤维不同发育阶段GhCAD6基因的相对表达量Fig.5 Relative expression of GhCAD6 gene at different developmental stages of cotton fiber.注:不同小写字母与大写字母表示在P<0.05和P<0.01水平上差异显著。
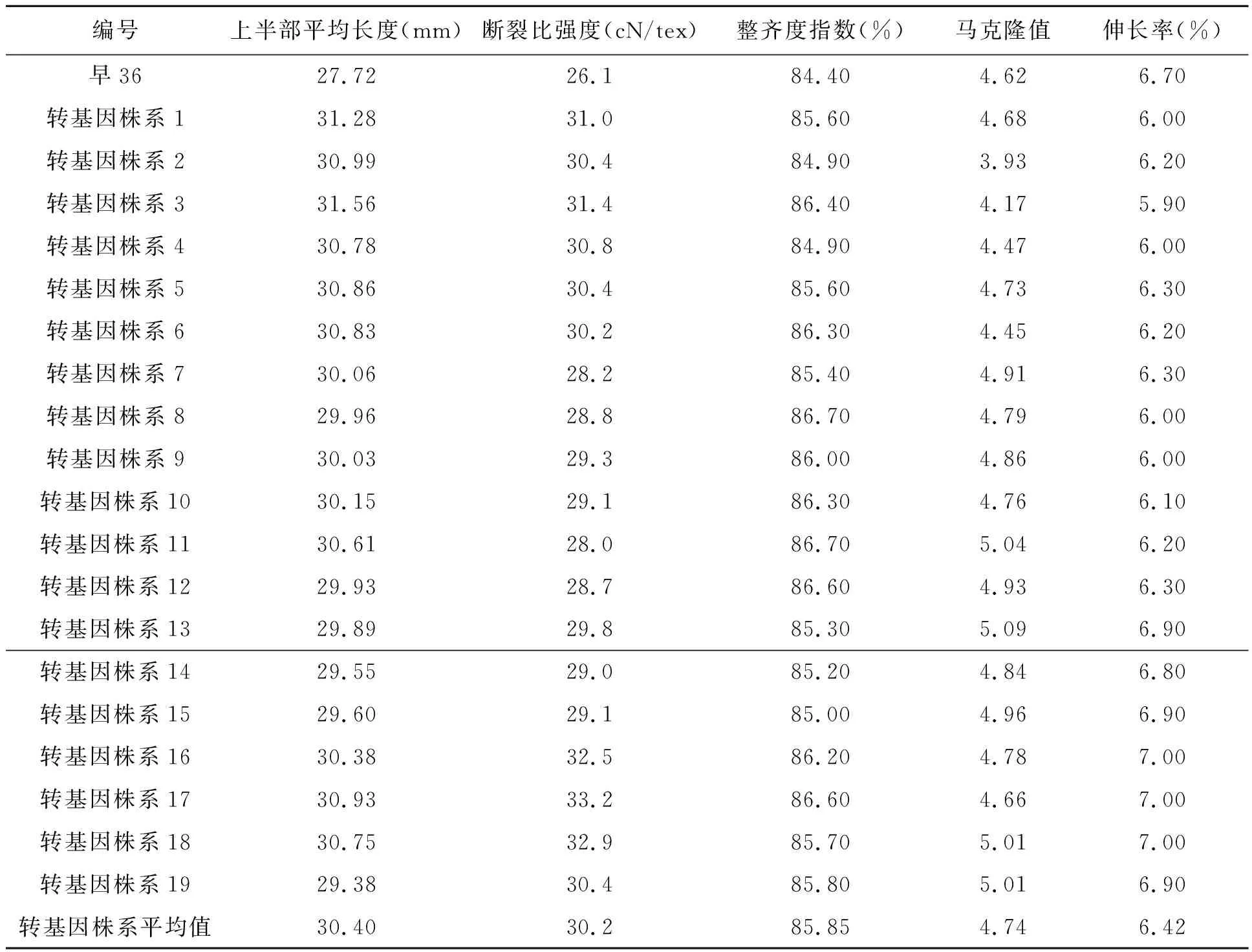
编号上半部平均长度(mm)断裂比强度(cN/tex)整齐度指数(%)马克隆值伸长率(%)早3627.7226.184.404.626.70转基因株系131.2831.085.604.686.00转基因株系230.9930.484.903.936.20转基因株系331.5631.486.404.175.90转基因株系430.7830.884.904.476.00转基因株系530.8630.485.604.736.30转基因株系630.8330.286.304.456.20转基因株系730.0628.285.404.916.30转基因株系829.9628.886.704.796.00转基因株系930.0329.386.004.866.00转基因株系1030.1529.186.304.766.10转基因株系1130.6128.086.705.046.20转基因株系1229.9328.786.604.936.30转基因株系1329.8929.885.305.096.90转基因株系1429.5529.085.204.846.80转基因株系1529.6029.185.004.966.90转基因株系1630.3832.586.204.787.00转基因株系1730.9333.286.604.667.00转基因株系1830.7532.985.705.017.00转基因株系1929.3830.485.805.016.90转基因株系平均值30.4030.285.854.746.42
3 讨论
本实验使用的是农杆菌介导转化法得到的棉花新陆早36号转GhCAD6基因的T6代材料。在每次的选育过程中每代都选择棉花纤维长度增加较多,变化明显的转基因抗卡那霉素后代植株作为下一次种植的材料,该方法大大缩短了得到高纯度的转基因后代材料所需要的时间。在本实验中也发现在转基因株系种植到T6代时已基本稳定,仅有较少的分离。经PCR检测发现目的基因和标记基因已存在于转基因植株叶片基因组中,Southern杂交检测出杂交信号,目的基因以单拷贝的形式插入到受体基因组中并得以表达,说明该目的基因能够在转基因后代中稳定遗传。
基因表达的定量检测方法很多,主要从蛋白表达水平、mRNA表达水平及外源DNA几个方面入手,包括酶联免疫吸附测定(ELISA)[36,37]、蛋白杂交[38,39]、高效液相色谱(HPLC)[40,41]、Southern杂交[42]、Northern杂交[43]、生物芯片技术(Biochips)[44]及聚合酶链式反应(PCR)技术、半定量RT-PCR[45]、实时荧光定量PCR(Real-time PCR)[46]等。各个检测方法在检测基因表达量时都有其优缺点,其中实时荧光定量PCR技术具有特异性高、灵敏度高、可定量、有效解决PCR污染问题及自动化程度高等优点,保证了结果的可靠性和可重复性,已广泛应用于分子生物学和医学等研究领域。但对于棉花纤维富含酚类化合物、多糖、次生代谢产物和内源RNA酶活性高等特点,适宜的棉花纤维RNA提取方法、合适的引物及内参基因是保证实时荧光定量PCR实施的关键,合适的实时荧光定量PCR反应条件也是实验实施必不可少的步骤之一。在本研究中,针对棉花纤维的特点,选用热硼酸-蛋白酶K法提取出棉花纤维中的RNA,避免了酚类、糖类等化合物对RNA的污染及RNA的完整性,再结合本研究中的实时荧光定量PCR的反应条件,从而保证了该技术在检测GhCAD6基因的表达量的顺利实施。该技术具有以下优点:①自动收集荧光信号,避免了肉眼判断的主观性,提高了实验的灵敏度,保证了结果的可靠性和可重复性;②免除了常规PCR中的电泳、定量扫描等后续繁琐步骤,大大缩短了实验时间;③操作简单,具有很强的推广性。CAD位于苯丙烷代谢途径最后一步反应[47],Fan等[28]从发育的棉花纤维中克隆了2个肉桂酸脱氢酶基因GhCAD1和GhCAD6的cDNA序列,发现这两个基因在棉花次生壁增厚期优势表达,表明CAD可能在棉花纤维次生壁形成过程中有重要的功能。Li等[48]研究表明GhCAD6基因被定位在第26号染色体上,参与棉纤维中的苯丙烷类单元和细胞壁酚酸的代谢。本研究也表明GhCAD6基因导入棉花受体后,其纤维长度、比强度得到明显提高,进一步证明了该基因在改良棉花纤维中的作用。本研究发现,转基因后代植株中GhCAD6基因的表达量在15 DPA时降低,20 DPA时又表现升高趋势,而转基因植株纤维品质明显高于其对照,该结果与袁辉[49]采用半定量RT-PCR法对棉花纤维发育过程中基因GhCADx进行量化分析的结果一致。这也可能是转GhCAD6基因造成棉花纤维品质改变的原因。但苯丙烷代谢是个非常复杂的代谢途径,涉及很多基因,转基因GhCAD6棉花的植株纤维中GhCAD6的表达量总体上低于对照的原因还需进一步研究。

