人胃肠道源儿茶酚类铁载体产生菌的筛选与鉴定
弓 强, 张希春
1.山西中医药大学基础医学院, 山西 晋中 030619;2.山西中医药大学中药与食品工程学院, 山西 晋中 030619
人胃肠道微生物菌群在低铁浓度的胃肠道环境中获取铁资源的主要策略是依靠分泌一类具有螯合、转运和贮藏铁元素功能的铁载体蛋白[1,2]。目前已知的铁载体蛋白有500多种,主要分为3大类:儿茶酚类(catecholates)、异羟肟酸类(hydroxamaces)、羧酸盐类(carboxylates)[3],其中儿茶酚类铁载体的螯合能力最强。儿茶酚类铁载体属于非核糖体肽,由NRPS参与合成。NRPS是一类具有模块化结构域的巨型酶系[4],其腺嘌呤结构域(adenine domain,A domain)具有底物识别特异性,可以根据其氨基酸序列预测NRPS合成产物的功能和类型[5~8]。
近年来,越来越多的研究发现铁载体在预防和治疗胃肠道疾病中显示出了独特功效。产铁载体微生物不仅在胃肠道低铁环境中表现出极强的适应性[9],还可与致病菌竞争铁元素从而抑制致病微生物的生长[10]。另有研究表明,产铁载体微生物可以作为补铁剂对一些自身无法合成铁载体的微生物(如乳酸杆菌、双歧杆菌)发挥益生作用,显著提高其数量和生长速率,从而维持胃肠道内菌群的平衡[11,12]。此外,铁载体在植物营养与保护[13~15]、鱼病防治[16,17]和医疗[18,19]等方面亦发挥着重要作用。
目前,铁载体高产菌株的分离筛选多来自海洋和植物根际土壤,而从成人粪样中分离筛选人胃肠道源铁载体高产菌株的相关研究较少。因此,本研究从健康成人粪样中筛选含NRPS A domain基因的阳性菌株入手,分析其产铁载体能力,以期为儿茶酚类铁载体产生菌在人胃肠道营养与健康中作用的研究奠定基础。
1 材料和方法
1.1 菌株和载体
大肠杆菌(Escherichiacoli)DH5α感受态细胞购自生工生物工程(上海)股份有限公司;载体pMD19-T购自日本TaKaRa公司。
1.2 主要试剂和仪器
胃蛋白酶(猪源,1∶3000)、胰酶(猪源,USP级)购自阿拉丁试剂(上海)有限公司;猪胆盐(BR级)购自国药集团;细菌全基因组提取试剂盒、DNA纯化回收试剂盒、质粒抽提试剂盒均购自天根生化科技(北京)有限公司;DNA Marker (DL2000)、T4连接酶、TaqDNA聚合酶试剂盒均购自日本TaKaRa公司;核酸染料Gold View-II购自北京赛百盛公司;氨苄青霉素(Ampicilline)、琼脂糖(agarose)购自德国Sigma公司;其他试剂均为国产分析纯。
PTC-200型PCR仪、Elddlxr型凝胶成像仪购于美国Bio-Rad公司;EPS-300型核酸电泳仪购自上海天能科技有限公司;UV-2600AH型分光光度计购于尤尼柯(上海)仪器有限公司。
1.3 主要溶液和培养基
模拟胃液(1 000 mL):蛋白胨8.3 g,葡萄糖3.5 g,氯化钠6.2 g,氯化钾2.2 g,氯化钙0.22 g,碳酸氢钠1.2 g,胃蛋白酶3.0 g,加蒸馏水定容至1 000 mL,pH 1.8,充分溶解后经0.22 μm滤膜过滤除菌。
模拟肠液(1 000 mL):蛋白胨8.3 g,葡萄糖3.5 g,氯化钠1.28 g,氯化钾0.24 g,碳酸氢钠6.4 g,胆盐3.0 g,胰酶1.0 g,加蒸馏水定容至1 000 mL,pH 7.5,充分溶解后经0.22 μm滤膜过滤除菌。
MRS去铁液体培养基(1 000 mL):蛋白胨10.0 g,葡萄糖10.0 g,酵母提取物5.0 g,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸氢二胺2.0 g,七水合硫酸镁0.2 g,五水硫酸锰0.05 g,8-羟基喹啉0.05 g,加蒸馏水定容至1 000 mL,pH 7.0~7.2,用等体积氯仿萃取2次,弃去氯仿层,121℃灭菌21 min。固体MRS去铁培养基另加15.0 g琼脂粉。
BHI培养基(1 000 mL):牛脑200.0 g,牛心浸出汁250.0 g,蛋白胨10.0 g,葡萄糖2.0 g,NaCl 5.0 g,琼脂20.0 g,加蒸馏水定容至1 000 mL,pH 6.8~7.2,121℃高压灭菌15 min。
琥珀酸培养基(1 000 mL):磷酸氢二钾6.0 g,琥珀酸4.0 g,磷酸二氢钾3.0 g,硫酸铵1.0 g,硫酸镁0.1 g,加蒸馏水定容至1 000 mL,pH 7.0,121℃灭菌21 min。
1.4 试验方法
1.4.1菌株的分离 志愿者为1名健康的成年在校女性大学生,无任何胃肠道相关疾病,采样前2周内未使用任何药物。收集其1 g新鲜粪便样品快速加入10 mL无菌生理盐水中,震荡混匀,4℃、10 000 r/min离心5 min,随后取1 mL上清液并加入9 mL模拟胃液,37℃培养4 h;再向培养菌液中加入40 mL模拟肠液,37℃继续培养18 h,用于菌株的分离。
取200 μL菌液分别涂布在不同的培养基(MRS、BHI培养基)中,37℃培养24 h,根据菌落形态特征进行初筛。初筛后的菌落在半固体培养基深层接种,挑取在表层和穿刺线均有生长的单菌落,进行甘油保种,于-20℃储存。
1.4.2含NRPS A domain基因菌株的筛选 按细菌全基因组提取试剂盒的操作说明书提取纯化后菌株的全基因组,于-20℃储存备用。利用CODEHOP软件[20]设计针对人胃肠道源微生物且代谢产物为儿茶酚类铁载体的NRPS A domain基因的简并引物F2(5′-GGCAAACCGAAAGGNGTNATGRT-3′)、AR1(5′-GCTTCAATYTCRCMYARYTC-3′),交由铂尚生物技术(上海)有限公司合成。以全基因组为模板筛选含NRPS A domain基因的微生物。PCR反应体系(25 μL):10×PCR buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL,TaqDNA聚合酶(5 U/μL)0.1 μL,10 μmol/L上、下游引物各1 μL,模板DNA 1 μL,ddH2O 17.4 μL。反应条件:94℃ 5 min;94℃ 40 s,55℃ 45 s,72℃ 105 s,共35个循环;72℃ 7 min。利用1.2%(w/V)琼脂糖凝胶电泳对扩增产物进行检测,目的片段大小应为800 bp左右,以此筛选含NRPS A domain基因的阳性菌株。
1.4.3NRPS A domain阳性菌株的鉴定 利用通用引物27F/1492R扩增NRPS A domain阳性菌株的16S rRNA基因,扩增产物纯化回收后与pMD19-T载体连接,导入DH5α感受态细胞,挑取阳性克隆菌株交至上海英骏生物技术有限公司测序。
将去除载体序列的16S rRNA基因以NCBI在线Blast比对进行菌株分类地位的初步分析,下载相似度较高的16S rRNA基因序列作为系统发育分析的参比序列,利用Clustal W软件进行比对,利用MEGA 5.2软件(采用Neighbor-Joining法,设置Bootstrap为1 000次)构建系统发育进化树[21]。将16S rRNA基因序列提交至GenBank数据库。
1.4.4NRPS A domain基因产物的分析 扩增阳性菌株的NRPS A domain基因,对扩增产物进行纯化回收,与pMD19-T载体连接后导入E.coliDH5α感受态细胞,挑取阳性克隆菌株提取质粒,将回收质粒交至上海英骏生物技术有限公司测序。
去除测序结果中的载体序列,利用NCBI中的CDD(conserved domain database)软件进行分析,验证测序结果是否为NRPS腺嘌呤结构域基因序列。利用NCBI中的ORF(open reading frame)Finder软件将核酸序列翻译为氨基酸序列;再以UniProtKB/Swiss-Prot在线数据库进行氨基酸序列分析,下载相似度较高的NRPS A domain氨基酸序列作为参比序列,利用Clustal W软件进行比对,利用MEGA 5.2软件(采用Neighbor-Joining法,设置Bootstrap为1 000次)构建系统发育进化树,预测NRPS次级代谢产物的化合物类型[21]。将NRPS A domain氨基酸序列提交至GenBank数据库。
1.4.5儿茶酚类铁载体产量的测定 利用Rioux比色法测定儿茶酚类铁载体的产量[22]。将活化后的菌液以3%(V/V)的接种量接种于10 mL琥珀酸培养基中,37℃摇床(180 r/min)培养36 h。12 000 r/min离心30 min,取上清液。配制5 mL的反应体系:2.3 mL无菌超纯水,0.2 mL 20%硫酸溶液,1 mL上清液,0.1 mL 1%柠檬酸铁胺溶液,0.4 mL 2 mol/L氟化铵溶液,0.4 mL 1%邻二氮菲溶液,0.6 mL 3 mol/L四氮环六亚甲基溶液。充分混匀后60℃水浴1 h,冷却至室温后于510 nm处测定吸光值。设置空白组为未接种的琥珀酸培养基;修正组用无菌超纯水替换邻二氮菲溶液,其他条件不变,以消除培养基的干扰。每组设置3次重复。用儿茶酚标准品配制不同浓度梯度的儿茶酚标准溶液,绘制510 nm处儿茶酚标准曲线。根据儿茶酚标准曲线计算儿茶酚类铁载体产量。
1.5 统计分析
实验数据处理与分析采用SPSS 19.0软件进行单因素方差分析(Anova),以P<0.05为存在显著性差异,并用Duncan检验法作多重比较,结果以平均值±标准差表示。
2 结果与分析
2.1 含NRPS A domain基因的阳性菌株
研究分离得到21株人胃肠道源兼性厌氧微生物,对其儿茶酚类铁载体生物合成途径NRPS A domain基因进行扩增,扩增产物经1.2%琼脂糖凝胶电泳检测,共获得8株阳性菌株,分别命名为Gut 01、Gut 03、Gut 07、Gut 12、Gut 13、Gut 14、Gut 16、Gut 20(图1)。
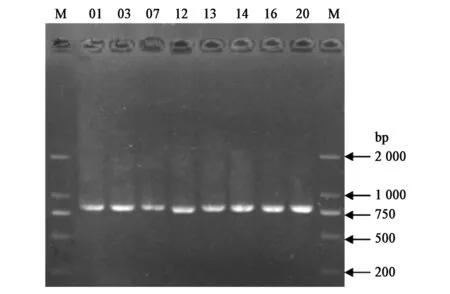
图1 NRPS A domain扩增产物电泳图Fig.1 PCR amplification of NRPS A domain gene.注:M:DNA DL-2000 marker;01、 03、07、12、13、14、16、20:菌株Gut01、Gut03、Gut07、Gut12、Gut13、Gut14、Gut16、Gut20 NRPS A domain基因扩增产物。
2.2 阳性菌株的种属
阳性菌株的16S rRNA基因序列比对分析结果如表1所示,Gut 01、Gut 07、Gut 12、Gut 13、Gut 20分别与E.coliE191-4 (KJ477005.1)、E.coliO157:H7 strain WS4202 (CP012802.1)、E.coliE84-1(KJ477001.1)、E.coliRCB273(KT260485.1)、E.coliK-12 strain DHB4 (CP014270.1)的16S rRNA基因序列的相似度最高(99%);Gut 03、Gut 14、Gut 16分别与BacilluscereusBQAR-01d(FJ217203.1)、Bacillussp. B31(2008)(EU384285.1)、B.cereusS2-8(CP009605.1)的相似度最高,分别为93%、93%、99%。
下载相似度较高的相关菌株16S rRNA基因序列,用MEGA 5.2软件构建16S rRNA基因系统发育进化树,Gut 01、Gut 07、Gut 12、Gut 13、Gut 20在进化关系上与埃希氏菌属微生物在同一分支,具有同源性(图2),说明这5株菌株为埃希氏菌属的新种或亚种;菌株Gut 16与B.cereusS2-8CP009605.1)在同一分支上,具有同源性,且其16S rRNA基因序列相似度为99%,因此将其命名为B.cereusGut 16;菌株Gut 03、Gut 14与Bacillussp. B31(2008)(EU384285.1)、B.cereusBQAR-01d(FJ217203.1)在同一分支具有同源性,且与其同源性菌株16S rRNA基因序列相似度为93%,由此可判断Gut 03、Gut 14是芽孢杆菌属的新种或亚种,因此命名为Bacillussp. Gut 03和Bacillussp. Gut 14。

表1 16S rRNA基因序列比对分析Table 1 Similarity to the closest relatives in GenBank of 16S rRNA gene sequences of isolates.

图2 筛选菌株基于16S rRNA基因序列构建的系统发育进化树Fig.2 Phylogenetic tree based on 16S rRNA gene sequences of selected strains.注:图中分支点的数字代表树形可信度,即1 000次联配中成功的百分比;括号内序列号为菌株的GenBank登录号;标尺代表序列间的分歧度,即遗传距离;▲为实验菌株;右侧为同一分支微生物的种属。
(
将8株菌株的16S rRNA基因序列测序结果提交至NCBI,得到GenBank的序列登录号为KU156682~KU156689。
2.3 阳性菌株的产物预测
阳性菌株的NRPS A domain基因测序结果经CDD软件验证,扩增产物属于NRPS A domain基因保守序列;再将核酸序列翻译为氨基酸序列,与UniProtKB/Swiss-Prot数据库比对分析,结果如表1所示;再利用MEGA软件构建系统发育进化树(图3)。由结果可知,Gut 14和Gut 16的NRPS A domain结构域氨基酸序列与菌株B.subtilis168 (P45745)的NRPS中DHB F结构域氨基酸序列的相似度最高,分别为81.4%和81.3%,且在系统发育进化树中具有同源性。DHB F结构域是芽孢杆菌属菌株中参与芽孢杆菌素合成的重要功能结构域[23],因此,Gut 14和Gut 16由NRPS参与合成的儿茶酚类铁载体为芽胞杆菌素。而Gut 01、Gut 03、Gut 07、Gut 12、Gut 13、Gut 20的NRPS A domain氨基酸序列在系统发育进化树中处于同一分支(图3),与参与合成肠杆菌素的Ent F结构域具有同源性,其相似度为97.7%~99.2%,因此,Gut 01、Gut 03、Gut 07、Gut 12、Gut 13、Gut 20由NRPS合成的儿茶酚类铁载体为肠杆菌素。
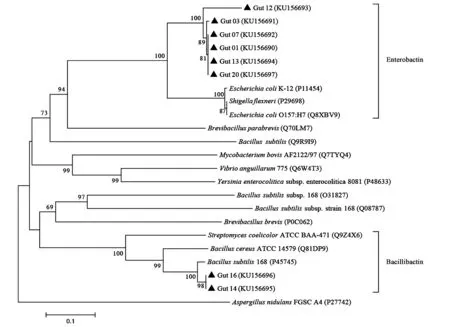
图3 筛选菌株基于NRPS A domain氨基酸序列构建的系统发育进化树Fig.3 Phylogenetic tree based on NRPS A domain amino acid sequences of selected strains.注:图中分支点的数字代表树形可信度,即1 000次联配中成功的百分比;括号内序列号为菌株的NRPS A domain氨基酸序列在数据库UniProt-KB/Swiss-Prot的登录号;标尺代表序列间的分歧度,即遗传距离;▲为实验菌株;右侧为次级代谢产物预测的化合物类型。
将8株菌的NRPS A domain结构域氨基酸序列提交至NCBI,得到GenBank中的序列登录号为KU156690~KU156697。
2.4 阳性菌株产儿茶酚类铁载体的能力
Rioux比色法定量测定儿茶酚类铁载体产量,结果显示8株菌株均有儿茶酚类铁载体产生;由表2可知,B.cereusGut 16 产芽胞杆菌素能力最强(94.75±0.40 μmol/L),E.coliGut 07产肠杆菌素能力最强(66.48±0.10 μmol/L),均显著高于其他菌株(P<0.05)。
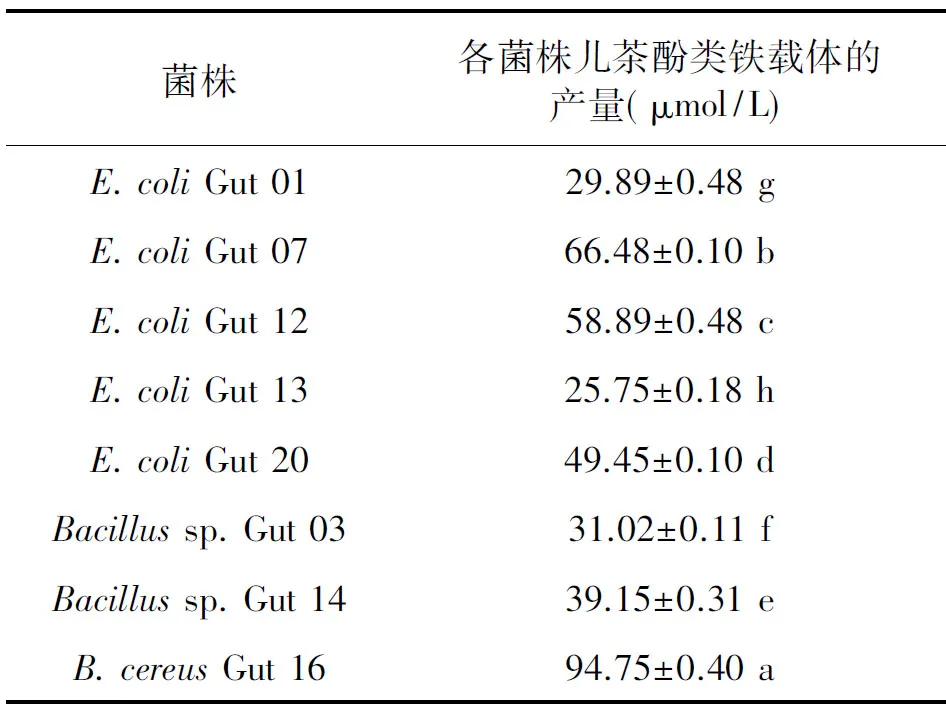
表2 儿茶酚类铁载体的产量Table 2 The yield of cateloate-type siderophore.
注:同一列内不同字母表示数据具有显著性差异(P<0.05)。
3 讨论
人胃肠道微生物菌群处在一个高度特殊化的环境中,因其庞大的生物量与基因资源,具有许多人体自身不具备的代谢功能,对人体的营养和健康产生直接或间接影响。本研究通过克隆儿茶酚类铁载体生物合成途径中NRPS的基因,根据NRPS A domain底物特异性预测代谢产物的化合物类型,并结合理化实验对产物进行定性和定量分析,最终筛选得到8株人胃肠道源产儿茶酚类铁载体菌株。基于生物信息学方法预测NRPS次级代谢产物儿茶酚类铁载体的化合物类型,8株菌的合成产物分别为肠杆菌素和芽孢杆菌素。利用化学方法对8株菌株的儿茶酚类铁载体产量研究表明,其生成儿茶酚类铁载体的能力具有显著性差异(P<0.05),菌株B.cereusGut 16生成芽胞杆菌素的能力最强(94.75±0.40 μmol/L),菌株E.coliGut 07生成肠杆菌素的能力最强(66.48±0.10 μmol/L)。
武汉大学赵翔等[24]从湖水中筛选得到1株高产铁载体荧光假单胞菌,其培养上清液中铁载体的产量达到15 μmol/L,产量小于本实验得到的产儿茶酚类铁载体菌株,其原因可能是因为微生物来源不同,胃肠道环境与湖水中环境差异较大。E.coliGut 01、E.coliGut 07、E.coliGut 12、E.coliGut 13、E.coliGut 20的NRPS A domain结构域氨基酸序列进化关系显示与16S rRNA基因序列分析结果一致,说明NRPS A domain结构域具有高度保守性;Bacillussp. Gut 03的NRPS A domain结构域氨基酸序列进化关系显示与埃希氏菌属微生物具有同源性(图3),说明NRPS A domain结构域氨基酸序列可以用来预测其次级代谢产物的化合物类型,而不能准确反映物种间的进化关系。Fiedler等[25]研究发现,肠杆菌素并非只能由革兰氏阴性菌合成,革兰氏阳性菌也能够分泌肠杆菌素,与本研究中革兰氏阳性菌Bacillussp. Gut 03合成的儿茶酚类铁载体为肠杆菌素结果一致。
儿茶酚类铁载体在胃肠道中分布广泛,如耶尔森菌、沙门氏菌、假单胞菌、弧菌等分泌的耶尔森菌素、沙门氏菌素、假单胞菌素和弧菌素都属于儿茶酚类铁载体,但是其对人胃肠道营养与健康的影响尚缺乏统一的认识。本研究得到的儿茶酚类铁载体高产菌株为芽孢杆菌属和埃希氏菌属,这一结果可能与芽孢杆菌和大肠杆菌在胃肠道环境中的作用和地位直接相关,作为胃肠道微生物菌群中的优势菌群,其不仅可以为自身生长提供所需的铁元素,而且可以作为胃肠道微生物菌群中铁资源的供体菌,为胃肠道微生物菌群的生长提供铁资源,维持胃肠道微生物菌群的多样性[26]。
本研究利用儿茶酚类铁载体生物合成途径NRPS的基因以筛选产儿茶酚类铁载体菌株,可以有效提高筛查的准确性与高效性,而且对于特定次级代谢产物微生物的筛选,较传统的筛选方法更具优势。本研究获得的儿茶酚类铁载体高产菌株为儿茶酚类铁载体及其产生菌在食品、医药和工农业生产等领域的应用提供了实验基础,并为其在胃肠道营养与健康中作用的研究奠定了基础。

