玉米G蛋白研究进展
王亚丽, 邓德祥, 王益军*
1.江苏省作物遗传生理重点实验室/植物功能基因组学教育部重点实验室/江苏省作物基因组学和分子育种重点实验室, 扬州大学农学院, 江苏 扬州 225009;2.江苏省粮食作物现代产业技术协同创新中心, 扬州大学, 江苏 扬州 225009
G蛋白是重要的信号转导载体,负责将胞外信号传递到胞内。G蛋白在动物和植物中都广泛存在,其包括3个亚基:Gα、Gβ和Gγ[1]。在动物中,G蛋白信号通路与细胞极性、突触结合、感觉响应等多个生物学过程相关[2]。植物G蛋白信号也参与众多生长发育进程,包括株型塑造、生物逆境与非生物逆境抗性、激素与光信号应答、糖信号响应、养分利用效率和产量形成等[3,4]。本文简述了植物G蛋白信号传递的基本特征,重点综述了玉米G蛋白的研究进展,包括玉米G蛋白的分布、功能及其与重要农艺性状的关联。此外,本文还对玉米G蛋白今后的研究工作进行了展望。
1 植物G蛋白的信号通路
G蛋白信号通路的激活依赖于发生GDP 到GTP 的转换。在失活状态下,G蛋白Gα亚基结合GDP,与Gβ、Gγ亚基形成异源三聚体Gαβγ。在激活状态下,发生GDP到GTP的转换,形成2种复合体:结合GTP的Gα亚基、Gβ、Gγ亚基形成的异源二聚体Gβγ,进而激活下游的效应基因(图1)。在动物中,发生GDP到GTP的转换,G蛋白偶联受体(G-protein-coupled receptors, GPCRs)是必需的[2]。而在植物中,迄今为止没有发现功能性的GPCRs。植物Gα亚基的激活可能不需要功能性GPCRs的参与,能够发生自我激活,实现GDP 到GTP 的转换,进而激活下游的效应基因[5]。尽管缺乏功能性的GPCRs,植物中含有G蛋白信号调节因子(regulator of G-protein signaling, RGS)。RGS通过Gα亚基促进GTP水解,进而阻止Gα亚基活性,终止植物体内的G蛋白激活信号。可见,RGS是植物G蛋白信号的负向调节因子[6]。有趣的是,研究者们只在拟南芥等双子叶植物中发现了RGS,在玉米等单子叶禾谷类作物中没有发现功能性的RGS[7,8]。RGS分布呈现出物种特异性,表明在单子叶和双子叶植物中可能存在着不同的G蛋白信号调节机制。玉米等禾谷类作物中,哪些因子参与了G蛋白信号通路的调控,尚有待进一步研究。
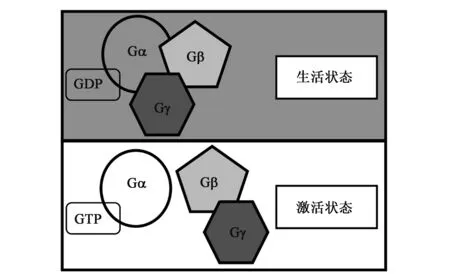
图1 G蛋白信号转导通路Fig.1 Signaling transduction pathway of G-proteins.
2 玉米G蛋白的分布
玉米中含有1个典型Gα、3个非典型超大Gα (extra-large Gα, XLG)、1个Gβ、6个Gγ亚基。6个Gγ亚基可以进一步分为Type A Gγ(1个)、Type B Gγ(1个)和Type C Gγ(4个)。
玉米典型Gα蛋白COMPACT PLANT2 (CT2)含有Gα结构域,Gα结构域又可以分为两个亚结构域:Helical和Ras-like亚结构域[9]。玉米中除了具有典型Gα蛋白CT2,还含有非典型超大Gα蛋白XLG。XLG大小是典型Gα亚基的两倍。与典型Gα蛋白类似,XLG蛋白在C端含有Helical和Ras-like亚结构域。在XLG蛋白N端,还具有核定位信号、富含半胱氨酸的结构域[10]。XLG蛋白能够与Gβ蛋白发生互作,直接参与G蛋白信号通路[11]。
玉米Gβ蛋白N端具有coiled-coil helices结构域。此外,Gβ蛋白含有7个tryptophan-aspartic acid 40 (WD40)重复结构域。玉米中含有6个Gγ蛋白,包括1个Type A、1个Type B、4个Type C Gγ[12]。与Gβ蛋白类似,所有Gγ蛋白N端都含有coiled-coil helices结构域。Type A Gγ蛋白在C端还含有prenylation结构域 (CaaX结构域)。Type B Gγ只含有N端的coiled-coil helices结构域。Type C Gγ,又被称为非典型的Gγ亚基(non-canonical Gγ subunit),是因为Type C Gγ蛋白除了N端的coiled-coil helices结构域,还含有跨膜螺旋、C端的富含半胱氨酸结构域。部分Type C Gγ蛋白还含有prenylation结构域(CaaX结构域)[3]。
玉米Gβ蛋白和所有3种类型Gγ蛋白的N端,都含有螺旋结构域。Gβ N端的螺旋能够与Gγ N端的螺旋形成螺旋-螺旋结构。Gβ和Gγ蛋白的互作是通过各自N端的螺旋形成螺旋-螺旋结构,进而产生Gβγ异源二聚体。在激活状态下,Gβγ异源二聚体可以激活下游的效应基因,从而调控多个生物学过程[1]。在Type C Gγ蛋白C端还含有富含半胱氨酸的结构域,该结构域负向调控Gβ和Gγ N端螺旋的互作[13]。
3 玉米G蛋白的功能
玉米具有1个典型Gα、1个Gβ、6个Gγ蛋白。根据结构域组成的差异,6个Gγ蛋白可以进一步分为Type A Gγ、Type B Gγ、Type C Gγ蛋白,它们在玉米中的数目分别为1个、1个、4个。与水稻、拟南芥等物种相比,玉米G蛋白功能研究的报道较少,玉米G蛋白功能研究主要集中于典型Gα蛋白CT2、Type C Gγ蛋白ZmGS3。
3.1 玉米典型Gα蛋白CT2的功能
玉米基因组中只含有1个编码典型Gα蛋白的基因ct2。玉米ct2基因功能缺失突变体ct2表现为半矮秆、根系生长减少、叶片短而直立、增大的茎顶端分生组织(shoot apical meristem,SAM)、雄穗分支密、雌穗多、穗尖变大、雌穗扁化、穗行数增多。与野生型相比,ct2突变体的开花期没有改变[9]。ct2突变体的半矮秆性状是由于细胞数目的减少,而不是细胞大小的降低所导致。此外,ct2突变体叶片数和雌穗数增多。增多的叶片数、雌穗可以部分补偿ct2株高降低的效应[14]。ct2突变体进一步分析的结果表明,玉米典型Gα蛋白基因ct2是细胞扩增与伸长的正向调节因子。
3.2 玉米Type C Gγ蛋白ZmGS3的功能
玉米中含有4个编码Type C Gγ蛋白的基因,只有水稻Type C Gγ基因GRAINSIZE3 (GS3)的同源基因ZmGS3的功能被初步研究。玉米Type C Gγ基因ZmGS3是水稻籽粒大小基因GS3的同源基因。玉米不同组织中基因表达分析的结果表明,ZmGS3主要在未成熟的玉米雌穗与籽粒中表达,调控玉米籽粒的发育。候选基因关联分析的结果显示,位于ZmGS3基因第5外显子、启动子区域的变异分别与玉米籽粒长度、百粒重的变异显著关联。尽管玉米ZmGS3与水稻GS3类似,调控籽粒的发育过程,然而,ZmGS3调控玉米籽粒发育的机理可能与GS3调控水稻籽粒发育的机理不同[15~17]。在水稻中过表达玉米ZmGS3基因,导致植株株高降低、籽粒变短,表明玉米ZmGS3基因负向调控植株的高度与籽粒长度[12]。
过表达拟南芥Type C Gγ基因AGG3导致叶片、花、荚果和种子增大,拟南芥agg3突变体表现为缩短的下胚轴、荚果和种子[18, 19]。在拟南芥中,Type C Gγ基因AGG3正向调控器官的大小。然而,玉米Type C Gγ基因ZmGS3负向调控器官的大小。Type C Gγ基因在单子叶、双子叶植物器官大小调控中呈现出不同的机制。这一方面表明,G蛋白信号对单子叶、双子叶植物的一些发育进程存在着不同的调节机制,另一方面也表明植物G蛋白信号调控通路的复杂性。因此,一些G蛋白信号调控的研究需要结合具体的研究物种与研究性状。
4 玉米G蛋白与重要农艺性状的关联
G蛋白影响到玉米的多个重要农艺性状,包括株型建成、花器官发育、产量形成、非生物逆境应答等。
4.1 G蛋白调控玉米分生组织的大小
植物分生组织是具有分裂分化能力的细胞群,是产生各种组织的基础。因此,分生组织的调控通路是发育生物学研究的热点与难点之一,也具有重要的实践应用意义。越来越多的证据表明,G蛋白可以调控玉米分生组织的发育,这一调控是通过玉米G蛋白与CLAVATA (CLV)通路受体的互作而实现的。
在植物中, CLV通路、同源异型盒基因WUSCHEL(WUS)形成负向反馈通路,进行分生组织的调控。WUS基因结合于CLV通路配体CLAVATA3 (CLV3)的启动子区域,正向调控CLV3的表达。配体CLV3被CLAVATA2 (CLV2)等受体识别,负向调控WUS基因的表达,从而形成CLV/WUS负向反馈调控通路。CLV/WUS负向反馈通路对于分生组织的维持起到十分重要的作用[20]。玉米FASCIATEDEAR2(FEA2)是拟南芥编码富含亮氨酸重复受体类激酶基因CLV2的同源基因。编码玉米Gα蛋白基因ct2的突变体ct2与拟南芥CLV通路突变体clv的表型类似。玉米Gα蛋白CT2与CLV通路受体FEA2发生互作,传递CLV通路受体的信号,调控玉米茎顶端分生组织和花序分生组织,进而影响玉米植株的株型塑造、花器官发育等[9, 21, 22]。
4.2 G蛋白影响玉米叶片形态和花序发育
玉米典型Gα蛋白基因ct2的突变体ct2不仅影响植株的株型建成,如株高等,而且调控植株的花序发育。ct2突变体植株着生多个雌穗[14]。表明典型Gα蛋白CT2可以有效抑制玉米雌穗的无序增殖。此外,组成型激活ct2基因可以提高玉米的穗行数,同时降低叶夹角[23]。穗行数是玉米产量的构成因子,与玉米最终的产量表现密切相关。叶夹角也是玉米育种中关注的重要农艺性状之一。适当降低茎叶夹角,培育紧凑型玉米品种,可以有效改善高密度种植条件下的群体结构,提高光能利用效率,是玉米株型改良和高产育种的重要内容之一。
玉米中除了具有典型的Gα蛋白CT2,还含有非典型的超大Gα蛋白XLG。与玉米典型Gα蛋白CT2类似,XLG蛋白参与调控玉米分生组织的发育。在调控玉米植株发育过程中,与CT2相比,XLG蛋白一方面表现出功能的冗余,同时也具有自身一些特有的功能[23]。XLG蛋白可以用作靶标来改良玉米的重要农艺性状,包括叶片形态、花序发育等。因此,发掘玉米典型Gα蛋白基因ct2、非典型超大Gα蛋白基因XLG的等位变异,尤其是具有育种价值的优良等位变异,将为玉米高产、理想株型等育种实践与遗传改良工作提供重要素材。
4.3 G蛋白与玉米产量性状的关联
G蛋白基因GS3影响水稻籽粒大小,最终影响水稻的产量表现[16]。过表达拟南芥Gγ基因AGG3使得荚果和种子增大。在水稻中过表达玉米Type C Gγ基因ZmGS3,导致水稻株高降低、籽粒变小。这表明玉米Type C Gγ基因ZmGS3影响籽粒的发育[12]。对玉米产量性状QTL进行分析,发现编码玉米Type C Gγ蛋白的基因ZmDEP1(水稻Type C Gγ基因DEP1的同源基因)是玉米产量性状的候选基因[24,25]。Type C Gγ基因DEP1与水稻穗型、粒长等产量性状相关[12,26,27]。Type C Gγ基因ZmDEP1作为玉米产量性状的候选基因,其与玉米产量的关联性有待进一步研究。
尽管在水稻中对玉米ZmGS3基因进行了过表达研究,但ZmGS3基因与玉米株型建成、籽粒发育的相关性仍需要进一步分析研究。直接在玉米中采用过表达、RNAi、CRISPR/Cas9等技术对ZmGS3、ZmDEP1等G蛋白基因进行研究,将有助于揭示G蛋白在玉米中的功能,尤其是阐明G蛋白在玉米产量形成中的作用及其机理。
4.4 G蛋白参与玉米非生物逆境应答
植物G蛋白在多种非生物胁迫(冷害、盐害、干旱、镉处理)响应中发挥重要作用。在水稻等植物中,研究者对G蛋白应答非生物胁迫的机制进行了深入研究。例如,水稻Gα蛋白与COLD互作,通过调控Ca2+通道影响植株的耐冷性[28]。水稻Gα蛋白还参与干旱胁迫响应[29]。水稻Type C Gγ蛋白DEP1与镉的耐受性相关[30]。与水稻相比,玉米G蛋白与非生物胁迫应答的相关性研究较少,目前主要集中在玉米典型Gα蛋白CT2与非生物逆境响应的研究。
玉米典型Gα蛋白CT2参与盐胁迫的响应。在NaCl处理下,与野生型相比,玉米Gα蛋白基因CT2的突变体ct2能够延缓叶绿素降解、细胞质电解质渗漏与叶片衰老。玉米G蛋白信号通过调控分生组织的细胞分裂和叶片细胞的凋亡,从而对盐胁迫作出应答[31]。尽管玉米Gα蛋白与盐胁迫应答的生理成因已经得到了初步揭示,在转录组、代谢组学等多个层面开展后续研究,不仅将有助于深入揭示玉米典型Gα蛋白对盐胁迫应答的机制,而且也能为研究玉米其他G蛋白与非生物逆境响应的关联提供参考。
5 展望
玉米中具有1个典型Gα、3个非典型超大Gα(XLG)、1个Gβ、6个Gγ(1个Type A Gγ、1个Type B Gγ、4个Type C Gγ)。玉米G蛋白的研究集中于典型Gα、1个Type C Gγ(水稻GS3的同源基因ZmGS3)。玉米Gβ、其余Gγ蛋白的功能未知。可以采用CRISPR/Cas9等技术,获得目的基因敲除材料,研究玉米G蛋白的功能。需要注意的是,一些G蛋白,例如水稻Gβ亚基,是生物体生长和发育所必需的。由于胚致死效应,通过CRISPR/Cas9技术可能难以得到纯合的突变体[12]。在这种情况下,可以通过RNAi等方法,进行G蛋白功能的研究。此外,对于玉米Gγ蛋白,由于有3种类型(Type A、Type B、Type C),并且Type C Gγ有多个成员(4个)存在,可能存在功能的冗余,单个基因的敲除不一定有明显的表型变化,需要通过CRISPR/Cas9多基因敲除、单基因敲除系杂交等方法构建多基因敲除系,进行玉米G蛋白功能的解析。
植物G蛋白影响到众多重要的农艺性状,包括株型建成、生物逆境与非生物逆境应答、养分利用效率、籽粒品质、产量表现等[3,9,23,28]。但G蛋白调控玉米籽粒发育、非生物逆境应答的机制尚有待深入解析。此外,通过自然群体筛选和CRISPR/Cas9等技术,发掘G蛋白基因的优良等位变异并评估其育种效用,也是今后玉米G蛋白研究的重要命题。

