一株亚硝化细菌的分离鉴定及其发酵工艺优化
赵彭年, 杨德玉, 王加友, 丁一凡, 安 鹏, 王 远
沈阳化工研究院有限公司生物与医药研究所, 沈阳 110021
亚硝化细菌(又称氨氧化菌)在自然界中分布十分普遍,其在土壤、淡水及海洋中都有存在。亚硝化细菌对环境的变化等较为敏感[1],其通过氧化水中的氨氮作为唯一能量来源以维持自身生长需要,以碳酸盐为碳源、以氨氮为氮源来合成细胞所需物质,是典型的自养型细菌。其代谢氨氮氧化反应式为2NH3+3O2=2HNO2+2H2O[2,3]。亚硝化细菌生长缓慢,平均生长代时在10 h以上[4],且其不能在有机培养基中生长,对营养的专一性较强,从而使得其分离和扩大培养较为困难。
亚硝化细菌在污水氨氮降解过程中发挥着重要作用,是脱氮过程中的限速反应步骤,在污水处理研究中,利用亚硝化细菌进行氨氮去除及氨氮短程硝化的应用越来越多[5,6],但多数停留在菌株分离、摇瓶培养的阶段,而在发酵罐中进行高密度发酵的研究报道相对较少。此外,在污水处理前期需要投加较多的亚硝化细菌进行氨氮的有效降解,然而由于亚硝化细菌的高密度发酵较为困难,且产量较少,目前只有少数外资企业掌握相关技术,使得亚硝化细菌菌剂的市场价格较高,严重影响了亚硝化细菌在污水处理过程中的应用。基于此,本研究将沿海污泥富集培养后,通过硅胶平板和水洗琼脂平板分离得到1株亚硝化细菌并命名为Sys NC-02,通过摇瓶培养、正交试验对其培养条件和培养基组分进行优化,利用10 L发酵罐进行高密度发酵并进一步优化发酵工艺,以期对其后续工业化生产起到重要的指导作用。
1 材料与方法
1.1 实验材料
1.1.1培养基 亚硝化细菌富集培养基:0.5% Na2CO3、0.4% (NH4)2SO4、0.1% K2HPO4、0.005% MgSO4、0.2% NaCl,加蒸馏水至1 L,混匀溶解,调节pH至8.0。
亚硝化细菌硅胶平板分离培养基:在亚硝化细菌富集培养基的基础上加入硅胶[7]。
亚硝化细菌水洗琼脂平板分离培养基:在亚硝化细菌富集培养基的基础上加入水洗琼脂[7]。
1.1.2主要仪器设备 ZWYR-D2402型摇床(上海智城分析仪器制造有限公司)、T100型PCR扩增仪(Bio-RAD)、BIOTECH-10BGZA型发酵罐(上海保兴生物设备有限公司)、Cleverchem380型水质分析仪(德国DeChem-Tech公司)、HQ30d型便携式溶氧测定仪(美国HACH公司)。
1.2 检测方法
1.2.1氨氮的测定方法 水杨酸比色法[8]。
1.2.2亚硝态氮(即亚硝酸盐)的测定方法 N-(1-萘基)-二乙胺光度法[8]。
1.2.3亚硝化速率测定的方法 在研究过程中发现,亚硝化细菌在静止的发酵液中沉降速度较快,若利用分光光度计测量其OD值,结果重现性较差;而采用MPN计数法[9]则存在计数时间长、计数干扰因素多等问题,不利于试验的快速进行。基于陈金声和史家梁[10]的亚硝化速率测定方法、陈捷音[11]的亚硝化细菌检测方法,以及亚硝化细菌氧化氨氮为零级反应[12]的理论依据,选择通过测定发酵液的亚硝化速率来表示发酵液中的亚硝化细菌的数量及活性。
①用单位时间生成亚硝态氮的量测定亚硝化速率。取某发酵时段发酵液10 mL加入装有190 mL的亚硝化细菌培养基的1 L三角摇瓶中,于30℃、180 r/min摇床培养,每隔0.5 h取样,以开始培养的时间点作为零点,利用Cleverchem 380分析仪测量亚硝态氮的浓度,以亚硝态氮的浓度为纵坐标、培养时间为横坐标作图,得到的斜率乘以稀释倍数(20倍)就是此时段的亚硝化速率。
②用单位时间消耗氨氮的量测定亚硝化速率。取某发酵时段发酵液10 mL加入装有190 mL的亚硝化细菌培养基的1 L三角摇瓶中,于30℃、180 r/min摇床培养,每隔0.5 h取样,以开始培养的时间点作为零点,利用Cleverchem 380分析仪测量氨氮的浓度,以氨氮的浓度为纵坐标、培养时间为横坐标作图,得到的斜率乘以稀释倍数(20倍)就是此时段的氨氮氧化速率。由于单位时间内的氨氮大多数被转化为亚硝态氮,所以可以用此方法间接计算亚硝化速率。
1.3 亚硝化细菌的分离鉴定
1.3.1亚硝化细菌的分离 将取自大连海水湾的污泥样品加入含有200 mL富集培养基的1 L三角揺瓶中,于30℃、180 r/min摇床培养,直到体系中氨氮全部降解并有亚硝态氮累积。
吸取0.5 mL富集培养液,均匀涂布在硅胶平板上,于30℃恒温培养。待硅胶平板上长出针尖大小的菌落后,挑取硅胶平板上多个单菌落并分别在琼脂平板上划线,于30℃恒温培养。再挑取琼脂平板上的菌体分别接入含有20 mL亚硝化细菌富集培养基的100 mL三角揺瓶中,于30℃、180 r/min摇床培养,并于培养过程中检测发酵液中的亚硝态氮浓度,选取可不断生成亚硝态氮的菌株继续培养,当亚硝化细菌在揺瓶中生长到一定浓度后静置沉降,向浓缩的菌液加入等体积的50%甘油,分装于菌种管内于-70℃保存。
1.3.2亚硝化细菌的鉴定 利用收集的亚硝化细菌菌体提取菌株基因组DNA,以提取的DNA为模版,以5′-GGAAGTAAAAGTCGTAACAACG-3′、5′-TCCTCCGCTTATTGATATGC-3′为引物,进行PCR扩增。PCR 反应体系(50 μL):DNA 模板1 μL,2.5 mmol/L dNTP 4 μL,1 mmol/L引物各1 μL,10×Loading Buffer 5 μL,5 U/μLTaq酶0.5 μL,ddH2O 37.5 μL。扩增程序:94℃ 5 min;94℃ 30 s,52℃ 60 s, 72℃ 2 min,共30个循环;72℃ 10 min。将扩增产物交至苏州金唯智生物科技有限公司测序,将测序结果在NCBI(http://www.ncbi.nlm.nih.gov/)数据库BLAST中进行序列对比,利用MEGA 7.0软件以Neighborjoining法绘制系统发育树,并将菌株命名为Sys NC-02。
1.4 亚硝化细菌氨氮去除能力考察
将新分离获得的亚硝化细菌Sys NC-02与本实验室原有的1株亚硝化细菌Nitrosomonassp. HPC101进行对比,以考察Sys NC-02的氨氮去除能力。
分别吸取Sys NC-02和HPC101的培养液接种于含有亚硝化细菌富集培养基的揺瓶中,通过调整接种体积使2种亚硝化细菌在揺瓶内的亚硝化速率相同,同时放入摇床中培养(30℃、180 r/min)。每隔0.5 h取样,48 h后,检测发酵液中氨氮含量并计算氨氮去除率,同时通过测定亚硝态氮浓度来计算亚硝化速率,进而考察2种亚硝化细菌的氨氮去除能力及生长能力。
1.5 亚硝化细菌培养条件的优化
1.5.1温度、pH、溶解氧浓度对亚硝化细菌的影响 最适温度确定:将Sys NC-02菌液分别接种于6个含有亚硝化细菌富集培养基(pH 8.0)的1 L三角瓶中,分别在15℃、20℃、25℃、30℃、35℃、40℃条件下,180 r/min摇床培养。最适pH确定:分别向pH为6.5、7.0、7.5、8.0、8.5的5个含有亚硝化细菌培养基的1 L三角瓶中接种Sys NC-02菌液,于最适温度、180 r/min摇床培养。最适溶解氧浓度确定:将Sys NC-02菌液分别接种于7个含有亚硝化细菌培养基(最适pH)的1 L三角瓶中,在最适温度下,分别以80 r/min、100 r/min、120 r/min、140 r/min、160 r/min、180 r/min、200 r/min进行摇床培养,并用溶氧仪测量发酵液的溶解氧浓度。上述处理均需每隔0.5 h取样,测量发酵液中的亚硝态氮的浓度,通过比较计算得到的亚硝化速率大小来确定培养亚硝化细菌Sys NC-02的最适温度、pH和溶解氧浓度。
1.5.2亚硝态氮浓度对亚硝化细菌的影响 分别向含有亚硝态氮浓度为50 mg/L、100 mg/L、200 mg/L、500 mg/L、1 000 mg/L、1 500 mg/L、2 000 mg/L的亚硝化细菌富集培养基(最适pH)的1 L三角揺瓶中接种Sys NC-02菌液,在最适温度下,于120 r/min摇床培养。每隔0.5 h取样,测量发酵液中氨氮的浓度,通过计算得到的氨氮氧化速率大小确定发酵过程中亚硝态氮(即亚硝酸盐)累积对亚硝化细菌Sys NC-02的影响。
1.6 亚硝化细菌发酵培养基的优化
1.6.1培养基组分单因素实验 最适碳源筛选:在不含Na2CO3的亚硝化细菌富集培养基中分别加入0.5%的Na2CO3、NaHCO3、CaCO3,每个处理3次重复,在最优培养条件下进行培养,考察不同碳源对Sys NC-02生长的影响。最适碳源作为下一步实验用碳源。最适氮源筛选:在不含(NH4)2SO4的亚硝化细菌富集培养基中分别加入0.4%的(NH4)2SO4、NH4NO3、NH4Cl,每个处理3次重复,在最优培养条件下进行培养,考察不同氮源对Sys NC-02生长的影响。最适氮源作为下一步实验用氮源。最适磷酸盐筛选:在不含K2HPO4的亚硝化细菌富集培养基中分别加入0.1%的K2HPO4、KH2PO4、NaH2PO4,每个处理3次重复,在最优培养条件下进行培养,测定不同磷酸盐对Sys NC-02生长的影响。最适磷酸盐作为下一步实验用磷酸盐。最适微量元素筛选:在不含MgSO4的亚硝化细菌富集培养基中分别加入0.005%的MnSO4、FeSO4、MgSO4,每个处理3次重复,在最优培养条件下进行培养,测定不同微量元素对Sys NC-02生长的影响。
1.6.2培养基组分正交试验 根据1.6.1的结果,选定培养基中4个营养组分,设计4因素3水平试验,各因素的试验水平见表1。在最优培养条件下进行培养,通过比较不同处理的亚硝化速率大小来对培养基中各成分的含量进行调整。
1.6.3污水处理效果对比 分别向优化培养基和原培养基中接种相同体积的Sys NC-02菌液,于最优培养条件下进行培养,48 h后将2种培养基中的Sys NC-02菌液以相同的接种量分别接种至含有氨氮污水的三角揺瓶中,于30℃、180 r/min摇床中培养。每12 h取样,检测污水中氨氮含量并计算氨氮去除率,进而验证培养基优化后亚硝化细菌对污水的处理效果。
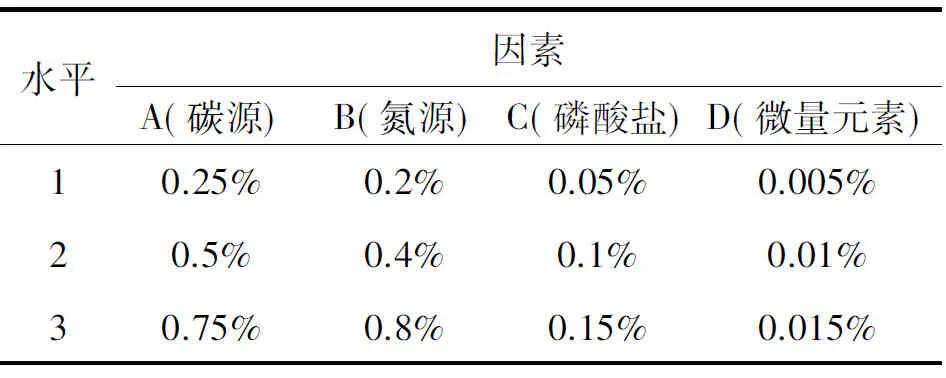
表1 正交设计因素水平表Table 1 Factors and levels of orthogonal test.
1.7 亚硝化细菌10 L发酵罐小试生产条件优化
利用10 L发酵罐进行高密度发酵,以优化小试生产条件。利用亚硝化细菌在发酵液中静止后易沉降及其在发酵过程中不需要绝对无菌的特点,以新鲜培养基对亚硝化细菌发酵过程中的发酵液进行置换,以降低发酵液中亚硝态氮(即亚硝酸盐)的浓度,从而大幅降低亚硝酸盐对亚硝化细菌的生长抑制作用以实现亚硝化细菌的高密度发酵。
在亚硝化细菌发酵后期,亚硝态氮浓度累积到抑制浓度(即该浓度对亚硝化细菌的生长产生抑制作用)之前,停止搅拌和通气,使亚硝化细菌沉降30 min,然后吸走发酵上清液,保留的发酵液体积为原体积的1/3,再补加新鲜培养基至原体积,开启搅拌及通气继续发酵。当亚硝态氮浓度再次累积到抑制浓度时继续进行发酵液置换,置换的次数由发酵罐的供氧能力和亚硝态氮再次到达抑制浓度的时间来决定。
1.8 数据分析
采用Microsoft Excel 2013软件对数据结果进行处理与作图,采用单因素方差分析(one-way ANOVA)进行差异显著性检验,P<0.05为差异具有统计学意义。
然后我发现他们谁也没有把我这句话听进去,我把这句话说了好几遍,到头来只有我一个人听进去了。这时候我打算离开了,我心想不能再这么混下去了,我们从原先那个家搬到这个新的家里来,都有一个星期了,我每天都在这里整理、整理的,满屋子都是油漆味和灰尘在扬起来。我才二十四岁,可我这一个星期过得像个忙忙碌碌的中年人一样,我不能和自己的青春分开得太久了,于是我就站到厨房和书房的中间,我对我的父母说:“我不能帮你们了,我有事要出去一下。”
2 结果与分析
2.1 菌株分离鉴定
将海洋污泥富集培养后,经硅胶平板和水洗琼脂平板分离得到单菌落的亚硝化细菌,其在水洗琼脂平板培养基上形成的菌落较小、呈圆形、周边光滑、油状、半透明。生物显微观察显示其细胞体呈短杆状、表面光滑,革兰氏染色为阴性。
将测得的16S rDNA基因序列通过GenBank进行Blast比对,利用MEGA 7.0软件以Neighborjoining法绘制系统发育树。如图1所示,菌株Sys NC-02与Nitrosomonaseuropaeastrain C-31菌株的同源性为100%,初步确定Sys NC-02属于亚硝化单胞菌Nitrosomonassp.。
2.2 菌株氨氮去除能力
将Sys NC-02菌株与本实验室原有的1株亚硝化细菌Nitrosomonassp. HPC101进行对比,由表2可知,新分离得到的亚硝化细菌Sys NC-02的氨氮去除率和生长能力都具有较为明显的优势,具有进一步研究的价值。
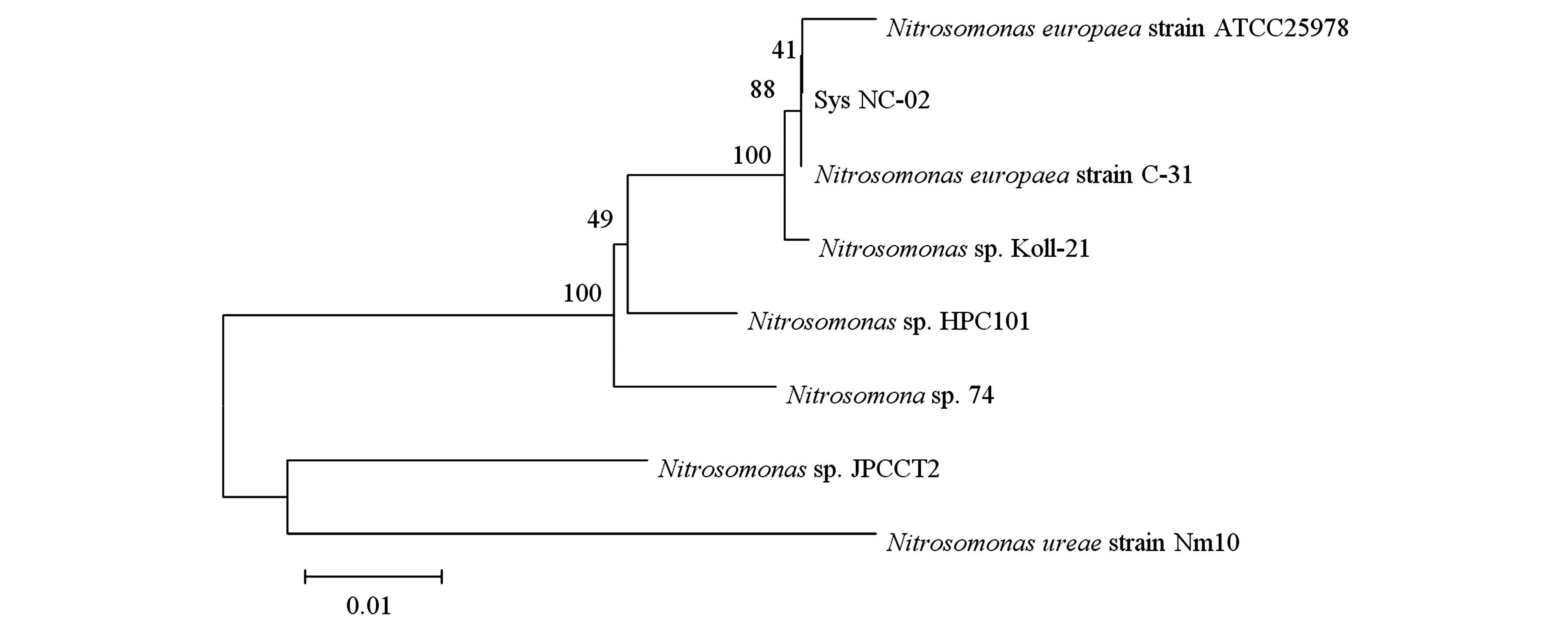
图1 亚硝化细菌的同源性分析Fig.1 Homology analysis of nitrite bacteria.
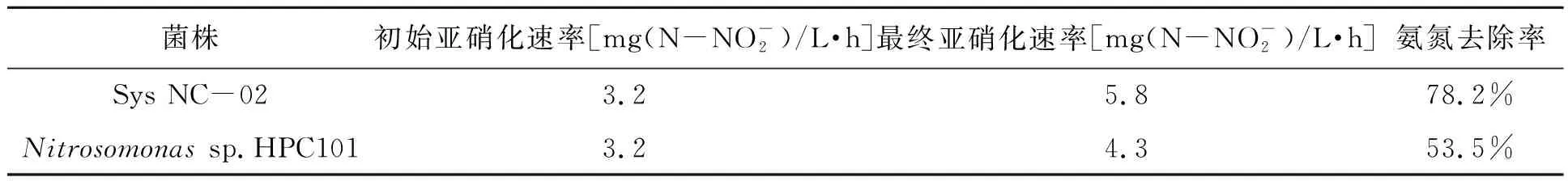
菌株初始亚硝化速率[mg(N-NO-2)/L·h]最终亚硝化速率[mg(N-NO-2)/L·h]氨氮去除率Sys NC-023.25.878.2%Nitrosomonas sp.HPC1013.24.353.5%
2.3 亚硝化细菌培养条件的优化
2.3.1最适温度 在不同温度条件下培养Sys NC-02,并测量发酵液中亚硝态氮的浓度,进而计算相应的亚硝化速率。由图2可知,15℃时,亚硝化速率几乎为零;随着温度升高,亚硝化速率逐渐升高,30℃时,亚硝化速率达到最大值;而后,随着温度升高,亚硝化速率逐渐降低。由此可推测,温度过高或过低时都会影响亚硝化细菌氨氧化酶的活性,从而影响亚硝化速率的大小。因此,培养亚硝化细菌Sys NC-02的最适温度为30℃。
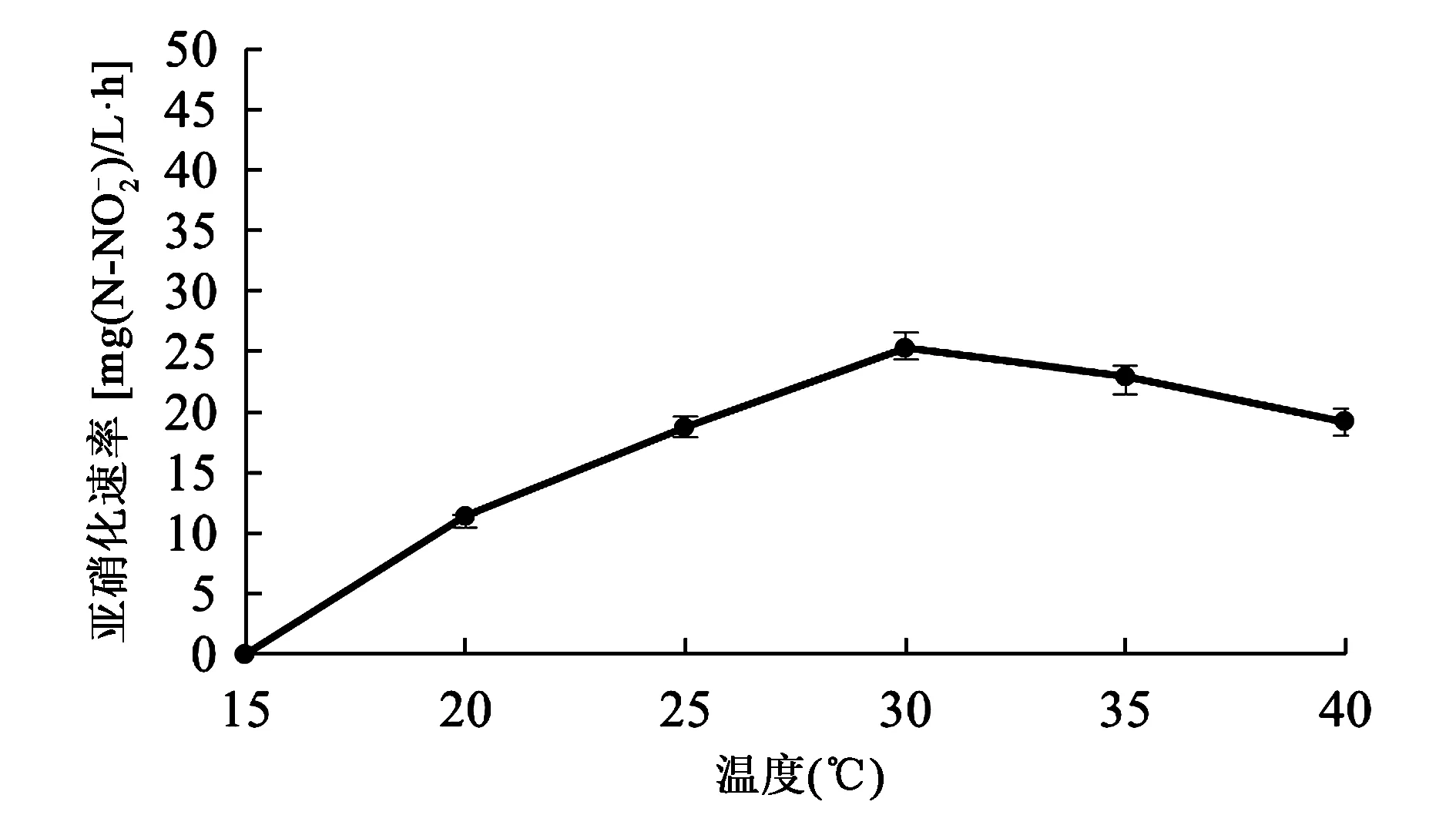
图2 温度对亚硝化细菌的影响Fig.2 The effect of temperature on nitrite bacteria.
2.3.2最适pH 在不同pH条件下培养Sys NC-02,并测量发酵液中亚硝态氮的浓度,进而计算相应的亚硝化速率。一般认为亚硝化细菌的最适pH为7.5~8.5。从图3可以看出,pH为8.0时,亚硝化速率最大;pH低于8.0时,亚硝化速率呈递减趋势;pH高于8.0时,亚硝化速率急剧下降,这可能是在pH为8.5时,游离氨浓度的增加抑制了亚硝化细菌的生长代谢[13,14]。由此可知,培养亚硝化细菌Sys NC-02的最适pH为8.0。
2.3.3最适溶解氧浓度 亚硝化细菌属于好氧菌,发酵液中的溶解氧在其生长过程中起着重要作用。在30℃、pH 8.0的条件下,将Sys NC-02置于不同转速的摇床中进行培养,用溶氧仪测量发酵液中的溶解氧浓度,同时,测量发酵液中亚硝态氮的浓度,进而计算相应的亚硝化速率。
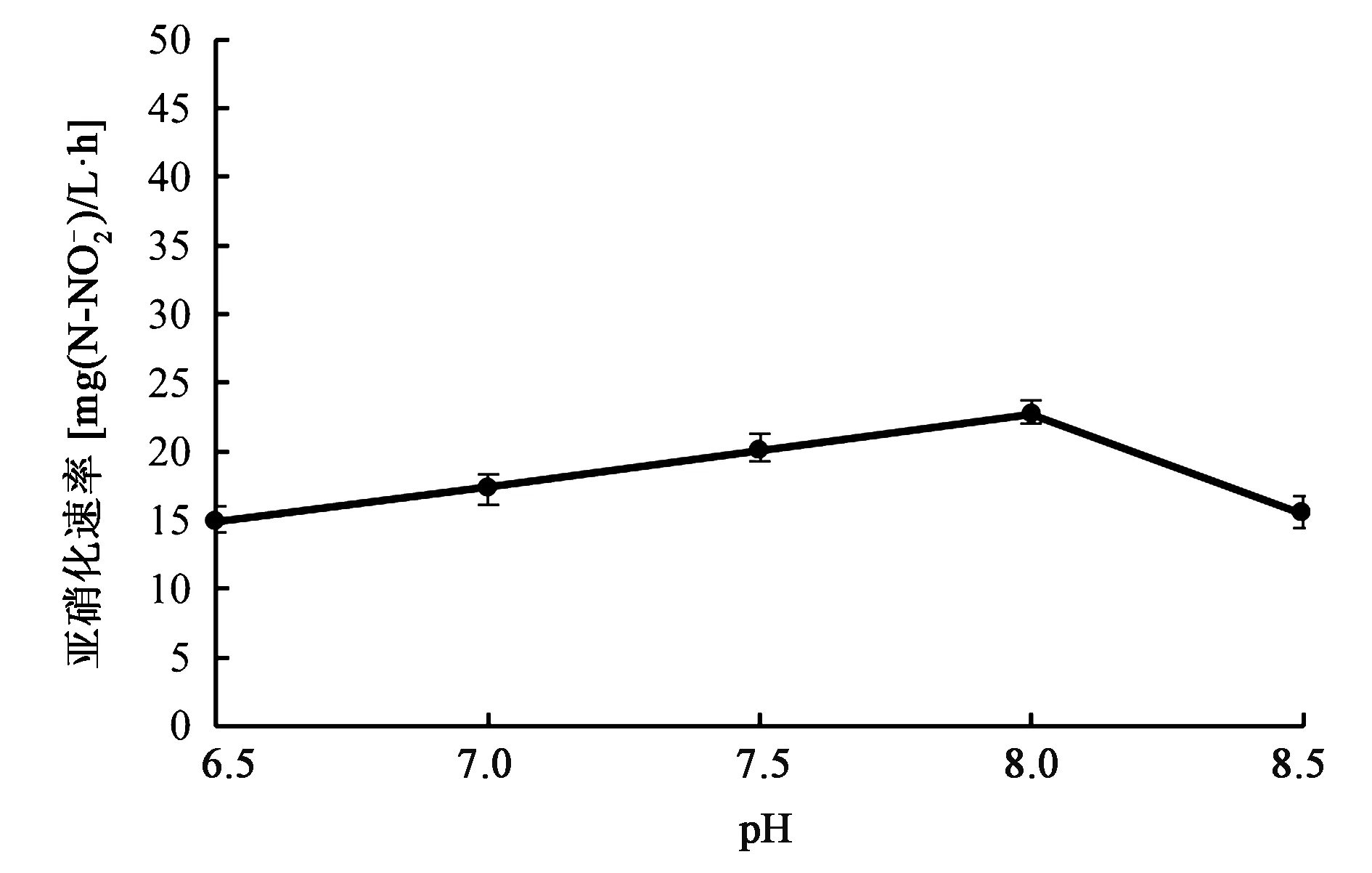
图3 pH对亚硝化细菌的影响Fig.3 The effect of pH on nitrite bacteria.
由图4可知,最初亚硝化细菌的亚硝化速率随着溶解氧浓度的升高而增大;当转速大于120 r/min、溶解氧浓度高于1.8 mg/L时,亚硝化速率趋于稳定,不再随溶解氧浓度的升高而增大。这说明溶解氧浓度≥1.8 mg/L时即可满足亚硝化细菌的生长需求。因而,从经济方面考虑,在发酵过程中保持溶解氧浓度≥1.8 mg/L是较为合适的。
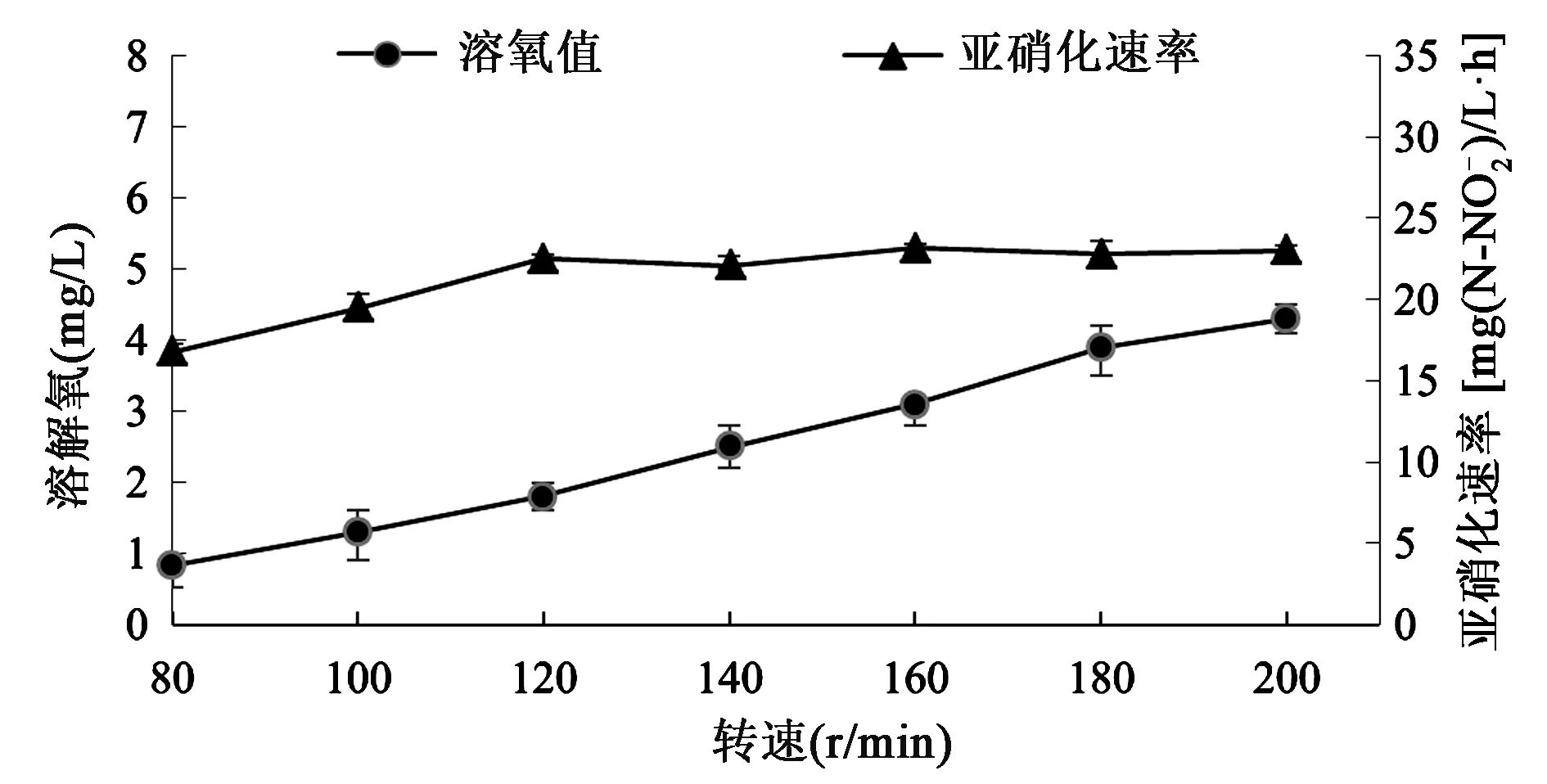
图4 溶解氧浓度对亚硝化细菌的影响Fig.4 The effect of dissolved oxygen concertration on nitrite bacteria.
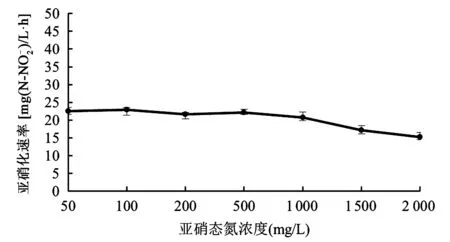
图5 亚硝态氮浓度对亚硝化细菌的影响Fig.5 The effect of nitrite concentration on nitrite bacteria.
2.4 亚硝化细菌发酵培养基的优化
2.4.1单因素实验 以亚硝化细菌富集培养基为基础,利用不同的碳源、氮源、磷酸盐和微量元素,考察不同组分对亚硝化细菌生长的影响。由图6可知,通过4组单因素实验及差异显著性分析结果(P<0.05)可以确定,最优培养基组合:碳源为NaHCO3、氮源为(NH4)2SO4、磷酸盐为KH2PO4、微量元素为FeSO4。
2.4.2正交试验 根据上述单因素实验筛选结果,NaHCO3、(NH4)2SO4、KH2PO4、FeSO4分别为最适碳源、氮源、磷酸盐和微量元素。将各因素做正交试验,选用正交表L9(34)进行正交设计(表3),以优化亚硝化细菌发酵培养基组分。
由表3可知,4种因素对亚硝化细菌生长的影响大小:(NH4)2SO4>NaHCO3>KH2PO4>FeSO4。同时,发酵培养基中最佳组合为A2、B3、C2、D2,即亚硝化细菌最佳培养基组成为0.5% NaHCO3、0.8% (NH4)2SO4、0.1% KH2PO4、0.01% FeSO4。
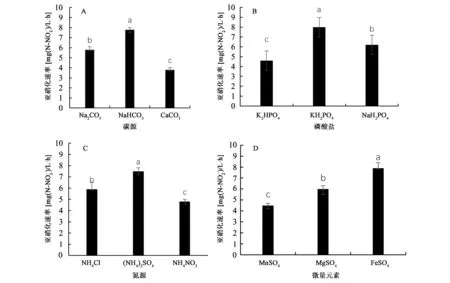
图6 不同组分对亚硝化细菌亚硝化速率的影响Fig.6 The effects of different media on nitrosation rate of nitrite bacteria.注:不同小写字母表示不同处理间差异显著(P<0.05)。
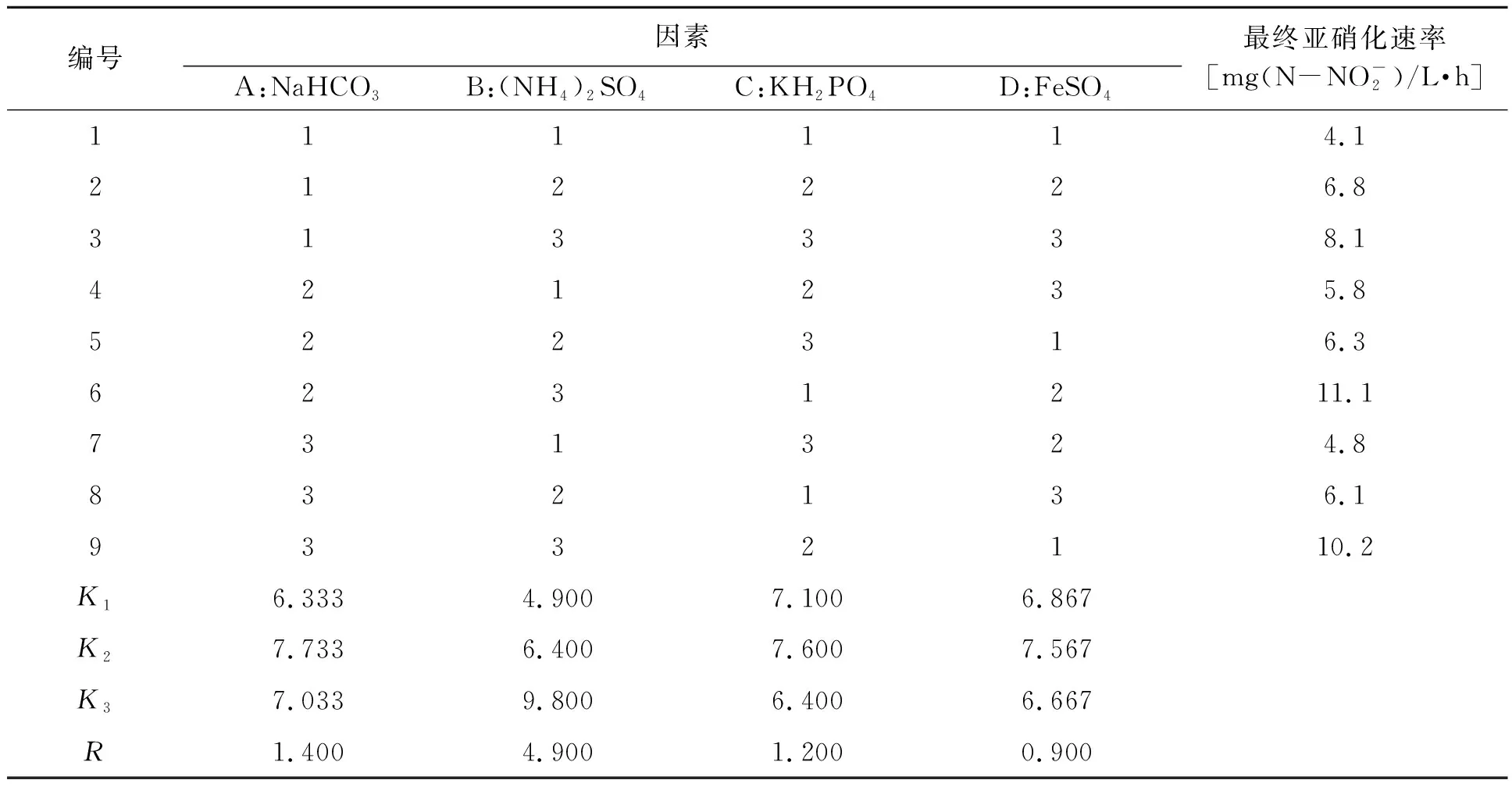
编号因素A:NaHCO3B:(NH4)2SO4C:KH2PO4D:FeSO4最终亚硝化速率[mg(N-NO-2)/L·h]111114.1212226.8313338.1421235.8522316.36231211.1731324.8832136.19332110.2K16.3334.9007.1006.867K27.7336.4007.6007.567K37.0339.8006.4006.667R1.4004.9001.2000.900
注:R为系列因素的极差,其绝对值大小代表不同因素对亚硝化细菌生长的影响程度,R越大,影响程度越大,反之亦同。Ki为不同因素不同水平所对应试验指标之和的平均值,选择较大的Ki值所对应的水平作为该因素的最佳水平,即若某因素的K2>K1,则选择水平2作为该因素的最佳水平。
2.4.3污水处理效果对比 分别向优化培养基和原培养基中接种相同体积的Sys NC-02菌液,于最优培养条件下进行培养,再以相同的接种量分别接种于含有氨氮污水的三角揺瓶中,以验证培养基优化后亚硝化细菌对污水的处理效果。由图7可知,处理36 h后,优化培养基组对氨氮的降解效果显著优于原始培养基组(P<0.05)。说明培养基优化后,Sys NC-02单位体积的发酵液活性有了较大提高。
2.5 亚硝化细菌10 L发酵罐小试生产条件优化


图8 优化条件发酵数据曲线Fig.8 The data curves of optimized fermentation conditions.


图9 进行2次发酵液置换的发酵曲线Fig.9 The data curves for performed twice fermentation broth replacements.
3 讨论
本研究将沿海污泥富集培养后,通过硅胶平板和水洗琼脂平板分离得到1株亚硝化细菌并命名为Sys NC-02,通过摇瓶培养确定其最优培养条件:最适温度为30℃、最适pH为8.0、最适溶解氧浓度≥1.8 mg/L,与已有研究结果[17~21]基本一致。并通过培养基组分的单因素实验和正交试验确定了最佳的培养基组合及浓度:0.5% NaHCO3、0.8% (NH4)2SO4、0.1% KH2PO4、0.01% FeSO4。优化培养基培养的Sys NC-02对污水中氨氮的去除率显著高于原始培养基,说明优化培养基可较好的促进Sys NC-02的生长,同时提高了其单位体积的活性。
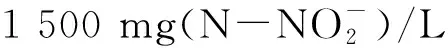
为了在微生物发酵过程中通过控制发酵液中生成物的浓度,以减少其对微生物生长的抑制作用,常用的可行途径为2种。一种是以指数流加为代表的流加方法,通过控制发酵过程中底物的浓度以降低副产物的生成累积对细菌生长的抑制[23],这种方法比较适用于大肠杆菌、酵母菌等的高密度发酵,此类生物的共同特性是其获取能量的反应速度与反应物的浓度有关,通常在一定浓度范围内,浓度越大细菌生长速度越快,副产物累积也越快,对微生物生长的抑制作用也越大。而亚硝化细菌的代谢属于生物反应中较为特殊的零级反应,亚硝酸盐的生成速度在一定条件下与氨氮浓度无关。因此,流加类方法不适用于亚硝化细菌的发酵。
另一种方法是在发酵过程中通过利用新鲜培养基置换一部分发酵液的方法,将发酵产物浓度控制在一定范围内,降低发酵产物的浓度对生物生长的抑制作用,从而实现高密度发酵,如目前在细胞培养中较为流行的灌流法[24,25]采用的就是这一原理,此类方法可以保证细菌或细胞不随置换液流失,又可以降低发酵液中代谢产物的累积,较好的促进了微生物或细胞的生长。当然此类方法只适用于在发酵液中沉降性较好的微生物和用微载体进行培养的贴壁细胞。
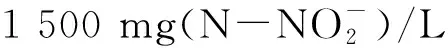
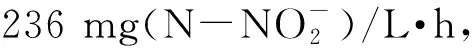
需要注意的是,本研究虽然利用灌流培养的方式实现了亚硝化细菌的高密度发酵,但为了控制亚硝酸盐浓度,整个发酵过程需要人工长期值守且需要较为频繁的检测,增加了人力物力成本,所以此发酵方式还需进一步优化。今后主要研究方向是通过发酵实验数据的累积建立氨氮的加入量与亚硝酸盐生成量的数据模型,通过数据模型计算出亚硝酸盐的累积浓度,从而减少检测频率;并以数据模型为依据对发酵设备硬件和软件进行改造,争取实现亚硝化细菌在无人值守下的自动发酵,为亚硝化细菌工业化生产提供技术支持。

