计算机模拟设计治疗急性关节炎的秋水仙碱生物电子等排抑制剂研究
孙 婧, 刘 丹, 慧文其
1.陕西中医药大学药学院,陕西咸阳 712046;2.西安市第五医院, 陕西中医药大学附属中西医结合医院, 西安 710082
类风湿性关节炎是一种免疫系统疾病,其特征是血清尿酸浓度增加[1]。随着现代计算机技术的发展与计算分子性质方法的开发,让利用计算机技术来帮助药物发现,即计算机辅助药物设计成为可能[2,3]。 如果目标酶的三维结构受体可以通过X射线晶体学获得,并优先与共结晶的配体结合,结合位点和配体的模式用交互式计算机图形技术和计算化学直接研究生物大分子——配体复合物是可行的[4]。因此,研究在配体和酶/受体之间的相互作用也是可行的。将新的候选配体“对接”到结合位点中,以研究该结构是否能够以最佳方式与受体相互作用, 这个过程被称为基于结构的配体设计[5~7]。
秋水仙碱(Colchicine,COL)是一种用于治疗类风湿性关节炎的药物,它能够阻止白细胞进入受影响的区域,因此有助于缓解疼痛和压痛,适用于急性关节炎。 但是,秋水仙碱会导致严重的副作用,包括腹泻、恶心、抽筋、腹痛和呕吐等[8~10]。实验研究近一步证明秋水仙碱还会导致基因突变和复制障碍。因此, 寻找COL对类风湿性关节炎有效且副作用小的新型衍生分子是治疗类风湿性关节炎新药开发的重要途径之一。本研究运用对接模拟技术设计出秋水仙碱衍生的生物电子等排抑制剂,以期为新药的开发提供参考。
1 材料和方法
1.1 分子对接模拟
所有的计算都使用Autodock(4.2版本)作为对接工具(8-12);利用PyMOL (pymol.org)、 Chimera (cgl. ucsf. edu/chimera)、 Discovery Studio Visualizer v3.5(Dassault Systèmes BIOVI, San Diego, CA, USA)和Molecular Modelling ProPlus(7.0版; Norgwyn Montgomery Software, Inc., North Wales, PA, USA)实现对接研究中的可视化。
1.2 秋水仙碱受体与秋水仙碱对接
1.2.1晶体结构 蛋白质的晶体结构,由与绑定配体相关的受体组成,从结构生物信息学蛋白质数据库中下载。 所有的关于受体结构的主要信息(识别号. 3E22.pdb)均注册在蛋白质数据库中。
1.2.2蛋白质加工 下载的受体蛋白显示了5个链,称为链A~E。 5条多肽链并无共价相互作用,由于此蛋白质的每个单位都不具有酶学性质,所以为了方便计算,在不影响结果的前提下,选择删除其中的4个单位,只留下其中的一个作为靶标进行处理。从这5个链中选择链B进行实验,剩下的链被删除。 链B的微管蛋白质包含COL受体配体,使用Chimera软件分离。
根据文献报道[11],该蛋白由A~E链形成类似常青藤的三维结构,而秋水仙碱与微管蛋白β-2B链相互作用,引发下游信号。其中,β-2B链由蛋白结构中的 B链和D链组成,已报道的蛋白晶体结构显示秋水仙碱与B链结合。因此,为减少计算量,仅模拟B链与配体分子相互作用。
1.2.3配体结构 配体与受体3E22.pdb分离,使用Chimera软件(14)。 配体通过自动对接程序进入受体。
1.2.4网格框 AutoDock中的活性区域是通过在活性点附近创建一个网格框来定义的。网格盒在对接过程中起着重要的作用,因为它们被设计用来覆盖所有在活性区域内存在的氨基酸,这些氨基酸除了在受体中存在外,还是必需的。 网格框工具使用3个拇指轮小部件,这意味着在x、y和z点尺寸可能会改变。网格点之间的间距可以用一个额外的指轮来调整。 在本文的研究中,网格点之间的间距固定为0.408 Å,被考虑的点数分别为x、y和z维度上40、48和50点,x、y和z中心分别为258.798、7.947和28.673。
通过采用以下方法对分子对接的抑制常数Ki进行计算,得到分子对接模拟技术的结果:
Log Ki =ΔG/RT×1/2.303
Ki = e,
ΔG/RT,
Ki = antilog ΔG/1362.97988
其中,G=结合能; R=1.986 kmol; T=298K。
1.2.5齿向修形 已知的微管蛋白抑制剂COL被替换为不同位点的生物等甾醇, 以提高药效和药物的相似性, 并减少毒性和相关副作用。
1.2.6毒性、吸收、分布、代谢和排泄毒性(ADME-T)研究 修饰后的分子(organic-chemistry.org/prog/peo)使用在线程序OSIRIS分析,预测任何有毒基团或具有ADME-T活性的分子。
2 结果与分析
2.1 对接
所有的分子都被检出,所有的对接研究都通过检查化学相似性、校准和结合能(表1)进行了验证。COL受体配体在受体内被识别。图1显示了覆盖微管蛋白受体所有结合残基的网格框,并给出了所下载的蛋白质与COL受体配体的所有链。
2.2 验证对接过程
为了验证对接某一特定配体与某一特定大分子的对接过程,本研究考虑了三个参数:①结合能。链接对接配体的结合能在5~15 kcal/mol之间。②叠加。配体的对接构象与被下载的蛋白质的晶体结构叠加。成功地完成了与COL(已经存在于受体内)的Autodock对接算法的测试,并与COL的参考结构(即其晶体结构)进行了对接。图2D为COL生物活性构象叠加的对接构象。为了改进结果,成功地实现了COL的重新对接。③交互。与蛋白质结晶结构中存在的相互作用相比,对接时必须观察到对接的配体与受体之间一致的相互作用。在本研究中观察到的COL结合配体与在微管蛋白受体中存在的结合残基之间的互作如图2E所示。在受体3E22中,ALA15(丙氨酸-15)和ASN228(天门冬酰胺-228)中,所有配体的键都保持弹性。 ALA15和ASN228的所有键都是可旋转的。
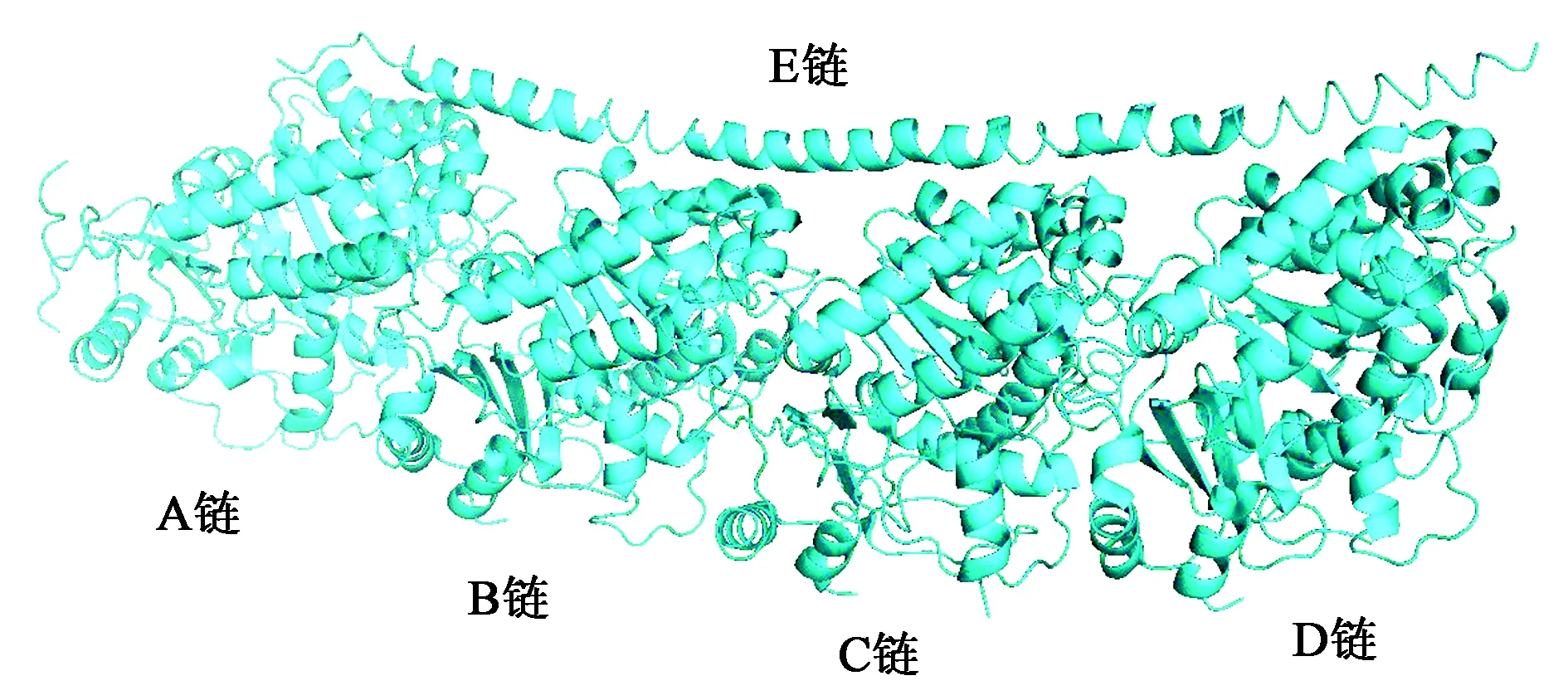
图1 蛋白质与COL受体配体的所有链Fig.1 All the chains of protein and COL receptor ligands.
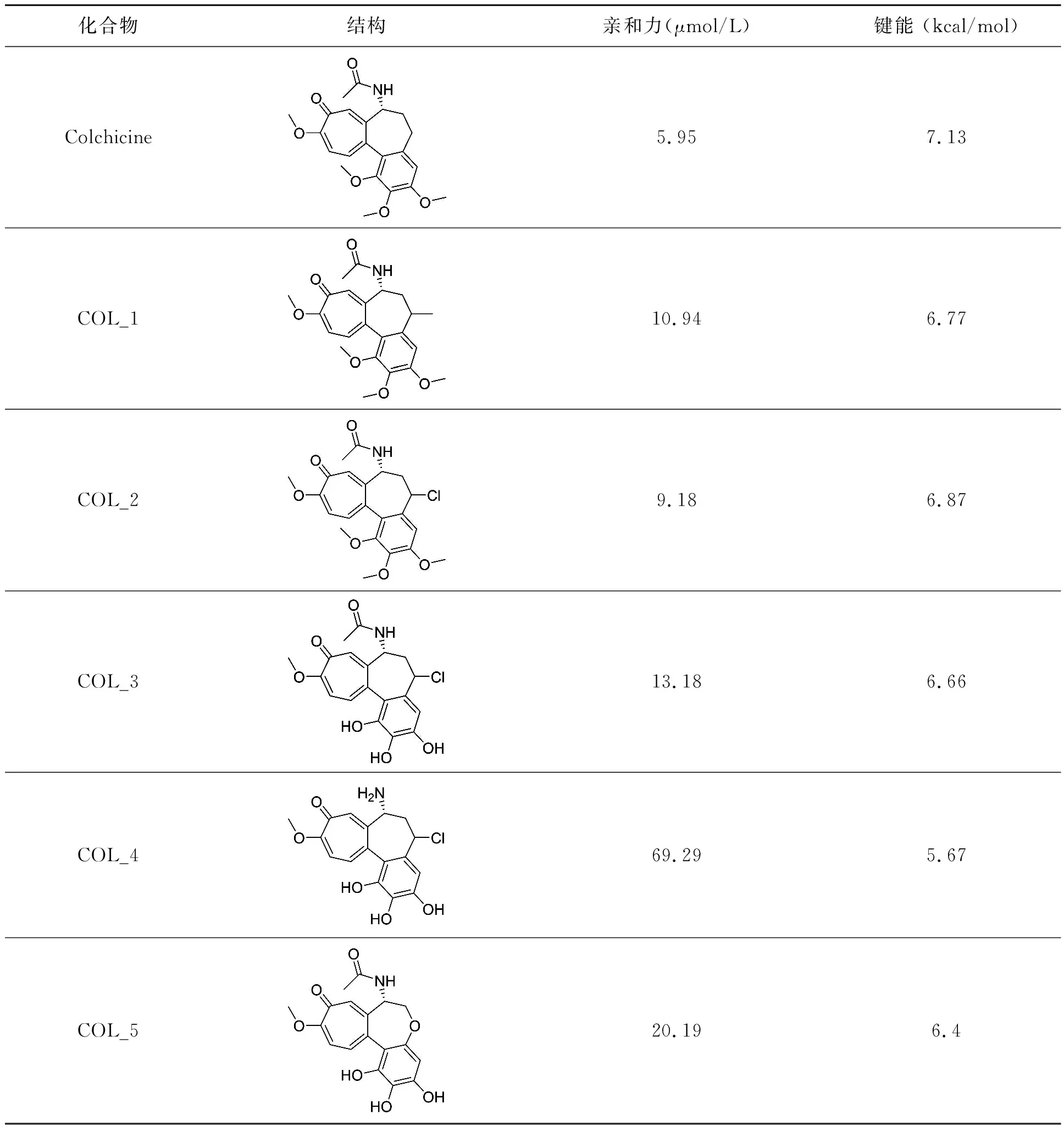
化合物结构亲和力(μmol/L)键能 (kcal/mol)Colchicine5.957.13COL_110.946.77COL_29.186.87COL_313.186.66COL_469.295.67COL_520.196.4
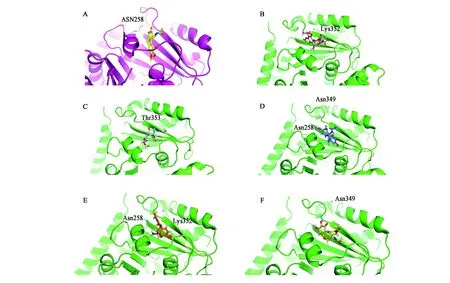
图2 秋水仙碱及其衍生物与3E22蛋白B链相互作用关系图Fig.2 Diagram of interaction of Colchicine and its modified derivative with 3E22 protein B chain.A.秋水仙碱与3E22蛋白B链相互作用;B.设计化合物COL_1与3E22蛋白B链相互作用;C.设计化合物COL_2与3E22蛋白B链相互作用;D.设计化合物COL_3与3E22蛋白B链相互作用;E.设计化合物COL_4与3E22蛋白B链相互作用;F.设计化合物COL_5与3E22蛋白B链相互作用。
2.3 毒性和ADME-T研究
本研究中的毒性和ADME-T分析结果显示在表2中。结果表明,所有4个基于秋水仙碱的微管蛋白抑制剂没有任何主要的毒性效应,包括致突变性、致瘤性、刺激性以及生殖效应,因为在线程序OSIRIS (Molecular Property Explorer)没有确定在设计的分子内存在负责这些毒性作用的任何有毒官能团。所有的分子都具有良好的药代动力学,并严格按照Lipinski的五(18)法则对其理化性质进行筛选。
2.4 COL系列化合物对接模式研究
设计的系列化合物COL_1-5分别与微管蛋白对接,研究其结合模式。化合物COL_1苯环结构上的甲氧基与Lys352之间形成氢键,结合方式不同于秋水仙碱,预测活性较差。COL_2酰胺结构上的羰基与Thr353之间形成氢键,苯环结构横亘于β片层和α螺旋之间,存在空间冲突,预测活性不高。COL_3分别与Asn349和Asn258形成氢键,作用较为牢固,疏水的苯环插入β片层和α螺旋之间,预测活性较佳。COL_4作用方式不同于秋水仙碱,酰胺取代的苯环插入蛋白内部,而三取代的苯环暴露于蛋白外部,同Asn258和Lys352形成氢键,预测活性最佳,但仍需进一步的实验验证。COL_5作用方式类似于COL_4,酰胺结构位于蛋白内部,三取代的苯环位于蛋白外部,同Asn349形成氢键,预测活性也较好。
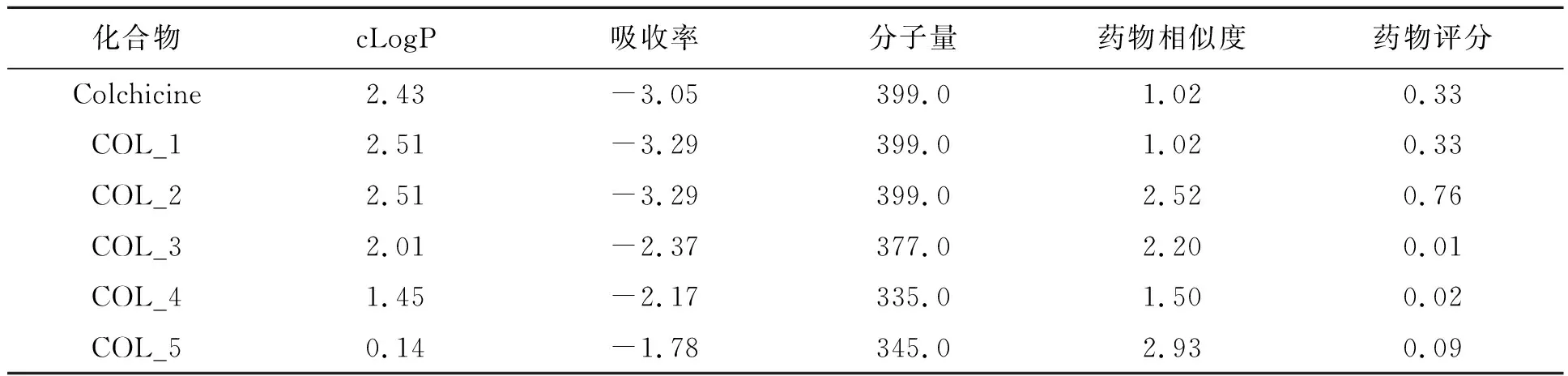
表2 秋水仙碱及其衍生物的吸收、分布、代谢和排泄毒性分析及毒性预测Table 2 Absorption, distribution, metabolism and excretion toxicity profiling and toxicity prediction of Colchicine and the modified Colchicine derivative.
3 讨论
结合已经报道的秋水仙碱与微管蛋白结合的晶体结构,可以看到微管蛋白上的Asn258与秋水仙碱环上的羰基之间有氢键相互作用,疏水的苯并七元环插入由β片层和α螺旋形成的空腔中。文中设计的系列化合物COL_1~5分别与微管蛋白对接,其中COL-3与COL-4均与Asn258有相互作用,与已经报道的文献较为符合,同时考虑到COL-4对接分数最高,与蛋白结合稳定,预测活性较好,有可能成为新型的微管蛋白电子等排抑制剂,但仍需进一步的生物活性测试。
本研究结果表明,新型秋水仙碱类人肾小管蛋白抑制剂可能是治疗关节炎的有效药物。从抑制常数Ki值可以看出,所设计的抑制剂均与大分子表现出良好的结合力。所有设计的抑制剂的毒性和ADME-T分析证实了没有任何毒性官能团。所有的抑制剂都是按照Lippinski’s Rule of Five(18)设计的,因此,所有的抑制剂都表现出与药物相似的作用。与COL相比,所有设计的COL衍生物表现出更强的结合力,此外,与母体分子COL相比,其物理化学性质也有所改善。
——水芹主要害虫识别与为害症状

