青蒿MYB类转录因子AaBPF1的克隆及功能研究
马嘉伟, 王宇婷, 严振宁, 付雪晴, 赵静雅
上海交通大学农业与生物学院, 交大-复旦-诺丁汉植物生物技术研发中心, 上海 200240
疟疾是由疟原虫引起的影响人类健康的传染病,染上疟疾会引起头痛、发热等一系列症状的出现,若情况继续恶化,则可能导致昏迷甚至死亡[1]。2017年,全球疟疾感染2.19亿例,因疟疾死亡人数为43.5万人[2]。青蒿(ArtemisiaannuaL.),又名黄花蒿,是一年生草本植物,茎直立、叶互生、地上部分多分枝,原产于中国,是我国传统的中草药,广泛分布于全国各地[3]。1972年,我国研究人员从青蒿中分离得到抗疟有效单体青蒿素,这一发现引起了全球科学家的广泛关注;1981年,屠呦呦等[4]的研究表明青蒿素是一种含有过氧桥结构的倍半萜内酯化合物。世界卫生组织(World Health Organization,WHO)推荐使用青蒿素联合疗法(artemisinin-based combination therapies,ACTs)以减少疟疾死亡人数[5]。此外,研究报道青蒿素及其衍生物还具有抗病毒[6]、抗癌[7]和抗血吸虫[8]的作用。目前,市场上青蒿素的生产主要来源于植物提取,但是青蒿素含量较低,仅为叶片干重的0.01%~1%[9]。尽管酵母半合成青蒿素已经取得了成功,但其生产成本高,每年的生产量远不能满足全球青蒿素的需求量[10]。因此,利用植物代谢工程手段提高青蒿中青蒿素的含量是十分必要的。

图1 青蒿素生物合成途径Fig.1 Biosynthetic pathways of artemisinin in A. annua.注:FPS:法尼基焦磷酸合酶;ADS:紫穗槐-4,11-二烯合成酶;CYP71AV1:紫穗槐-4,11-二烯氧化酶;CPR:细胞色素还原酶;ADH1:乙醇脱氢酶1;DBR2:青蒿醛Δ11(13)双键还原酶;ALDH1:乙醛脱氢酶1。
青蒿素合成途径已经基本解析清楚,如图1所示,青蒿素合成前体物质异戊烯基二磷酸(isopentenyl pyrophosphate,IPP)及其异构体二甲基烯丙基二磷酸(dimethylallyl pyrophosphate,DMAPP)分别来源于2种途径:在胞质中发生的甲羟戊酸(mevalonate,MVA)途径和在质体中发生的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-enthritol-4-phosphate,MEP)途径[11]。法尼基焦磷酸(famesyl pyrophosphate,FPP)是青蒿素生物合成的直接底物,由IPP和DMAPP在法尼基焦磷酸合酶(farnesyl pyrophosphate synthase,FPS)的催化下生成。青蒿的分泌型腺毛是合成青蒿素的部位,青蒿素就储存在蜡质囊腔中[12,13]。从FPP开始的一系列催化反应属于青蒿中青蒿素特有的合成代谢途径。FPP在紫穗槐-4,11-二烯合成酶(amorpha-4,11-diene synthase,ADS)的催化下生成紫穗槐二烯,这是进入青蒿素特异代谢途径的第一步重要反应[14,15]。然后在紫穗槐-4,11-二烯氧化酶(amorpha-4,11-diene 12-hydroxylase,CYP71AV1)及其配体细胞色素还原酶(cytochrome P450 reductase,CPR)和乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)的作用下,紫穗槐二烯氧化水解生成青蒿酸[16]。在青蒿醛Δ11(13)双键还原酶(artemisinic aldehyde Δ11(13) reductase,DBR2)与ALDH1的催化下形成二氢青蒿酸[17,18]。而青蒿酸转化为青蒿素B和二氢青蒿酸转化为青蒿素的过程是非酶促光氧化过程[19,20]。
转录因子是一类能够特异结合基因的启动子从而调控基因表达的蛋白质分子,如苹果(Malusdomestica)转录因子MdMYB1可以与MdCOP1s互作,并通过直接结合花青素合成酶基因MdUFGT和MdDFR启动子以调控花青素的合成[21]。目前的研究也证明了转录因子广泛地参与了青蒿素的生物合成过程。在青蒿中,属于AP2/ERF转录因子家族的AaORA能够调控ADS、CYP71AV1和DBR2的表达水平从而提高青蒿素的生物合成[22]。本课题组从青蒿中克隆了AabZIP1转录因子,研究发现AabZIP1能够直接结合ADS和CYP71AV1的启动子,通过促进ADS和CYP71AV1基因的表达来调控青蒿素的合成[23];同时还克隆了1个受茉莉酸诱导的bHLH家族的转录因子AaMYC2,其可通过与CYP71AV1和DBR2的启动子结合影响青蒿素的合成[24]。而属于WRKY转录因子家族的AaGSW1不仅受到AabZIP1和AaMYC2的直接调控,还能够结合CYP71AV1和AaORA的启动子从而通过多条路径实现对青蒿素合成的调控[25]。MYB类转录因子家族是植物中最大的转录因子家族之一,广泛参与植物的生长发育以及代谢过程。然而,目前对青蒿中MYB类转录因子的研究相对较少,只有Matías-Hernández等[26]在青蒿中克隆了AaMYB1,当在青蒿中过表达AaMYB1基因时,多个青蒿素合成途径的关键酶基因,尤其是ADS和CYP71AV1,基因表达量显著提高,转基因青蒿中青蒿素的含量也显著提高。
光作为重要的环境因子之一,不仅为植物提供生存的能量,还影响植物的生长发育[27]。植物可通过光敏色素、隐花色素、向光素和紫外光受体接收光信号,并形成复杂的转录调控网络响应光信号[28]。多项研究表明,光信号广泛地参与了植物次生代谢产物的合成。Hong等[29]通过在青蒿中过量表达拟南芥(Arabidopsisthaliana)蓝光受体AtCRY1基因显著提高了转基因青蒿植株中青蒿素的含量。本课题组前期研究发现,植物激素茉莉酸甲酯(methyl jasmonate,MeJA)促进青蒿素的合成是依赖于光的,在黑暗条件下MeJA处理后的青蒿幼苗中青蒿素合成酶基因ADS、CYP71AV1和ALDH1表达量并没有提高[30]。Zhang等[31]使用不同光质处理青蒿幼苗,持续2 d后测定青蒿中的青蒿素及青蒿酸的含量,结果发现,与白光相比,红光处理的青蒿幼苗积累了更多的青蒿素及青蒿酸。由此可见,红光能够促进青蒿素的合成,但是红光调控青蒿素合成的机制尚未被揭示。
本研究通过对红光处理6 h的青蒿转录组数据进行分析,筛选出MYB类转录因子AaBPF1,推测AaBPF1可能参与了红光调控青蒿素的合成,并通过生物信息学分析、基因表达模式分析、Dual-luciferase系统检测以及转基因植株中目的基因表达量、青蒿素含量分析等进行进一步的验证,以期为揭示光调控青蒿素合成机制的研究奠定基础,并为青蒿素代谢工程提供良好的候选基因。
1 材料与方法
1.1 材料与试剂
本实验使用的所有青蒿种子均来自重庆,保存于交大-复旦-诺丁汉植物生物技术研究中心,本实验使用的烟草为本氏烟草(Nicotianabenthamiana)。青蒿及烟草的生长条件:16 h光照、8 h黑暗,于24℃培养间进行培养。
KOD DNA聚合酶购于日本东洋纺绩株式会社,Taq酶、PrimeScriptRTreagent kit(Perfect Real Time)试剂盒购自大连TaKaRa公司,植物总RNA提取试剂盒、SuperReal PreMix Plus定量试剂盒均购于天根生化科技(北京)有限公司,Dual-Luciferase Reporter Assay System试剂盒购于普洛麦格(北京)生物技术有限公司,Axygen胶回收试剂盒、Axygen质粒提取试剂盒购于康宁生命科学(吴江)有限公司,非连接酶依赖型单片段快速克隆试剂盒(ClonExpress Ⅱ One Step Cloning Kit)购于南京诺唯赞生物科技有限公司,Gateway系统(美国Invitrogen公司)。
1.2 实验仪器
Mastercycler nexus PCR仪(德国艾本德股份公司),PTC-200 Peltier Thermal Cycler荧光定量PCR仪(伯乐生命医学产品(上海)有限公司),Water alliance 2695液相分析仪(沃物世科技(上海)有限公司),ELSD蒸发光散射检测器(美国奥泰科技有限公司)。
1.3 转录组测序和基因表达分析
选取14 d左右、生长一致的青蒿幼苗置于黑暗中预处理24 h,随后转入40 μmol/m2·s的红光条件下继续培养6 h。各取3份处理0 h和6 h的青蒿叶片(5株青蒿幼苗混样)用于转录组测序,并对测序数据进行拼接和注释。
收集青蒿植株的不同组织(根、茎、幼叶、老叶和花蕾),迅速置于液氮中,研磨至粉末后提取RNA,并利用PrimeScriptRTreagent kit(Perfect Real Time)试剂盒将其反转录成cDNA。根据实时荧光定量PCR(real time fluorescence quantitative PCR,qRT-PCR)引物设计原则,在非保守域设计基因特异性引物(引物序列见表1),扩增产物约150~300 bp,选择青蒿β-actin作为qRT-PCR内参基因,以cDNA为模板进行qRT-PCR分析。反应体系:cDNA模板3 μL,2×SuperReal PreMix 10 μL,上、下游引物各0.8 μL,ddH2O补至20 μL。反应程序:94℃ 10 min;94℃ 40 s,55℃ 40 s,72℃ 2 min,共40个循环。
1.4 AaBPF1基因克隆和载体构建
根据转录组数据库中AaBPF1拼接序列设计基因特异性引物(引物序列见表1),用KOD plus DNA聚合酶进行扩增。PCR反应体系:cDNA模板1 μL,AaBPF1-F 1.5 μL,AaBPF1-R 1.5 μL,dNTPs 5 μL,MgCl22.5 μL,10×KOD Plus Buffer 5 μL,ddH2O补至50 μL。反应程序:94℃ 10 min;94℃ 20 s,55℃ 20 s,68℃ 2 min,共40个循环;68℃ 10 min。取PCR产物经1%琼脂糖凝胶电泳分析,利用Axygen胶回收试剂盒回收目的片段,并与pJET载体连接,转化大肠杆菌(Escherichiacoli)DH5α,将阳性菌液交至铂尚生物技术(上海)有限公司测序。
通过网站(http://web.expasy.org/translate/)获得AaBPF1氨基酸序列,利用Conserved Domain Database(CDD)预测核苷酸结合域(nucleotide-binding domain,NBD)。利用特异性引物BamHI-AaBPF1-F及AaBPF1-SpeI-R扩增AaBPF1片段(PCR反应体系及程序参照KOD plus DNA聚合酶扩增),利用ClonExpress II One Step Cloning Kit将该片段连接到pHB-YFP载体BamHⅠ和SpeⅠ酶切位点上,以构建过量表达载体。再利用特异性引物Topo-AaBPF1-F、Topo-AaBPF1-R扩增部分AaBPF1片段(PCR反应体系及程序参照KOD plus DNA聚合酶扩增),利用Gateway系统(Invitrogen公司)构建pHellsgate12-AaBPF1干扰载体,转化大肠杆菌(Escherichiacoli)DH5α,将阳性菌液交至公司测序。测序鉴定无误后,利用Axgen质粒提取试剂盒抽提质粒,具体按照试剂盒说明书进行操作。所用引物序列见表1。将构建完成的过量表达载体和干扰载体转化农杆菌(Agrobacteriumtumefaciens)EHA105,用于青蒿遗传转化[32]。同时,将pHB-AaBPF1-YFP载体转入农杆菌GV3101,采用农杆菌注射法侵染烟草叶片进行瞬时转化,用于观察亚细胞定位[33]。
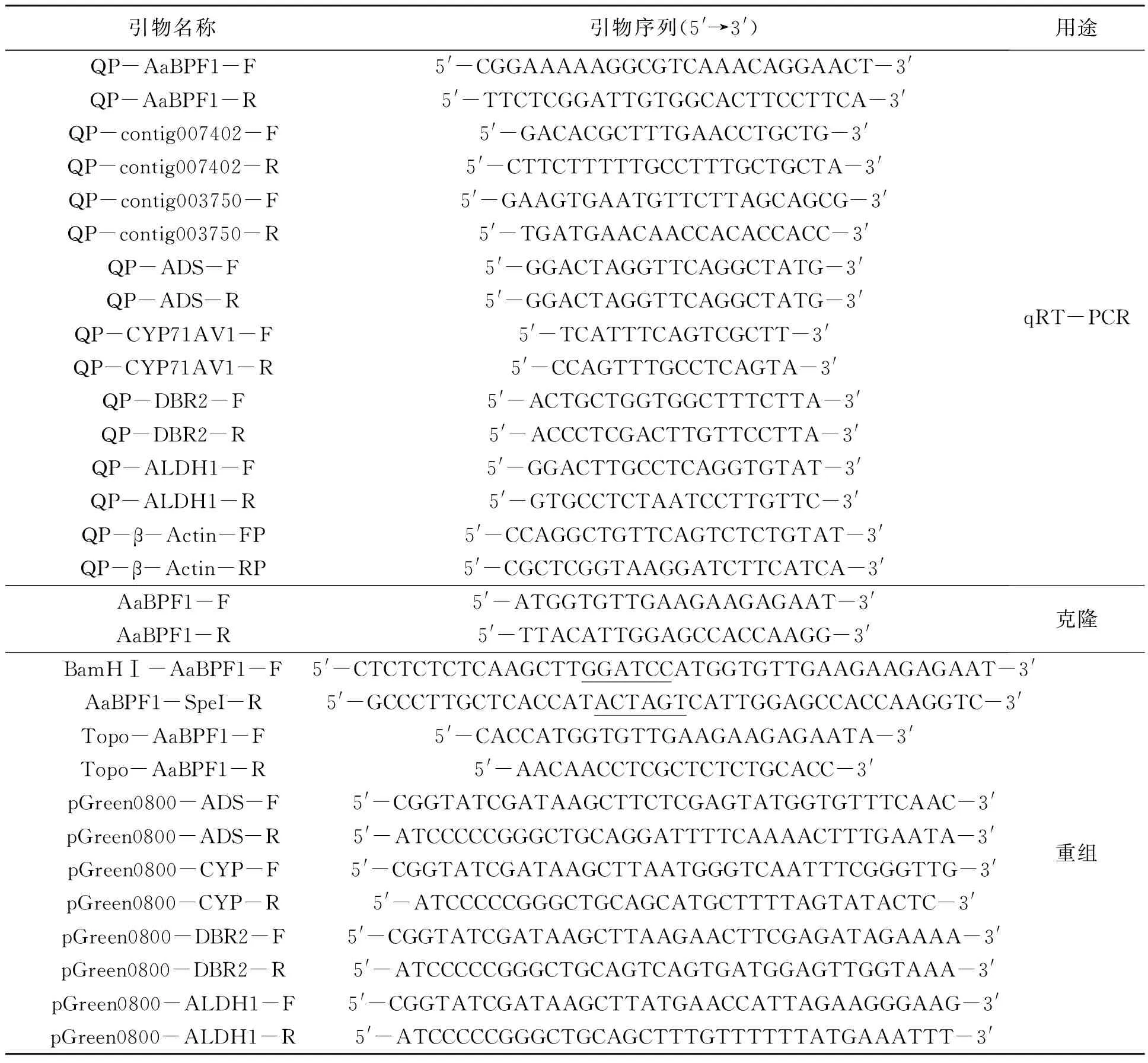
表1 实验所用引物序列Table 1 Primers used in this study.
注:下划线为BamHⅠ和SpeⅠ的酶切位点。
1.5 Dual-luciferase实验分析AaBPF1调控青蒿素合成
扩增ADS、CYP71AV1、DBR2和ALDH1启动子片段(PCR反应体系及程序参照KOD plus DNA聚合酶扩增,所用引物序列见表1),利用ClonExpress II One Step Cloning Kit将PCR产物分别连接到载体pGREEN0800EcoRⅠ和BamHⅠ酶切位点上,与pSOUP18质粒共同转化农杆菌GV3101。将含有启动子和转录因子的农杆菌按照1∶1混合,用农杆菌注射法进行烟草叶片瞬时转化,使用Dual-Luciferase©Reporter Assay System试剂盒检测荧光素酶活性。
1.6 青蒿的遗传转化及分析
用75%乙醇浸泡青蒿种子1 min,10%次氯酸钠浸泡10 min,无菌水反复冲洗数次,将处理后的种子铺在MS固体培养基上培养。幼苗长至5 cm左右时,剪下叶片与农杆菌共培养2 d,之后将外植体转至发芽筛选培养基,在25℃、16 h光照/8 h黑暗的条件下培养2周,约3次继代后,获得潮霉素抗性的丛生芽,随后挑选长势良好的丛生芽剪下转至生根培养基,生根后获得再生青蒿植株,移至土壤中进行培养。
待转基因青蒿生长2个月后,取其第一片叶提取RNA,反转录为cDNA后利用荧光定量PCR分析目的基因的表达量(引物序列见表1),具体方法参照1.3中的基因表达分析。
取2个月大小的转基因青蒿叶片于50℃烘箱中烘干,用研钵研磨成粉末,准确称取0.1 g粉末,加入1 mL甲醇,30℃、50 W超声30 min,12 000 r/min离心10 min后吸取上清液于2 mL离心管中;向沉淀中加入1 mL甲醇,再次超声提取,离心后吸取上清液并与第一次上清液混匀,经0.45 μm过滤器过滤后进样进行高效液相色谱(high performance liquid chromatography,HPLC)分析。使用Water alliance 2695液相分析仪、Waters C18 色谱柱,测定青蒿素的流动相为甲醇∶水=60%∶40%(V/V),测定二氢青蒿酸和青蒿酸的流动相为乙腈∶0.1%冰醋酸=60%∶40%(V/V),流速均为1.0 mL/min;使用ELSD蒸发光散射检测器检测,载气压为5×105Pa,检测器漂移管温度设定为40℃。根据标准品计算出青蒿素在样品干重中所占的比例。
1.7 数据分析
本研究使用TopHat软件对转录组数据进行差异表达分析(http://ccb.jhu.edu/software/tophat/index.shtml)。qRT-PCR的结果分析选择Ct比较法,使用2-ΔΔCt方法进行数据计算与分析。所有图中的误差线(n=3)皆为标准差,且显著性差异分析使用Student’st检验,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 红光诱导的MYB类转录因子的筛选
将黑暗预处理后的青蒿幼苗置于40 μmol/m2·s 红光下处理6 h后进行转录组测序,并对测序结果进行拼接注释。将样品的Unigenes的RPKM值均一化处理后筛选出差异基因,其中,青蒿素合成相关酶基因(ADS、CYP71AV1、DBR2和ALDH1)的表达在红光处理6 h后均上升(图2A)。
MYB类转录因子是一类多功能的蛋白质家族,其参与了植物整个生命过程的调节,包括植物生长和发育的调节、光形态建成的调控、植物激素合成及信号传导的调控等。通过差异分析,本研究筛选出红光处理6 h后表达上升的3个MYB类转录因子(contig009201、contig007402以及contig003750;图2A)。如图2B所示,qRT-PCR进一步证明青蒿素合成酶基因、contig009201、contig007402和contig003750基因表达量在处理后6 h显著高于0 h。结果表明contig009201、contig007402和contig003750很可能参与红光调控青蒿素合成,因此,选择这3个基因作为本研究的候选基因。
2.2 红光诱导的MYB类转录因子基因的表达分析
青蒿素只在青蒿的分泌型腺毛中合成,青蒿素合成酶基因(ADS、CYP71AV1、DBR2和ALDH1)的表达也具有组织特异性,均在花蕾中表达量最高,其次是幼叶[34]。qRT-PCR分析3个候选基因在不同组织中的表达情况,结果如图3A~C所示,其中,contig009201在花蕾中表达量最高,其次是幼叶,在根和茎中的表达量较低。该表达模式与青蒿素合成酶基因(ADS、CYP71AV1、DBR2和ALDH1)类似,而其他2个MYB类转录因子基因表达模式与之不同。因此,选择contig009201作为本研究的目的基因。

图2 受红光诱导的MYB类转录因子的筛选Fig.2 Screening of MYB transcription factors induced by red light.注:A:转录组测序结果中青蒿素合成途径中关键酶基因及筛选到的3个MYB类转录因子红光处理后的基因表达;其中,绿色为低表达,颜色越深,代表表达量越高;红色为高表达,颜色越浅,代表表达量越高。B:qRT-PCR验证青蒿素合成途径中关键酶基因及筛选到的3个MYB类转录因子红光处理后的基因表达。0为红光处理0 h;6 h为红光处理6 h。

图3 3个MYB类转录因子基因在青蒿不同组织中的表达量Fig.3 Relative expression of three MYB transcription factor genes in different tissues of Artemisia annua.
2.3 AaBPF1的克隆与分析
根据转录组测序结果设计特异性引物,以青蒿cDNA为模板扩增得到目的基因contig009201编码区片段,命名为AaBPF1,其全长为1 932 bp,编码643个氨基酸。使用pI/Mw工具(http://www.expasy.org),可知该蛋白质的等电点为9.14,分子量为72.2 kDa。使用NCBI分析该序列发现该转录因子属于MYB家族R3-MYB。多重序列比对显示AaBPF1与长春花BPF同源性为56.1%,与欧芹BPF的同源性为55.4%(图4A)。
AaBPF1的C端融合了黄色荧光蛋白(yellow fluorescent protein,YFP),从而形成AaBPF1-YFP融合蛋白。通过瞬时转化烟草,利用激光共聚焦显微镜观察AaBPF1的亚细胞定位。实验结果表明AaBPF1定位于细胞核中(图4B)。
2.4 AaBPF1与青蒿素合成的调控分析
将青蒿素合成酶基因(ADS、CYP71AV1、DBR2和ALDH1)启动子序列构建到Dual-luciferase系统(图5A),分别与AaBPF1过量表达载体瞬时转化烟草,以验证AaBPF1是否调控青蒿素的合成。如图5B所示,Dual-luciferase系统检测结果表明AaBPF1能够显著激活ADS和CYP71AV1基因的表达。
2.5 过量表达AaBPF1转基因青蒿植株分析
通过农杆菌介导的遗传转化方法,获得70棵抗性植株,PCR鉴定后获得63棵AaBPF1过量表达转基因青蒿植株。提取转基因青蒿植株第一片叶RNA,反转录为cDNA,进行qRT-PCR分析,其中基因表达量最高的5个转基因株系(BPF1-12、BPF1-22、BPF1-27、BPF1-44和BPF1-65)的结果如图6A所示,转基因植株中AaBPF1基因表达量显著高于野生型对照,最高为野生型的18.8倍。随后选择这5个转基因株系进行后续试验(图7A)。过量表达AaBPF1基因导致转基因植株中ADS和CYP71AV1表达量显著上调,而DBR2和ALDH1基因表达量也有所提高,可能是上游基因表达量提高使代谢流增加所致(图6B)。HPLC
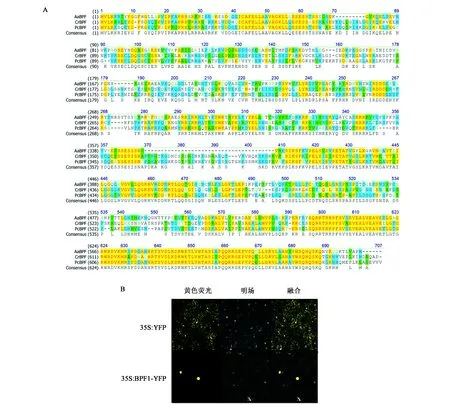
图4 AaBPF1的生物信息学分析以及亚细胞定位Fig.4 Bioinformatics analysis and subcellular localization of AaBPF1.注:A:AaBPF1蛋白和其他植物BPF蛋白的比对,比对的BPF蛋白分别为长春花(CrBPF;CAC19789.1)及欧芹(PcBPF;CAA48413.1),序列中高度保守的氨基酸用黄底表示,部分保守序列用蓝底表示;B:AaBPF1在烟草叶片中的亚细胞定位。
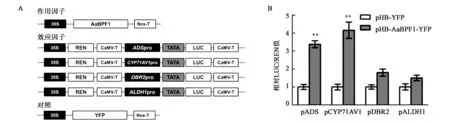
图5 AaBPF1调控青蒿素合成途径中关键酶基因的表达Fig.5 Expression of artemisinin biosynthetic genes regulated by AaBPF1.注:A:Dual-luciferase实验所使用载体系统;B:Dual-luciferase实验结果。**表示实验数据与对照组相比差异极显著(P<0.01)。
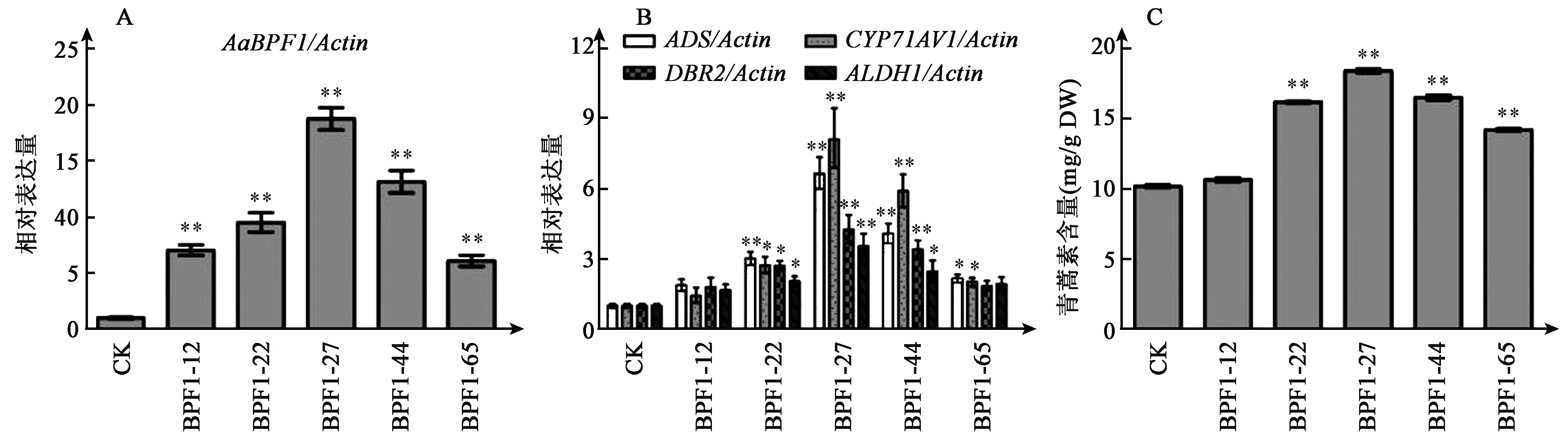
图6 过量表达AaBPF1转基因青蒿植株分析Fig.6 Analysis of transgenic Artemisia annua plants with overexpression of AaBPF1.注:A:AaBPF1的基因表达;B:青蒿素合成途径中关键酶基因的表达;C:转基因植株中青蒿素的含量。CK为野生型植物(非转基因植物),其余为转基因植株。*和**分别表示实验组数据与CK相比差异达到显著(P<0.05)和极显著水平(P<0.01)。

图7 转基因青蒿植株Fig.7 Transgenic Artemisia annua plants.注:A:AaBPF1过量表达转基因青蒿植株;B:AaBPF1 RNAi干扰转基因青蒿植株。
测定青蒿素结果如图6C所示,过量表达AaBPF1基因的青蒿中,青蒿素的含量最高约为18.4 mg/g (DW),而对照组野生型青蒿中青蒿素的含量约为10.21 mg/g (DW)。上述结果证明,AaBPF1可能通过激活青蒿素合成酶基因的表达来正调控青蒿素的合成。
2.6 RNAi干扰AaBPF1转基因青蒿植株分析
构建AaBPF1 RNAi干扰载体,通过农杆菌介导的遗传转化方法,共获得32棵AaBPF1 RNAi干扰转基因青蒿植株。经qRT-PCR分析,其中基因表达量最低的5个转基因株系(BPF1-RNAi-2、BPF1-RNAi-7、BPF1-RNAi-13、BPF1-RNAi-15和BPF1-RNAi-26)的结果如图8A所示,可知转基因青蒿中AaBPF1基因表达被显著抑制。选择这5个转基因株系进行后续研究(图7B)。抑制AaBPF1基因表达并未导致青蒿素合成酶基因(ADS、CYP71AV1、DBR2和ALDH1)表达全部降低,仅有AaBPF1基因抑制效果最好的转基因株系BPF1-RNAi-7的ADS、CYP71AV1和DBR2基因表达量显著降低(图8B)。转基因青蒿BPF1-RNAi-7的青蒿素含量显著低于野生型对照,其他转基因株系青蒿素含量略低于野生型或与野生型植株无显著差异(图8C)。这可能是由于青蒿素调控网络较为复杂,而AaBPF1很可能处于调控网络的上游;此外,MYB类转录因子的功能冗余较多。

图8 RNAi干扰AaBPF1转基因青蒿植株分析Fig.8 Analysis of transgenic Artemisia annua plants RNAi silencing AaBPF1.注:A:AaBPF1的基因表达;B:青蒿素合成途径中关键酶基因的表达 ;C:转基因植株中青蒿素的含量。CK为野生型植物(非转基因植物),其余为转基因植株。*和**分别表示实验组数据与CK相比差异达到显著(P<0.05)和极显著水平(P<0.01)。
3 讨论
光照除了可以通过光形态建成改变植物的形态结构,还能影响植物的次生代谢。一般情况下,较长波段的光(如红光),可以降低植物体内黄酮类物质的含量;短波段的光(如蓝光),有利于黄酮类物质的积累。如红光处理会导致烟叶(NicotianatabacumL.)中黄酮的含量降低[35, 36]。但也有研究表明,遮荫处理会让高山红景天(RhodiolasachalinensisA. Bor)根内积累的红景天苷数量变少,而红光处理下,高山红景天根内积累的红景天苷含量会升高[37]。此外,红光处理还可以显著增加番茄(Solanumlycopersicum)果实(着色期)中番茄红素的含量[38]、丹参(SalviamiltiorrhizaBunge)幼苗根系中丹酚酸B的含量[39]。在光调控植物次生代谢产物合成的研究中,MYB类转录因子备受关注。苹果中花青素必须在光的参与下才能合成,从苹果中克隆的MYB家族的MdMYB1、MdMYB10和MdMYBA均是受光诱导的转录因子,可调控花青苷合成关键基因的表达,在花青苷合成中发挥着重要作用[40,41]。将番茄置于强光下,番茄的R2R3MYB类转录因子SlAN1和SlAN2基因表达量显著提高,从而促进花青素合成中关键基因的表达,使花青素在番茄苗中的合成和积累[42]。
本研究利用单色光红光处理青蒿幼苗,并对测序所得的转录组数据进行差异基因分析和共表达分析,成功筛选到MYB类转录因子AaBPF1。Dual-luciferase系统检测以及转基因植株的目的基因表达、青蒿素含量分析的结果显示,AaBPF1很可能是通过调节ADS和CYP71AV1基因的表达来实现对青蒿素合成的调控。通过已报道的对ADS和CYP71AV1启动子序列的分析,发现这2个基因的启动子区均具有MYB结合的顺式作用元件[43,44]。因此,AaBPF1有可能是直接结合ADS和CYP71AV1启动子调控其基因表达水平,从而调控青蒿素的合成;除此之外,AaBPF1也可能与其他转录因子(如bHLH类转录因子)通过蛋白相互作用,间接实现对ADS和CYP71AV1基因表达的调控。然而,AaBPF1的RNAi株系对青蒿素合成的影响并不明显,这可能是由于青蒿素合成途径调控网络较为复杂且MYB类转录因子的功能冗余较多,因此造成AaBPF1的RNAi株系青蒿素含量变化不明显。
MYB类转录因子的研究主要都集中在R2R3MYB,而R3MYB的功能研究相对较少。在已报道的R3MYB亚家族中,几乎都是负调控因子[45],因此,本研究发现的AaBPF1正调控次生代谢产物合成具有重要的意义,不仅是对红光调控青蒿素合成机制的初步探索,也为青蒿素植物代谢工程提供了良好的候选基因。
——青蒿素

