黄芩苷的抗肿瘤作用及机制研究进展
王婷婷, 赵鹏翔, 谢 飞
北京工业大学生命科学与生物工程学院, 北京氢分子研究中心, 北京 100124
黄芩在我国药用历史悠久,产量大且用途广泛,其中主要的有效成分为以下4种:黄芩苷、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)。在我国现行药典当中,是以黄芩苷含量的高低来作为评价黄芩质量的标准。黄芩苷属于黄酮类化合物(图1),黄酮类化合物的抗氧化作用已被人们所熟知。此外,黄芩苷口服后需经过肠道中的酶水解在体内代谢为黄芩素来发挥药效,故通常二者在一起进行研究。以往对于黄芩苷的认识只局限于清热解毒、降压、抗病毒等方面的作用,随着近年来国内外对其研究的深入,发现黄芩苷还具有抗肿瘤等方面的作用[1],通过大量的实验结果表明,黄芩苷会以时间、浓度依赖的方式对胃癌、乳腺癌、卵巢癌等多种肿瘤细胞起到明显的抑制效果。本文将针对近年来黄芩苷的抗肿瘤作用进行总结,以期为黄芩苷在肿瘤治疗中的应用研究提供参考。
1 黄芩苷对肿瘤细胞的直接作用
当今多数直接与肿瘤细胞发生作用的抗肿瘤药物主要是以下几种方式:通过影响细胞周期来抑制肿瘤细胞的增殖;诱导肿瘤细胞凋亡相关的基因或蛋白发生改变以促进其凋亡;抑制肿瘤细胞的转移能力。大量的实验结果表明,黄芩苷可对肿瘤细胞造成多方面的综合影响。
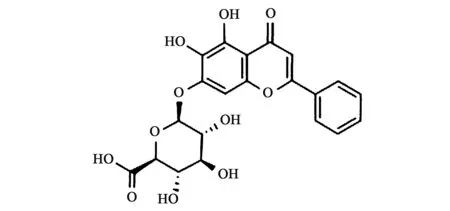
图1 黄芩苷结构简式Fig.1 Simplified structure of baicalin.
1.1 通过细胞周期阻滞抑制肿瘤细胞增殖
细胞周期是一个从遗传物质准备到细胞分裂都受到严密管理的进程,从上一次细胞分裂结束开始到下一次细胞分裂结束被称为一个细胞周期,分为G0/G1、S、G2、M四个时期,其中含有多个检查点以确保遗传物质的完整复制和在分裂过程中被精确分配到两个子细胞当中。细胞周期的调控由细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(CDKs)、细胞周期蛋白依赖性激酶抑制剂(CKIs)三者共同协调完成。Cyclin分为多种类型,其中CyclinD作用于G1期,是启动整个细胞周期循环的关键,可推动细胞周期进入S期(图2)。Cyclin含有一段共同的保守氨基酸序列,通常与CDK结合形成Cyclin-CDK复合体发挥调控作用。异常的细胞周期活动是肿瘤细胞的特点之一,在绝大多数肿瘤细胞中许多Cyclin存在着异常激活的情况,特别是D型Cyclin和E型Cyclin,同样CDKs也存在异常激活[2]。在转基因小鼠中,过表达Cyclin后会诱导肿瘤发生。而CKIs是细胞周期的负调控因子,具有抗肿瘤的特性,包括CIP/KIP家族,例如:p21CIP1、p27KIP1、p57KIP2等,可抑制CDK1、CDK2的活性;INK4蛋白家族,例如:p16INK4A、p15INK4B、p18INK4C等,可与CDK4、CDK6结合并抑制其活性[3]。Cyclin、CDKs、CKIs这三者均可作为癌症治疗中的潜在靶点,对不受控的细胞周期进行调节,以抑制肿瘤细胞的过度增殖。
在肺癌的研究中,黄芩苷对人肺癌A549、SK-LU-1、SK-MES-1三种细胞具有选择毒性,并且对正常人肺纤维母细胞无明显影响,其中,黄芩苷可使A549细胞中的CyclinA表达量下降,将细胞周期阻滞在S期,而在SK-LU-1、SK-MES-1中则会使CyclinD1表达量下降,将细胞周期阻滞在G1期[4]。此外,还有报道称黄芩素对于膀胱癌TSGH8301、BFTC905两种细胞可通过抑制CDC2-CyclinB1复合物的活性来抑制膀胱癌细胞增殖[5]。CDC2,属于CDKs,是细胞周期调控中的关键蛋白, Wall 等[6]在乳腺癌细胞MCF-7和宫颈癌细胞HeLa中发现,CDC2可抑制凋亡抑制蛋白的磷酸化作用,以促进肿瘤细胞凋亡。此外,在黄芩苷对细胞周期的调控中有多条信号通路参与其中,例如PI3K/AKT、JAK-STAT等。黄芩苷对人胃癌SGC-7901细胞具有抑制作用,可上调ptenmRNA水平以及蛋白表达[7],其中发挥抑制作用的潜在机制可能与PI3K/AKT信号途径有关。pten是一种肿瘤抑制基因,PTEN蛋白非常特殊,同时具有脂质磷酸酶、蛋白磷酸酶两种活性,可以上调细胞周期依赖蛋白激酶抑制蛋白p27,降低PI3K的水平并抑制其下游Akt的活性[8],PI3K/AKT信号途径在多种癌症中存在着过度激活的现象,会导致细胞周期失控与细胞凋亡抑制。同时有实验证据表明黄芩素可抑制PI3K的活性[9],并使食管鳞状肿瘤细胞中p-Akt的表达量减少[10]。此外,董明等[11]发现,黄芩苷可能是通过下调CyclinD1与上调凋亡相关蛋白的表达量,来起到对人肝癌细胞SMMC-7721裸鼠皮下移植瘤的生长抑制作用。同时在SMMC-7721体外实验当中,黄芩苷对于STAT3的磷酸化具有抑制作用并可下调其表达量,可能是通过JAK-STAT这条信号通路对SMMC-7721细胞起到抑制效果[12]。JAK-STAT信号途径具有促进细胞进入细胞周期、抑制细胞凋亡等作用。STAT家族是信号激活与转导过程中的关键因子,在细胞生长增殖、凋亡中起着关键作用,可促使带有酪氨酸的蛋白发生磷酸化,引发一系列的级联反应[13]。其中STAT3与肿瘤细胞密切相关,在乳腺癌、卵巢癌、前列腺癌中均发现STAT3存在异常激活的情况,可对CyclinD1/D2、Bcl2、VEGF进行异常调节,是肿瘤细胞恶性进程当中的驱动器[14]。
1.2 诱导肿瘤细胞凋亡
研究表明,细胞凋亡主要分为两大途径:外在途径(死亡受体途径)和内在途径(线粒体途径)。细胞凋亡的机制是高度复杂的,涉及诸多分子的级联反应。死亡受体途径主要由细胞表面的死亡受体Fas、肿瘤坏死因子受体TNFR等所介导,当死亡配体与之结合后,引起细胞凋亡。通过线粒体途径发生的凋亡则会导致线粒体膜电位发生改变,与凋亡相关的因子或蛋白释放,例如细胞色素c(Cytochrome c)等,从而引发半胱氨酸蛋白酶(Caspase)家族发生一系列级联反应。Caspase家族是执行绝大多数细胞凋亡的最终途径,其中Caspase-3位于关键地位。两大凋亡途径不是相互独立的,可相互关联,均可由Caspase-3来执行凋亡,Caspase-3经剪切活化后会导致DNA片段断裂和蛋白质降解等,形成凋亡小体后被吞噬细胞吞噬[15,16]。此外,在细胞凋亡中还存在内质网介导的凋亡途径,内质网可参与调节细胞内的Ca2+的动态平衡,当内质网发生应激,Ca2+平衡被破坏时可激活位于其上的Caspase-12,Caspase-12可引发细胞凋亡或进一步激活Caspase-3发挥凋亡作用(图3)[16]。
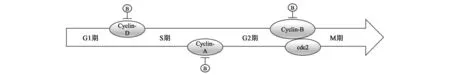
图2 黄芩苷在细胞周期调控中的作用位点Fig.2 The acting sites of baicalin in cell cycle regulation.注:B:Baicalin
在T型急性淋巴白血病CCRF-CEM细胞中,黄芩苷除可使DNA断裂、细胞周期发生阻滞外,还可下调抗凋亡蛋白Bcl-2的表达,促进线粒体释放细胞色素c,同时线粒体膜电位发生改变,表明在黄芩苷促进CCRF-CEM发生细胞凋亡过程中有线粒体途径参与其中[17]。在白血病HL-60细胞中,黄芩苷同样可以下调Bcl-2的表达量并改变线粒体膜电位,另外还会提高细胞中的Ca2+水平[18]。Ca2+稳态被破坏后则会导致内质网应激,在实验后续研究中发现,黄芩苷还可上调Caspase-3、Gadd153的表达水平,在正常细胞中Gadd153通常水平较低,但在应激条件下会呈现高表达的情况,可作为检测内质网应激水平的标志物。此外,细胞凋亡的死亡受体途径也同样参与到黄芩苷对肿瘤细胞的抑制作用中,Chen等[19]研究表明,黄芩苷处理胃癌MGC-803、BGC-823之后,相关的凋亡诱导配体(TRAIL)与FASL、凋亡执行蛋白Caspase-3与Caspase-8的mRNA及蛋白的表达水平均会上调。除此之外,黄芩苷还可下调骨肉瘤MG-63细胞中Survivin的表达量并抑制新血管形成从而促进其凋亡,Survivin作为凋亡抑制蛋白(IAP家族)中的一员,同样也是目前癌症治疗研究中较为火热的作用靶点,可直接抑制Caspase-3、Caspase-7发挥其凋亡作用[20]。
1.3 抑制肿瘤细胞的侵袭与迁移
肿瘤细胞的侵袭与转移是其恶性进程当中重要的一步,首先要对肿瘤细胞周围的细胞外基质进行降解,此过程中基质金属蛋白酶家族(mitochondrial membrane potential,MMPs)发挥着重要作用,同时MMPs还具有抑制肿瘤新血管形成与调节细胞黏附性等多种作用[21],其中MMP-2和MMP-9两个亚型尤为关键(表1)。张悦等[30]发现,在宫颈癌HeLa细胞中,黄芩苷通过p38-MAPK信号通路下调MMP-2、MMP-9的表达量来抑制其侵袭,在一定程度内呈现浓度依赖效应。有丝分裂原活性蛋白激酶(mitogen activated prote in kinase,MAPKs)属于一大类保守蛋白家族,位于细胞质基质,活化后可以使一系列核蛋白磷酸化或进入细胞核内激活特定靶基因, p38-MAPK信号通路主要影响细胞增殖和迁移等方面,在膀胱癌细胞HTB9、HTB5中,发现p38-MAPK信号通路下游因子MAPK活化蛋白激酶2(MAPKAPK2)可以影响MMP-2、MMP-9的表达来调节细胞迁移[31]。
另外,有实验研究发现黄芩苷使人卵巢癌SKOV3细胞中p-ERK、波形蛋白(Vimentin)的表达量下降,对细胞侵袭的抑制作用的潜在机制可能是以下2种:影响MAPK-ERK信号通路与上皮间充质转化(EMT)[32]。细胞外信号调节激酶(external signal regulated kinase,ERK)同样属于MAPK蛋白家族分为两种亚型ERK-1与ERK-2,在细胞调控中起着关键作用,通过Ras-Raf-MEK-ERK(简称ERK通路)发挥作用。Ras,一种GTP结合蛋白位于细胞膜内侧,当受到胞外信号刺激后,可使Raf、MEK、ERK产生磷酸化的级联反应来发挥调节作用,ERK信号通路与人类恶性肿瘤密切相关,在卵巢癌、胃癌等细胞中普遍存在ERK持续激活的现象[33],孔卫平等[34]研究发现在正常子宫内膜组织中ERK-1、p-ERK-1阳性率约为12.5%、18.75%,而在子宫内膜癌组织中的阳性率分别高达78.33%、68.33%。同时,有大量实验表明,阻断ERK途径可起到抑制肿瘤细胞迁移和侵袭的作用,地塞米松、巨噬细胞移动抑制因子(migratory inhibitorg factor,MIF)对胶质瘤U373-MG细胞迁移和侵袭的影响均是通过抑制或激活ERK途径来实现的[35]。前文提到黄芩苷对人卵巢癌SKOV3细胞迁移、侵袭的抑制还可能影响了EMT过程,该过程多见于肿瘤细胞或处于特定生理情况下的细胞中,对于上皮源肿瘤细胞的转移、浸润等过程至关重要。2种主要原因可导致肿瘤细胞中出现EMT,例如:受到炎性细胞因子刺激和缺氧条件下的活性氧造成的损伤[36]。EMT过程中牵涉的信号通路包括:TGF-β、Wnt、Notch等,可破坏细胞间的黏附、使细胞失去极性、重塑细胞骨架等[37],使上皮细胞向间质细胞进行转化,从而实现肿瘤细胞的转移与浸润,并且EMT可促使MMPs高表达。Chung等[38]在实验中同样发现,黄芩苷可抑制乳腺癌细胞的EMT过程。另外,Wang等[39]实验发现,黄芩苷通过下调EMT过程中的多个间质细胞标志物的表达量来抑制骨肉瘤细胞的侵袭。其中,波形蛋白作为EMT过程中间质细胞的标志物被广泛研究,其中绝大多数与肿瘤细胞的迁移与侵袭有关。Vimentin可改变细胞形状、增加细胞运动活力,并在多种癌症中高表达[40],高转移潜能的肿瘤细胞中Vimentin会呈现高表达,当药物使Vimentin表达量下降之后,均可不同程度地抑制迁移与侵袭。
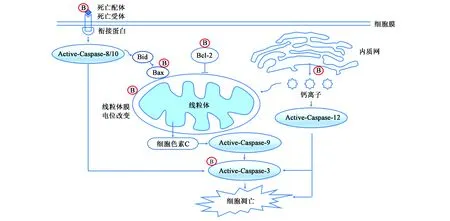
图3 黄芩苷在肿瘤细胞凋亡中的作用位点Fig.3 The acting sites of baicalin in tumor cell apoptosis.注:B:Baicalin
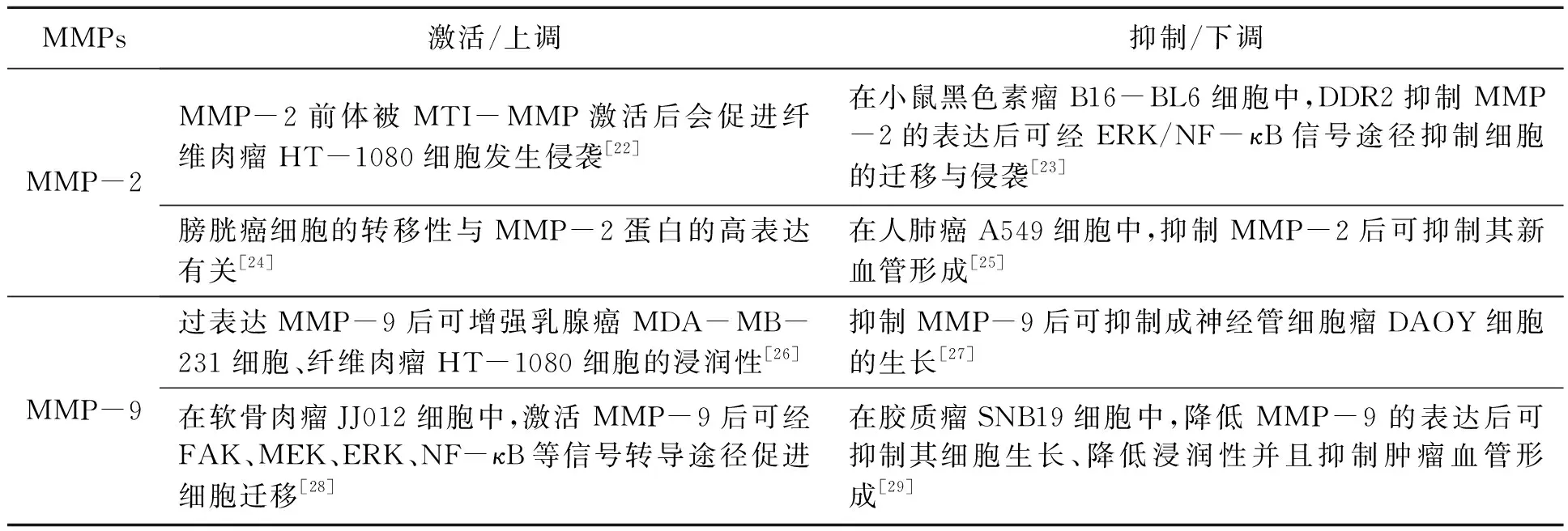
MMPs激活/上调抑制/下调MMP-2MMP-2前体被MTI-MMP激活后会促进纤维肉瘤HT-1080细胞发生侵袭[22]在小鼠黑色素瘤B16-BL6细胞中,DDR2抑制MMP-2的表达后可经ERK/NF-κB信号途径抑制细胞的迁移与侵袭 [23]膀胱癌细胞的转移性与MMP-2蛋白的高表达有关[24]在人肺癌A549细胞中,抑制MMP-2后可抑制其新血管形成[25]MMP-9过表达MMP-9后可增强乳腺癌MDA-MB-231细胞、纤维肉瘤HT-1080细胞的浸润性[26]抑制MMP-9后可抑制成神经管细胞瘤DAOY细胞的生长[27]在软骨肉瘤JJ012细胞中,激活MMP-9后可经FAK、MEK、ERK、NF-κB等信号转导途径促进细胞迁移 [28]在胶质瘤SNB19细胞中,降低MMP-9的表达后可抑制其细胞生长、降低浸润性并且抑制肿瘤血管形成[29]
2 黄芩苷对肿瘤细胞的间接作用
在众多的抗肿瘤药物中,除前文介绍的能够直接与肿瘤细胞发生作用的药物外,还有些可间接地起到抑制肿瘤细胞的作用。已有大量的文献报道,当机体内氧化应激水平持续升高或处于长期慢性炎症中,会大大增加癌症发生的机率或促进肿瘤细胞的生成与转移。
2.1 黄芩苷的抗氧化作用
正常情况下,人体内氧化与抗氧化是一个相对平衡的状态,当这种平衡被破坏后会导致大量问题,例如:DNA损伤、促进细胞内发生脂质过氧化反应导致细胞膜渗透性与流动性的改变等[41]。另外,从遗传学、能量代谢等方面的研究来看,肿瘤患者处于一个低抗氧化状态,并且体内会存在活性氧(reactive oxygen species,ROS)的堆积,其中包括超氧阴离子(O2-)、羟自由基(·OH)等,另外ROS还参与肿瘤细胞的生成与转移[42]。目前,很多抗肿瘤药物是通过改变人体内氧化应激水平来起到对肿瘤细胞的抑制作用的。
从中草药中提取出的黄酮类化合物被研究证明是一种非常有效的抗氧化剂,与其分子结构中的酚羟基密切相关[43],黄芩苷中含有2个酚羟基,因此具有较强的抗氧化作用。大脑组织易受到氧化应激损伤,因为神经元存在丰富的多不饱和脂肪酸,并且内源性抗氧化酶不足[41],ROS对神经元细胞损伤极大。Gao等[44]通过电子自旋共振ESR实验发现,黄芩苷和黄芩素可以以浓度依赖的方式清除羟自由基(·OH),并且10 μmol/L的黄芩苷可依靠其羟基基团来缓解大鼠大脑皮层的氧化应激损伤,效果比已知的抗氧化剂槲皮黄酮更强。谭廷华等[45]还采用荧光法检测了黄芩甙,发现其对芬顿(Fenton)反应(Fe2++H2O2→Fe3++OH+·OH)所产生的羟自由基(·OH)有着非常强的清除作用,EC50=39 μmol/L,清除效果比其特异性清除剂甘露醇更加显著。Fenton反应是由法国科学家Fenton发现的,因该反应可产生具有强氧化性的·OH,常被用来降解污染,但在生物学中可用来研究细胞氧化应激的机理与修复。Cao等[46]的研究结果表明黄芩苷通过抗氧化以及抗凋亡两种方式减弱缺血再灌注后对神经元细胞造成的损伤,损伤的主要原因之一是重新得到血液灌注后短时间内产生大量氧自由基O2-、·OH等。进一步对海马组织检测发现,其作用的机理是:黄芩苷可降低脂质过氧化反应的终产物——丙二醛(MDA)的含量,从而可间接反映出自由基含量的多少。提高超氧化物歧化酶(SOD)、谷胱甘肽(GSH)等活性来清除氧自由基,保护机体免受自由基损伤,同时促进脑源性神经营养因子(BDNF)的表达,并且抑制细胞凋亡蛋白(Caspase-3)的表达。在大鼠神经细胞PC-12中同样发现,黄芩苷可增强SOD活性,降低细胞中MDA含量,并且通过抗细胞凋亡的方式来减轻H2O2带来的氧化损伤[47]。
2.2 黄芩苷的抗炎作用
当人体受到外界环境刺激时,免疫系统易遭到破坏,存在一定机率引发机体内产生炎性反应,如果炎性不能被及时清除,更多的炎性细胞会转移至病灶形成正反馈的恶性循环,对机体造成损伤,严重时会造成DNA损伤、基因组不稳定等问题。因此炎症与癌症的关系密切,有调查显示慢性炎症与1/4以上的癌症发生相关[48]。另外,从细胞所处的微环境来看,肿瘤细胞和炎性细胞的微环境之间可相互作用,肿瘤细胞可通过炎性细胞获取营养因子以促进其生长。炎性微环境中的炎性细胞因子、组胺等可增强血管壁、淋巴管壁的通透性,使肿瘤细胞更容易穿过血管壁进入血液循环或淋巴循环,进而促进肿瘤细胞转移。同时,炎性细胞还可以释放出大量的活性氧[49,50],在本文中已提到活性氧与肿瘤细胞的发生、转移同样密切相关。因此炎症与肿瘤细胞的关系为癌症治疗研究提供了新的思路。消除炎性反应可从以下三方面入手:抑制炎性反应相关酶的酶活性;抑制炎性相关基因的表达;抑制多种炎性因子的产生与释放。其中NF-κB是参与调控炎性反应的关键因子(图4)。NF-κB包括两大家族,这两个家族多以二聚体形式结合(p50/p65),形成具有生理活性的NF-κB,通常NF-κB在细胞质中与IκB(NF-κB抑制蛋白)形成复合物处于静息状态,磷酸化后与IκB脱离进入细胞核,促进炎性因子TNF、IL-6等靶基因转录,引发炎症反应[51]。同时越来越多的实验证据表明,NF-κB在肿瘤细胞的生成过程中同样具有一定的作用,NF-κB信号通路可参与调控细胞周期、抑制凋亡等[52],NF-κB相当于炎性反应与癌症之间的桥梁。另外,转录因子STAT3也同时参与了炎性反应与癌症的调控。STAT3信号通路主要靠IL-6家族、IL-10家族以及一些酪氨酸激酶等激活,激活后可进一步诱导表达炎性因子,加剧炎性反应[50],STAT3与NF-κB还可发生相互作用[53],而在被Janus家族激酶(JAK)激活后,JAK-STAT3信号通路对肿瘤细胞周期的调控在前文中已阐述。
在乳腺炎动物模型中,黄芩苷可降低炎性因子IL-6、TNF-α的含量,同时下调NF-κB、p38的mRNA表达水平并降低其磷酸化水平,通过抑制NF-κB信号通路和MAPK-p38信号通路来发挥抗炎作用,后者同样是炎性反应中重要的调控途径[51,54]。同时还有报道发现,黄芩可通过影响STAT3通路来减少炎性因子的含量[55]。2000年Li等[56]首次提出,黄芩苷可与部分趋化因子结合来发挥抗炎作用,趋化因子是一些低分子量的小蛋白质,可导致白细胞定向迁移至炎性病灶。在人白细胞中黄芩苷可抑制趋化因子与其特异性受体结合,进一步检测发现黄芩苷与趋化因子并不是竞争受体,而是直接与趋化因子结合,这种结合是具有选择性的,IL-8、MIP-1β、MCP-2等均可被黄芩苷结合,但是与CX3C发生相互作用。将黄芩苷与IL-8共同注射入大鼠体内,由IL-8引起的中性粒细胞浸润(炎性反应特征之一)明显地受到抑制。除此之外, Luo等[57]通过实验发现,加入黄芩苷后可通过负调控TLR信号途径来缓解炎性反应。TLR信号通路可被脂多糖(lipopolysaccharide,LPS)为革兰氏阴性菌细胞壁外侧的一类物质激活,不仅可以引起多种细胞一系列的由内毒素诱导的炎性反应,还可以引起非细菌性的炎性反应,Toll样受体(TLR)属于跨膜蛋白,可识别多种细胞内、外源性配体,通过级联活化反应参与多种细胞调控[58]。Feng等[59]的研究结果还表明,黄芩苷可以通过下调TLR4(LPS的作用靶点)的表达来抑制炎性反应。
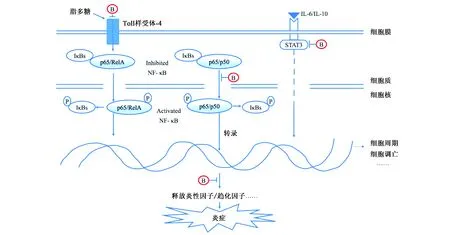
图4 黄芩苷在炎性反应调控中的作用位点Fig.4 The acting sites of baicalin in the regulation of inflammatory response.注:B:Baicalin; P:磷酸化
3 展望
黄芩在传统中医中药用历史久远,黄芩苷作为黄芩中最主要的有效成分之一,过去认为其主要作用是清热解毒、泻火等。随着国内外对黄芩苷的研究及其发挥药效的潜在分子机制的了解逐步深入,研究者们认识到黄芩苷的药效十分广泛。近年来,大量的文献报道称黄芩苷可从诸多方面对肿瘤细胞具有明显的抑制作用,并且对正常细胞无明显毒副作用,为未来的癌症治疗提供了新的思路。但是,目前绝大多数黄芩苷对于肿瘤细胞的研究局限于细胞或动物实验,对于其中的分子机制尚不完全清楚,同时在临床研究上还有待进一步探究,评价其临床应用的价值及可能性。

