DMSO 联合神经营养因子BDNF 诱导BMSCs 向神经样细胞分化
倪爽 苗泽远 王家昕 王晓霞 李洁 王子钰 魏会平 董明纲 苏立宁
1.河北北方学院基础医学院麻醉专业,张家口,075000,中国
2.河北北方学院基础医学院临床专业,张家口,075000,中国
3.河北北方学院基础医学院口腔专业,张家口,075000,中国
4.河北北方学院基础医学院生物教研室,张家口,075000,中国
5.河北北方学院学报编辑部,张家口,075000,中国
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)来源于骨髓组织,是治疗神经损伤、神经系统退行性等疾病的种子细胞,具有取材容易、可分化为神经细胞等特点。神经营养因子在神经元的发育、死亡、修复、轴突再生、突触可塑性和神经递质等神经系统活动中发挥重要作用。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对神经元起保护、促进再生等作用。BDNF 能维持中脑多巴胺能神经元、基底前脑胆碱能神经元的存活、分化及功能表达,对神经元损伤修复与再生起重要作用[1]。在脊髓运动神经元中也有一定的分布,并在神经损伤后保护运动神经元存活及在运动神经元纤维的再生中发挥作用。有研究证实BDNF 刺激BMSCs 向神经细胞分化,而用BDNF 等生长因子诱导的效率较低,同时伴随神经元样细胞有很多神经胶质细胞产生缺陷[2]。本团队在以往的实验中已证实 BDNF 在诱导BMSCs 向神经样细胞分化的过程中效果显著,且表现出诱导率低的缺点。
目前很多研究已经证实二甲基亚砜(dimethyl sulfoxide,DMSO)等抗氧化剂具有诱导效率高,诱导中少有神经胶质细胞产生的优点[3],但经其处理的细胞存活时间短(约5 h)。而复合培养基可集中多种诱导剂的优点,减少不利因素的干扰。
随着神经科学的发展,已经证实microRNA(miRNA)在整个神经系统的发育过程中发挥着重要的作用,不仅在胚胎期能够调控神经元产生/胶质细胞产生/神经元的迁移等生理过程,还能在成年体内控制神经元受损后的再生,在神经功能丧失和恢复过程中发挥关键性调控作用[4-8]。miRNA-26a 是众多miRNA中的一种,脊椎动物特异性的miRNA,最早在小鼠妊娠12 d 开始显著增加。在平滑肌分化和神经元产生过程中miRNA-26a 的含量明显上调[9]。
鉴于以上基础,本实验研究BDNF 联合 DMSO诱导BMSCs 向神经样细胞分化的效果,并初步研究miRNA-26a 在神经分化中的调控。
1 材料和方法
1.1 材料
1.1.1 实验动物
健康SD 大鼠 4只,4周龄,体质量(90±20)g,由河北北方学院实验动物中心提供。
1.1.2 试剂
DMEM,购自GIBCO 公司;BDNF,购自GenScript公司;RNA 提取试剂盒,购自TaKaRa 公司;兔抗神经元特异性烯醇化酶,购自北京博奥森生物技术有限公司。
1.1.3 仪器
安全工作柜,CO2细胞培养箱,流式细胞仪,Eclipse 90i倒置荧光显微镜,低温离心机,凝胶成像系统等。
1.2 实验方法
1.2.1 BMSCs 的获取及纯度检测
无菌条件下,从大鼠股骨骨髓腔中获取BMSCs,培养于含 1%双抗(青霉素、链霉素)+10%胎牛血清(fetal bovine serum,FBS)的DMEM 培养液中。待细胞密度达80%时,利用0.25%的胰酶消化进行传代。细胞培养中,使用倒置显微镜观察生长情况。传代至第3 代,利用流式细胞仪检测 BMSCs 表面标志物:CD29,CD34,CD45,CD90,以评价其纯度。
1.2.2 BDNF/DMSO 联合诱导BMSCs 的分化
将传至第3 代的BMSCs,以4×105个细胞每mL密度制备细胞爬片,待细胞贴壁生长,将细胞分为四组:BDNF 联合DMSO组、BDNF组、DMSO组和无处理组。BDNF 联合DMSO组加入3% DMSO、DMEM/F12预诱导液预诱导2 h,更换诱导液:100 ng·mL-1BDNF、DMEM/F12,诱导 48 h。BDNF组加入含有100 ng·mL-1BDNF 的DMEM/F12 培养液,培养50 h 后备用。DMSO组加入含有3% DMSO 的DMEM/F12 培养液。无处理组只加入DMEM/F12 培养液,培养50 h 后备用。
1.2.3 BMSCs 神经分化的鉴定
1.2.3.1 形态鉴定 采用倒置显微镜(Eclipse 90i,Nikon)观察各组的细胞形态变化。
1.2.3.2 免疫组化检测各组神经元特异性烯醇酶(neuron specific enolase,NSE)蛋白的表达 待 BMSCs细胞爬片生长至60%左右时,分四组分别进行处理:①BDNF 联 合DMSO组:加 入3% DMSO、DMEM/F12 预诱导液预诱导2 h,更换诱导液:100 ng·mL-1BDNF、DMEM/F12,诱导48 h。②BDNF组:加入含有100 ng·mL-1BDNF 的DMEM/F12 培养液,培养50 h后备用。③DMSO组:加入含有3% DMSO 的DMEM/F12 培养液,处理5 h 后备用。④无处理组:只加入DMEM/F12 培养液,培养50 h 后备用。后续取出细胞爬片,进行免疫组化的检测:PBS 洗1次,冷丙酮固定10 min,PBS 洗3次,每次3 min;将盖玻片浸入3%H2O2中,室温孵育20 min,PBS 洗3次,每次3 min;用试剂A(正常山羊血清)封闭20 min,吸弃,不予漂洗;分别滴加稀释后的NSE 抗体(1∶200 稀释度)置入湿盒中4℃过夜,PBS 漂洗3次,每次3 min;加入试剂B(生物素标记的二抗),37℃ 孵育15~20 min,PBS 漂洗3次,每次3 min;滴入试剂C,室温或37℃孵育15~20 min,PBS漂洗3次,每次3 min;DAB 溶液显色10 min,自来水冲洗终止反应,中性树胶封片。
1.2.4 实时荧光定量 PCR 检测 miRNA-26a、PTEN、mTOR 的表达变化
选择BDNF 联合DMSO组和无处理组分别诱导16 h、32 h 和48 h 的样品,提取总RNA,反转录合成cDNA。设计各基因引物,利用实时荧光定量PCR 检测PTEN、mTOR 和miRNA-26a 的表达量(每个基因重复三次),比较神经分化前后的变化。以上各基因引物见Tab.1。
2 结果
2.1 诱导前后大鼠 BMSCs 细胞的形态变化
传至3 代的细胞密度均匀,以长梭形为主,流式细胞仪检测显示标记物CD29 和CD90 阳性率分别高达99.8%,88.6%;CD34,CD45阳性率分别为1.8%,23.3%,符合BMSCs 的指标特征。各组诱导后,密切关注其形态学变化。BDNF组诱导2 h 后细胞形态基本无变化,诱导50 h 后出现少量神经样细胞;DMSO组诱导2 h 后出现大量神经样细胞,但诱导50 h 后细胞大量死亡;无处理组不加任何诱导剂,细胞形态没发生变化;BDNF 联合DMSO组DMSO 预诱导后,加BDNF诱导2 h 后出现神经样细胞,细胞突起明显,诱导50 h后神经样细胞量明显增多,部分细胞间形成网络样连接(Fig.1)。
2.2 免疫细胞组化对BMSCs 分化的鉴定
免疫细胞化学方法鉴定结果显示,已分化的BMSCs 中NSE 呈阳性表达(Fig.2)。
2.3 实时荧光定量PCR 对诱导前后miRNA-26a、PTEN、mTOR 表达量的检测
实时荧光定量PCR 鉴定结果显示,与未处理组比较,诱导不同时间后,miRNA-26a 表达量和mTOR 基因的表达量升高、而PTEN 表达量降低,且差异具有显著性(P<0.05)(Fig.3)。
3 讨论
目前国内外对BMSCs 分化和神经系统修复的研究主要集中在BMSCs 体外诱导和体内移植实验和研究,关于BMSCs 向神经元样细胞诱导分化已取得了不少成果。2000 年由 Sanchez-Ramos[10]和 Woodbury[3]开始尝试体外诱导 BMSCs 向神经细胞分化。β-巯基乙醇、DMSO 和丁基羟基茴香醚联合,或表皮生长因子EGF、维甲酸和 BDNF 联合诱导,均成功让 BMSCs 分化为神经元样细胞。随后国内外学者为寻找诱导BMSCs 分化为神经样细胞的方法开展了大量的研究,包括细胞因子、生长因子等的研究。
细胞增殖和分化受各种细胞因子的影响,其中以神经营养因子的作用尤为关键。神经营养因子在神经发育和神经损伤中调节神经元活性和修复。BDNF 是一种重要的脑源性神经营养因子,与其受体酷氨酸激酶受体B 结合后启动细胞内信号转导途径,产生相应分子对神经元起保护、促进再生作用[11]。同对照组比较,在神经诱导培养基内添加BDNF 诱导BMSCs 向神经分化,分化的神经元样细胞数量明显增多,说明BDNF 可诱导BMSCs 向神经细胞分化[2],但分化效率较低。
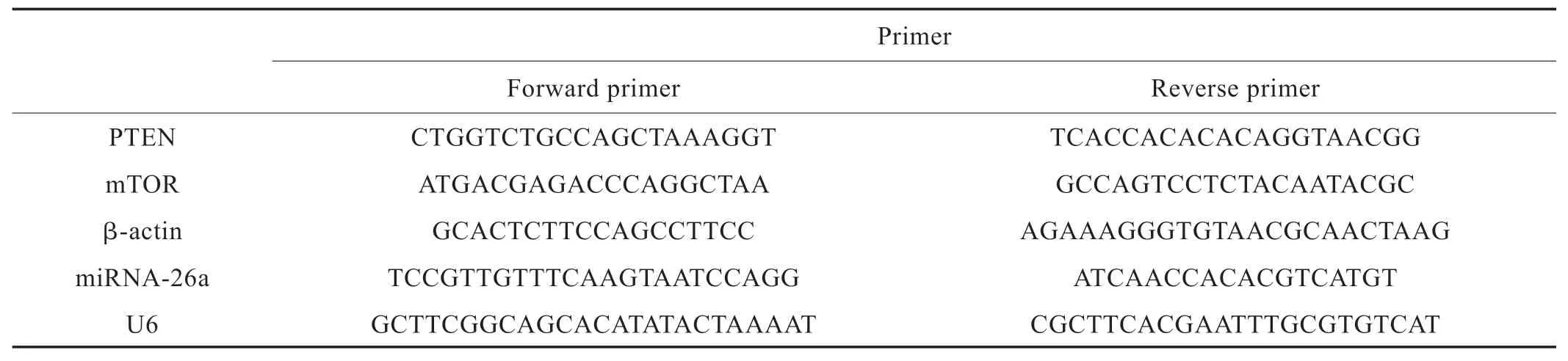
Tab.1 Primer of each gene

Fig.1 Morphological change of BMSCs after being induced(×100)
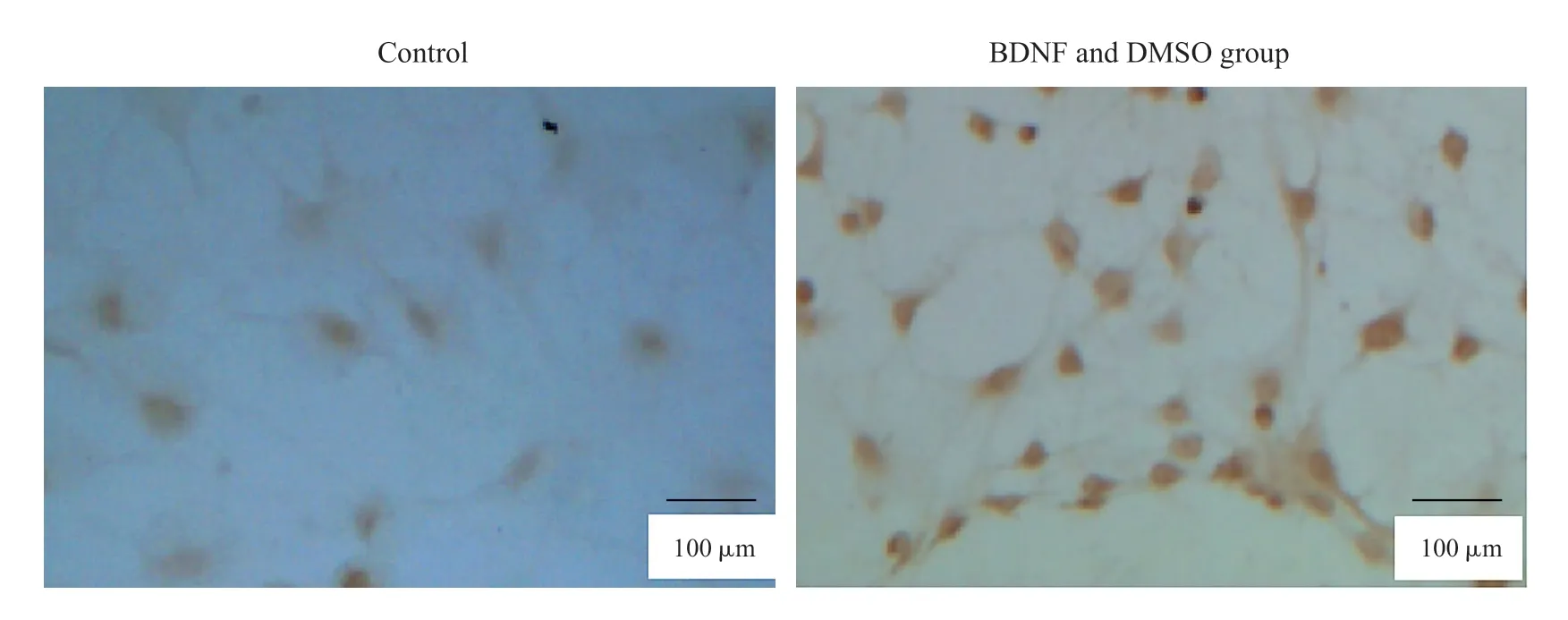
Fig.2 The expression of NSE protein after being induced(×100)
研究证实DMSO 或BDNF 对 BMSCs 诱导生成神经元样细胞有一定的促进作用,但存在一定的局限性,如诱导效率低、诱导剂对细胞存在毒性等。因此,本团队首次开展了BDNF 联合DMSO 诱导BMSCs 向神经样细胞分化的研究,得到了在形态和神经元标志物都呈阳性的神经元样细胞。
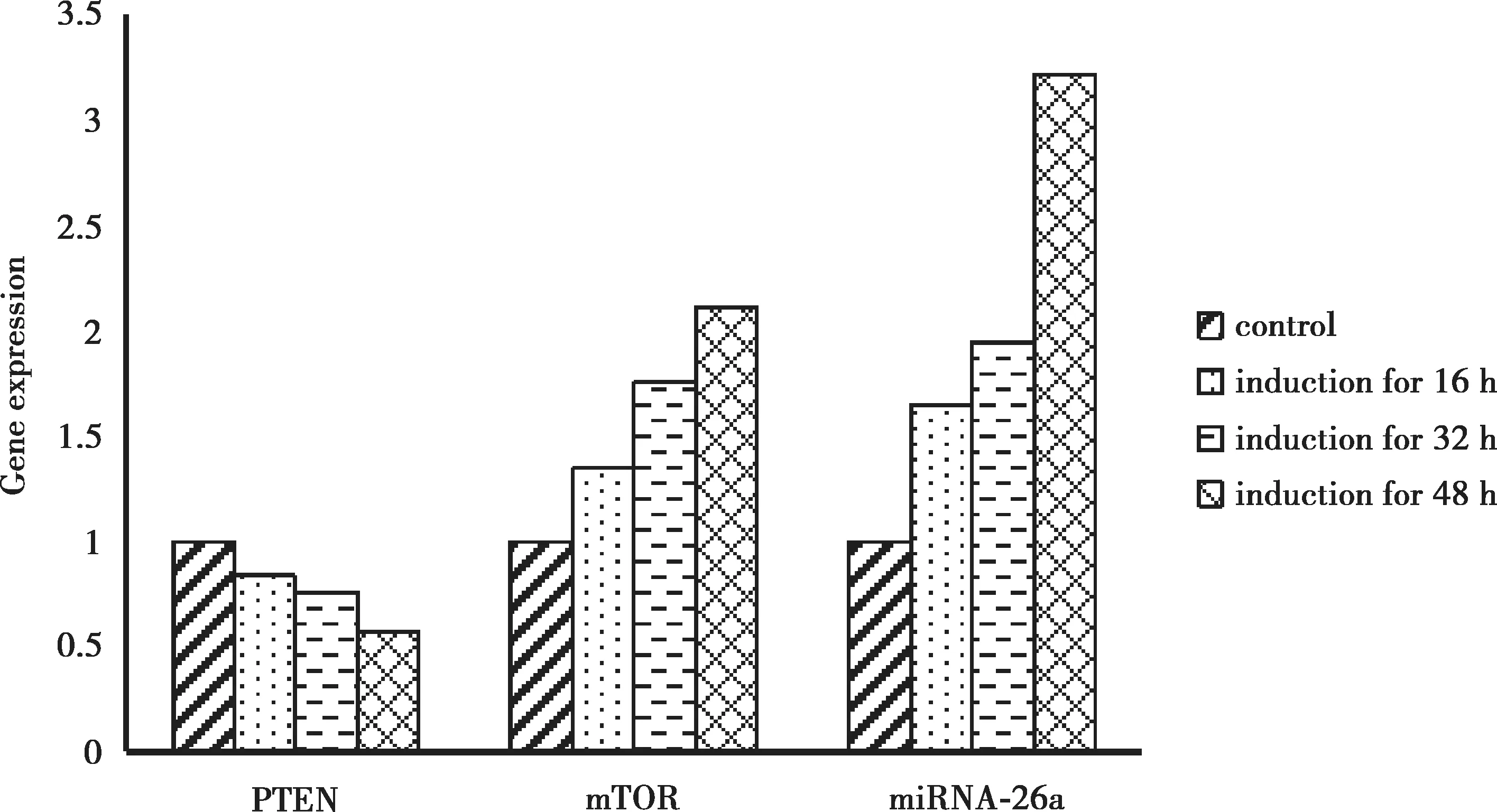
Fig.3 Detection of miRNA-26a,PTEN and mTOR gene expression by Real-time-PCR
体外细胞水平研究发现,miRNA-26a 通过PTEN在神经元细胞突起的生长中发挥重要作用[12],本项目组前期研究也表明在神经轴突再生中 miRNA-26a介导PTEN 起负调控作用,与前人研究结果相似[13]。PTEN 是1997 年被发现的一种新型肿瘤抑制基因,主要调控细胞的增殖、迁移、分化和凋亡,并参与中枢神经系统损伤和神经系统退行性疾病的发生发展[14]。研究发现利用shRNA 沉默PTEN 基因后可促进视网膜神经节细胞存活和轴突再生[15]。抑制PTEN 基因后,mTOR 信号被激活,受损的神经轴突出现再生,并形成突触连接[16]。综上所述,miRNA-26a 和PTEN 的变化与神经轴突的再生能力有着非常紧密的联系,miRNA-26a 通过抑制PTEN 而激活mTOR 信号促进轴突再生。以上研究均显示在神经元细胞中PTEN 是miRNA-26a的一个关键性作用靶点。鉴于miRNA-26a 在神经元细胞突起生长中的重要作用,本研究检测了其及下游信号分子在 BMSCs 向神经样细胞分化中表达量的变化,结果显示,在BMSCs 向神经样细胞分化过程中,随着诱导时间的延长,PTEN 表达量下降,miRNA-26a和mTOR 表达量升高。说明miRNA-26a 可能通过PTEN/mTOR 信号通路调节神经分化。
细胞水平,神经元细胞分化中PTEN、miRNA-26a 和 mTOR 三者之间的调控关系已进行了研究,得出了一定的结论,但在体内神经损伤或再生过程中三者之间表达的相关性还未阐明。因此后续将首先在动物模型中探讨miRNA-26a 和PTEN/mTOR 之间的调节作用,为临床治疗神经损伤或神经退行性疾病提供参考。

