颅内多发动脉瘤的介入诊治分析
徐剑峰 王童 刘阳 曾令勇 张波 刘藻滨 曹辉 何兴 钟俊
颅内多发动脉瘤 (multiple intracranial aneurysms,MIA)是指颅内同时存在2 个及以上的动脉瘤,其发病率占颅内动脉瘤的25%~30%[1]。MIA一旦破裂后将造成蛛网膜下腔出血、脑内出血、脑室内出血等,有极高的致残率和致死率[2]。因MIA 瘤体数量较多及瘤体形态、位置的多样性,其诊治难度较颅内单一动脉瘤明显提升,且存在漏诊、误诊的情况,为治疗方案的选择带来极大困难。血管内介入治疗具有微创、可一并处理多个动脉瘤等优势,已成为治疗MIA 的主要方式之一。本研究采用血管内介入治疗颅内MIA 患者29 例,临床效果报告如下。
资料与方法
一、一般资料
收集我院神经外科2016 年1 月至2018 年6月收治的29 例颅内MIA 患者,均实施了血管内介入治疗。病人纳入标准∶(1)有自发性蛛网膜下腔出血史。(2)经脑血管造影术(DSA)证实为颅内MIA。(3)无临床症状,其他影像学检查检测出颅内动脉瘤。排除标准∶(1)未实施介入治疗者。(2)对造影剂过敏者。(3)拒绝接受介入治疗者。29 例患者中男12 例,女17 例。年龄49~75 岁,平均年龄(57.8±9.4)岁。其中蛛网膜下腔出血11 例,脑内出血3 例。Hunt-Hess 分级∶Ⅰ级13 例,Ⅱ级9 例,Ⅲ级4 例,Ⅳ级2 例,Ⅴ级1 例。伴有脑膜刺激征16 例,伴有动眼神经麻痹4 例,伴有肢体功能不全5 例。29 例患者共有65 枚动脉瘤,其中22 例有2 枚动脉瘤,7例有3 枚动脉瘤。65 枚动脉瘤主要位于颈内动脉床突段动脉和后交通动脉,占60%,其他分布位置详见表1。

表1 颅内动脉瘤分布情况
二、治疗方法
根据患者一般身体状况、血管条件及动脉瘤位置制定手术计划。患者术前准备完毕,全身肝素化后行双侧颈内动脉及椎动脉正侧位2D-DSA 及3D-DSA。获得原始图像后自动传输至西门子Syngo后处理工作站进行三维重建,根据重建图像选择合适的工作角度进行动脉瘤栓塞。栓塞完成后再次对载瘤动脉进行3D-DSA,获得原始图像进行双容积重建。术后予以压迫止血、抗血管痉挛等治疗。65 枚动脉瘤中,采用介入治疗动脉瘤40 枚,余25 枚因动脉瘤未破裂、瘤体较小(最大直径小于3 mm)或位置较深故未采取介入治疗。40 枚中采取单纯弹簧圈填塞动脉瘤17 枚,支架辅助弹簧圈填塞动脉瘤19 枚,Pipeline 辅助下治疗动脉瘤4 枚。
三、疗效评估
术后利用双容积成像等处理技术采用Raymond 分级标准评估动脉瘤的填塞程度,Ⅰ级∶完全栓塞(动脉瘤体及瘤颈均无造影剂充盈);Ⅱ级∶近全栓塞(动脉瘤颈有造影剂充盈,而瘤体则无造影剂充盈);Ⅲ级∶部分栓塞(动脉瘤体有造影剂充盈)。
采用格拉斯哥预后评分(GOS)精确评估患者术后情况,5 分∶恢复良好-能恢复正常生活,尽管有轻度缺陷;4 分∶中度残疾-残疾但可独立生活,能在保护下工作;3 分∶重度残疾-日常生活不能独立,需要照料;2 分∶植物生存-仅有最小反应(如随着睡眠/清醒周期,眼睛能睁开);1 分∶死亡。
结 果
一、手术情况
根据Raymond 分级对动脉瘤填塞程度进行分级,结果示40 枚动脉瘤中Raymond Ⅰ级30 枚,Raymond Ⅱ级4 枚,Raymond Ⅲ级2 枚(含1 枚pipeline 覆盖瘤颈的大动脉瘤),Pipeline 密网支架瘤颈处覆盖4 枚。典型病例见图1、2。
二、术后评估
29 例患者GOS 评分结果∶5 分18 例(62.1%),4分8 例(27.6%),3 分2 例(6.9%),2 分1 例(3.4%)。远期(6 月及以上)随访情况∶1 例复发,因复发瘤体小,建议随访观察,余未有复发病例。
讨 论
颅内动脉瘤破裂是导致自发性蛛网膜下腔出血的首要原因,约占75%左右[3]。颅内MIA 属于颅内复杂动脉瘤的一种,其病因与吸烟、家族遗传及高血压显著相关,但与高血压的相关性最为密切[4],其发病人群多见于女性,动脉瘤瘤体多见于前循环系统,且MIA 是提示动脉瘤预后不良的独立危险因素之一[5],对于已破裂及未破裂的动脉瘤,需要及时进行干预。目前诊断MIA 的金标准仍是DSA,且DSA衍生出来的3D-DSA 技术能对脑血管系统进行三维重建,能够进行多角度、无死角的观察和诊断,较传统的CTA 及MRA 等检查具备更高的敏感性,提高了颅内动脉瘤特别是多发动脉瘤的检出率。3DDSA 也能提供更多的形态学及动脉瘤位置的数据,从而为动脉瘤的治疗方案制定提供更全面的指导。
临床上颅内MIA 常以蛛网膜下腔出血为首发症状,有时伴有神经功能障碍等临床表现,部分患者无相关症状。MIA 导致蛛网膜下腔出血或其他类型的脑出血时责任动脉瘤多为单个,故认定责任动脉瘤尤为重要,作者归纳起来其判断标准有以下几点∶(1)CT 检查发现蛛网膜下腔出血较多聚集处或脑内血肿形成处常伴有动脉瘤破裂。(2)若出血无明显聚集,影像学检查提示动脉瘤形态不规则、伴有子囊或位于分叉处,则为责任动脉瘤的可能性大。(3)根据患者临床症状,如伴有单侧动眼神经麻痹等可判断责任动脉瘤。(4)载瘤动脉血管痉挛较重部位者。虽然可结合多种无创手段判定责任动脉瘤,但仍建议在采取治疗前对疑似MIA 患者进行全脑血管造影,特别是多发动脉瘤位置相近或患者临床症状不明显时,则更需要完善该检查进行验证,保证责任动脉瘤判定的准确性。

图1 典型病例(女,54 岁,左侧颈内动脉床突、眼段动脉瘤)行介入治疗前后表现
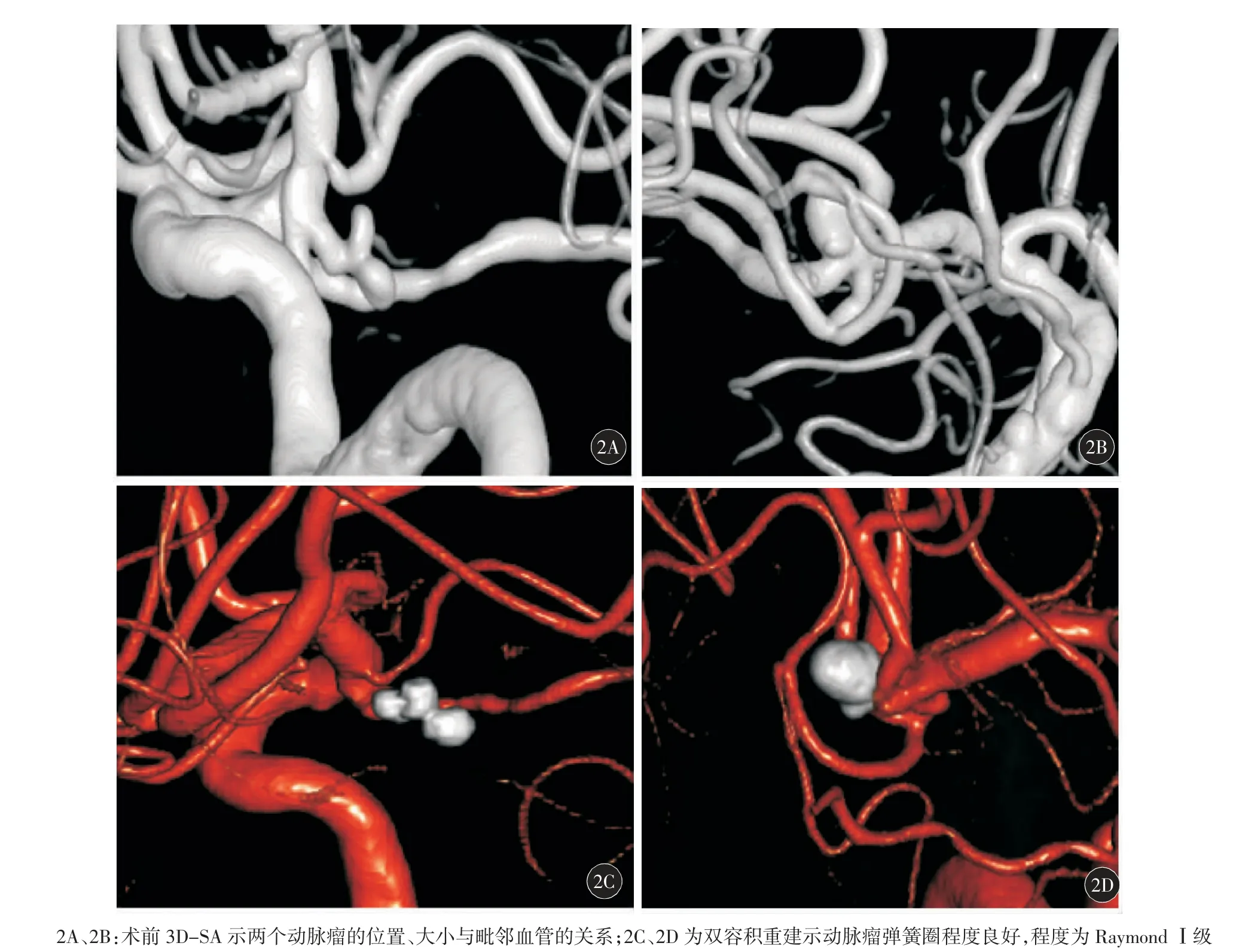
图2 典型病例(男,70 岁,大脑中动脉瘤合并后交通动脉瘤)治疗前后的血管造影表现
对于MIA 患者,确定了责任动脉和未破裂动脉瘤后,则需要尽早积极处理动脉瘤,预防动脉瘤破裂致使出血的发生。但MIA 患者中每个瘤体的大小和形态不同,故是否需要治疗所有动脉瘤,是否需要对非责任动脉瘤进行填塞,笔者认为可结合以下几点综合考虑∶(1)对于最大直径<3 mm 且形态规整的未破裂动脉瘤,可选择保守治疗。(2)对于未破裂的微小动脉瘤,若瘤体形态不规则、伴有子囊等情况,建议及时干预或短期内复查头颅CTA 或DSA密切随访。(3)后循环位置靠近脑干者,出血的风险较前循环更高[6],若发生出血,可压迫脑干在短时间内出现生命危险,建议尽早治疗。(4)特定部位动脉瘤如脉海绵窦段内的动脉瘤,相对不太容易发生破裂出血,故可采取保守治疗[2]。(5)未破裂的小动脉瘤若随访期间出现形态学变化,应及时治疗。
目前治疗MIA 主要有血管内介入治疗及开颅显微夹闭术两种方式。但MIA 患者的不同动脉瘤体之间位置常相隔较远,且对于特殊部位例如海绵窦段、床突段及后循环系统的动脉瘤,采用开颅显微夹闭术的手术难度大,且易对患者造成二次损伤。血管内介入治疗技术发展较快,随着支架、球囊辅助等技术的不断完善,新型材料如血流导向装置(密网支架、带膜支架等)的推出及应用,使得介入技术更加安全、可靠且微创,大大提高了MIA 的临床治疗效果[7-8]。密网支架是近年推出的一种新合金密网支架系统,其展开后完全贴附在载瘤动脉壁上,覆盖动脉瘤瘤颈,起到血流导向作用,降低后期再通发生率,特别是对于串联的颈内动脉床突段附近的多发动脉瘤疗效显著[9]。近年来国内外也有学者将密网支架用于治疗颅内其他部位如大脑前动脉、大脑中动脉及后循环等部位的动脉瘤,取得了较好的临床效果[10]。笔者认为对于以下情况的MIA应首选血管内介入方式∶(1)不同瘤体位置相隔较远,例如分别位于对侧大脑半球、病变分别位于前循环或者后循环。(2)全身状况良好无严重并发症,Hunt-Hess 分级为I~Ⅲ级的MIA 患者。(3)位于后循环系统的MIA 动脉瘤,介入治疗可明显降低治疗相关风险,明显改善患者预后。(4)高龄(70 岁以上)且Hunt-Hess 分级为Ⅳ~Ⅴ级的患者,若伴有部分脑内血肿或脑血管痉挛期的患者更应优先选用介入治疗[11-12]。虽然血管内介入治疗未清除脑内血肿,但有研究表明∶与微创夹闭术相比,血管内治疗3~5 d 后的蛛网膜下腔血肿吸收程度无明显差异,伴有症状的血管性痉挛发生情况亦无明显差异[13]。(5)MIA 数量大于3 个且同时累及双侧前循环(或后循环)、或者同时累及前后循环者。本研究中除一例患者因术前Hunt-Hess 评分为Ⅴ级且因家庭经济原因要求术后自动出院外,其余患者术后的GOS 评分均良好,说明血管内介入治疗对MIA 患者有确切的疗效。
综上,对于颅内MIA 这一特殊的复杂动脉瘤疾病,血管内介入治疗作为一种治疗选择的方法,具备微创、一期性、安全、有效等优点。但对于部分有严重脑内出血伴随颅内压升高、血管过度迂曲导致介入治疗难以实施、造影剂过敏、经济困难等情况的患者,在有条件开展复合手术的医院,也可将开颅动脉瘤夹闭术与血管内介入治疗两种方式结合应用。

