肝硬化食管静脉曲张出血风险的MSCTA评估研究*
罗 艺,秦 俭△,修志刚,王 玉,董官伟,郑仕诚,李 军,谢春艳
1.龙泉驿区第一人民医院 放射科(成都 610100);2.龙泉驿区第一人民医院 消化科(成都 610100)
上消化道出血是肝硬化门静脉高压所导致的严重并发症之一。近年我国肝硬化发病率呈上升趋势,门静脉高压是肝硬化患者最常见的并发症之一[1],中晚期肝硬化患者常伴有门静脉高压并形成多条门-体静脉循环通道,表现为较广泛的侧支循环开放。胃镜检查仅能观察食管静脉曲张(esophageal variceal, EV)状况,并可对EV的严重程度进行评估分级,但具有侵入性、需镇静等特点。多层螺旋CT(multiple slice spiral computed tomography, MSCT)扫描速度快,无检查痛苦,CT血管成像(computed tomography angiography, CTA)能有效显示血管并通过强大的后处理技术重建图像,从而清晰全面地展现侧支循环通路。本研究旨在探讨多层螺旋CT血管成像(multiple slice spiral computed tomography angiography, MSCTA)对食管静脉曲张出血(esophageal varicose hemorrhage, EVH)的预测价值。
1 资料与方法
1.1 临床资料
收集龙泉驿区第一人民医院2016年1月至2018年3月104例肝硬化门脉高压患者的门静脉MSCTA及临床资料,其中男75例(36~86岁),女29例(42~84岁);随访龙泉驿区第一人民医院2018年4月至2019年3月54例肝硬化门脉高压患者的门静脉MSCTA资料。纳入标准:肝硬化门脉高压者。排除标准:未行胃镜检查者;检查前进行门静脉高压减压治疗者;上腹部行其他手术者。
1.2 方法
1.2.1 EV胃镜分级方法 胃镜检查于MSCTA后一周内完成。胃镜分级如下:Ⅰ级:无EV。Ⅱ级(轻度):EV呈直线型或略有迂曲。Ⅲ级(中度):EV呈蛇形迂曲隆起。Ⅳ级(重度):EV呈串珠状,结节状或瘤状。
1.2.2 MSCTA检查方法及图像处理 肝硬化患者行MSCTA腹部扫描检查。检查方法:采用(GE MEDICAL SYSTEMS optima CT660)64排螺旋CT扫描。检查前准备:患者口服清水500~1 000 mL。对比剂:碘海醇300 g/L,对比剂用量:1.5~2.0 mL/kg体重,以2.5~3.0 mL/s流速经前臂静脉注入,门静脉期扫描延迟扫描时间60 s。检查参数:管电压120 kv,管电流250 mA,扫描层厚0.625 mm。原始图像传至工作站进行后处理,用薄层图像(层厚0.625 mm)进行最大密度投影(maximum intensity projection, MIP),多平面重建(multiple planner reconstruction, MPR),容积重建(volume reconstruction, VR)观察肝硬化门脉高压侧支血管开放情况。图像分析及实验数据的获取图像分析及数据的测量均由两名有经验的放射科医师进行,最终结果以两人商议一致为准。
1.3 统计学方法
2 结果
2.1 一般资料
104例肝硬化门脉高压患者中,非出血组60例,出血组44例,EV出血组与非出血组差异有统计学意义的指标有Child-pugh分级、血小板数。 Child-pugh分级中,A级中出血者8例,占22.2%,B级中出血者23例,占48.9%, C级中出血者13例,占61.9%。出血组与非出血组的血小板数差异较大,分别为62.00×109个/L、84.00×109个/L(表1)。
表1 104例肝硬化门脉高压患者临床资料
2.2 肝硬化门脉高压侧支血管的开放情况
本研究104例患者中,有EV的92例,占88.5%;胃左静脉(left gastric vein,LGV)显示85例,占81.7%;副脐静脉(para-umbilical vein,PUV)显示47例,占45.2%;脾肾静脉分流20例,占19.2%;胃肾静脉分流19例,占18.3%。
2.3 肝硬化门脉高压患者的目标血管与EV胃镜分级的相关分析
胃镜分级中Ⅰ级12例,Ⅱ级26例,Ⅲ级14例,Ⅳ级52例,胃镜Ⅳ级的病例数较多,占50.0%。LGV、PUV、门静脉(portal vein,PV)3支血管分别与EV胃镜分级差异有统计学意义(P<0.05),提示随着胃镜分级的增高,3支血管增粗程度增加。LGV未开放组中,胃镜分级较多集中在Ⅱ级,10例,占52.6%;LGV开放组中,胃镜分级较多集中在Ⅳ级,51例,占60.0%。PUV未开放组中,胃镜分级较多集中在Ⅳ级,32例,占56.1%,PUV开放组中,胃镜分级较多集中在Ⅳ级,20例,占42.6%。PV两组中,胃镜分级均较多集中于Ⅳ级,PV<16 mm组17例,占44.7%,PV≥16 mm组35例,占53.0%。SV、脾肾静脉分流、胃肾静脉分流与EV胃镜分级差异无统计学意义(P>0.05)(表2)。
表2 肝硬化门脉高压患者的目标血管与EV胃镜分级
2.4 肝硬化门脉高压患者的目标血管改变与出血与否的关系
LGV、PUV、PV 3支血管分别与EV出血组/非出血组差异有统计学意义(P<0.05)。LGV未开放组18例,其中17例为非出血,占94.4%,LGV未开放组中非出血的病例明显多于出血的;而7 mm≤LGV<16 mm组共28例,出血16例,占57.1%,出血的病例数明显多于非出血的。PUV未开放组57例,其中29例为出血,占50.9%;6 mm≤PUV<11 mm组18例,其中3例有出血,占16.8%,本组中发生出血的病例数明显少于非出血的,且当PUV>8 mm者发生出血的0例。PV<16 mm组38例,其中28例为非出血,占73.7%,PV≥16 mm组66例,其中34例为出血,占51.5%。脾静脉、脾肾静脉分流、胃肾静脉分流与EV出血组/非出血组差异无统计学意义(P>0.05)(表3)。
表3 肝硬化门脉高压患者的目标血管改变与出血与否的关系
2.5 肝硬化门脉高压CTA积分对出血的预测分析
将EV出血组与非出血组组间差异有统计学意义的PV、LGV及PUV改变纳入CTA积分,积分值范围0~6分,积分方法如下(表4)。

表4 肝硬化门脉高压CTA积分方法
将肝硬化门脉高压患者的CTA积分与EVH作ROC曲线分析,找到CTA积分评估EVH的cut-off值。将EV胃镜分级与EVH做ROC曲线分析,找到胃镜分级评估EVH的cut-off值。ROC曲线提示CTA积分值>3时,预测出血的敏感性为79.5%,特异性为53.3%,AUC线下面积为0.727。ROC曲线提示胃镜分级>3时,预测出血的敏感性为81.8%,特异性为73.3%,AUC线下面积为0.773。将CTA积分方法联合胃镜分级对EVH进行评估,结果如下(图1~2、表5~7)。
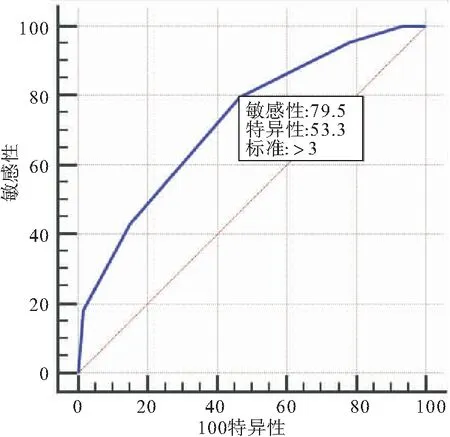
图1 肝硬化门脉高压CTA积分与EVH发生的ROC曲线
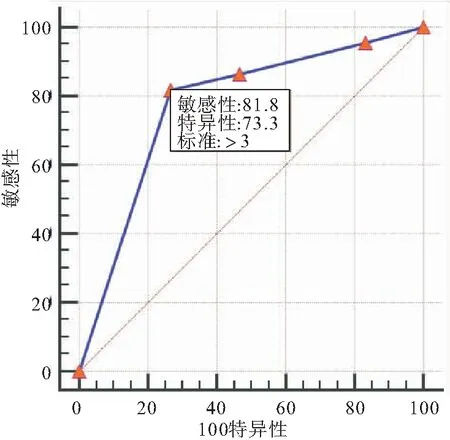
图2 EV胃镜分级与EVH发生的ROC曲线

表5 CTA积分值与出血情况分析
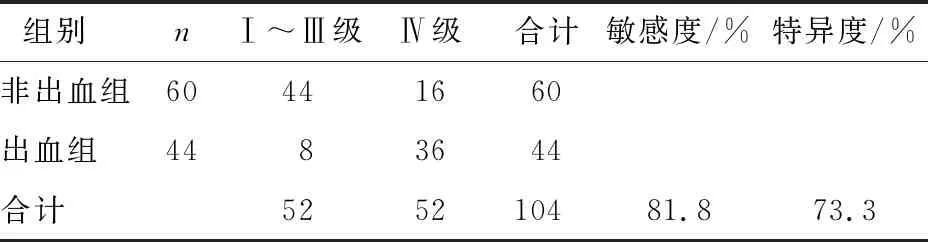
表6 EV胃镜分级与出血情况分析

表7 EV胃镜分级联合CTA积分评价与出血情况分析
2.6 CTA积分联合胃镜分级评估随访肝硬化患者EVH发生的价值
按照CTA积分方法联合胃镜分级评价的方式随访12个月的肝硬化门脉高压患者54例,将CTA积分4~6分且胃镜分级为Ⅳ级的纳入出血组,将CTA积分0~3分且胃镜分级为Ⅰ~Ⅲ级的纳入非出血组,与患者临床实际是否出血相比较。CTA图像积分方式评估肝硬化门脉高压患者出血的敏感性为77.8%,特异性为70.4%(表8)。

表8 CTA评估肝硬化门脉高压患者出血与临床结果的相关性
3 讨论
肝硬化门静脉高压所致的上消化道出血是肝硬化严重的并发症之一,在肝硬化患者中EV的发生率约50%[2],随访2年后静脉曲张患者中20%~30%发生食管胃静脉破裂出血[3],EVH患者出血后1年内发生再出血率约达60%[4]。针对肝硬化门脉高压EV破裂出血风险的预测,除Child分级、肝静脉压力梯度等方法外,临床探寻多种可行的无创性检查方法[5]尤为重要。
多层螺旋CT血管成像技术是临床上常用的诊断肝硬化门静脉高压的检测手段,可清楚地显示门静脉高压侧支循环各级分支血管[6]及血管的起止、走向及形态[7-8],对曲张静脉血管的直径能进行准确的测量[9],其所获得的高空间分辨率的图像以及强大的后处理技术,清晰而全面地展现侧支循环通路的情况。多层螺旋CT血管成像技术对曲张的食管静脉大小及位置的测定与胃镜结果具有较好的一致性[10]。有研究[11-13]认为,利用多层螺旋CT预测肝硬化门脉高压EV出血具有一定的价值。2015年中国门静脉高压食管胃静脉曲张出血防治指南[14]也肯定了多层螺旋CT及CT门静脉血管成像在诊断和指导治疗食管胃静脉曲张的价值。
正常情况下LGV的血流为向肝性血流,随着肝硬化门脉压力逐渐增大,LGV血流逐渐变为逆肝性血流,流入食管胃底静脉,所以,LGV是EV形成的主要供血血管。LGV在肝硬化门脉高压侧支血管中的出现率为 76.3%~90.0%[15],是门静脉高压最早出血曲张的血管之一。本研究显示,LGV的出现率为81.7%。刘桂勤等[13]研究显示,LGV直径≥6 mm时,肝硬化患者发生EVH可能性明显增大,其敏感度为82.9%。而宋兵等[16]研究结果显示,门脉高压出血组LGV内径较正常对照组明显增宽,以LGV直径>7 mm作为预测EVH的临界值时,其敏感性为 61.5%,特异性为 77.1%,准确性为 71.6%。本研究中,LGV≥7 mm时,食管静脉更容易发生重度曲张,EVH的发生也高于其他组(P<0.05)。也有研究[17]结果以LGV内径>6.8 mm为判断EVH 标准,敏感性为 84%,特异性为 54%,准确性为 64%。
既往研究[6,18-21]显示,PUV在肝硬化门脉高压侧支血管中的出现率为 25%~82%,出现率跨度较大,本研究中PUV的出现率为45.2%。目前对肝硬化门脉高压时PUV开放对EVH的发生是否存在影响还存在争论。本研究结果显示,PUV开放与胃镜EV分级具有相关性,即无PUV开放的肝硬化门脉高压患者发生EVH的风险较PUV开放组增高(P<0.05),PUV≥6 mm时,出血率为16.7%,PUV直径>8 mm的病例中无出血发生。Calame等[22]研究结果显示,粗大PUV(PUV>5 mm)开放减低门静脉压力作用原理类似于 TIPS,能减低 EVH 的发生率,研究中 PUV > 10 mm的病例无EVH的发生。以上研究支持了本研究结果。而张嘉瑜等[6]研究结果却显示,PUV开放和不开放组中EV占51%、40%,且EV形态无明显差异,提示PUV对EVH没有明显影响。有研究[23]提出,有1例PUV直径为12 mm的肝硬化门脉高压患者仍有EVH发生。因此,PUV对EVH的影响有多大尚需更多研究证实。
脾肾静脉分流、胃肾静脉分流可让部分门静脉血流分流进入体循环,减小门静脉压力[24],从而减小曲张食管静脉的压力及出血的发生[25]。而本研究结果显示,脾肾静脉及胃肾静脉分流在出血组与非出血组差异无统计学意义(P>0.05),提示脾肾静脉及胃肾静脉分流对EVH没有明显影响,这与Calame等[22]研究结果相似。
本研究中,PV主干直径以16 mm为界,直径≥16 mm组的EV分级多为Ⅳ级,35例,占53.0%,直径<16 mm组的EV分级也多为Ⅳ级,17例,占44.7%,且两组差异有统计学意义(P<0.05)。PV主干直径≥16 mm组的出血风险高于PV主干直径<16 mm组,且差异有统计学意义(P<0.05)。这一结果得到了刘桂勤等[13]研究的支持,该研究显示CT上测量PV主干直径>16 mm时发生中重度EV的可能性明显增大,EVH发生风险明显增高,但其敏感度为60%。
有研究[9]认为,当脾静脉直径≥8.5 mm时预测EV的敏感度为83.3%,特异度为58.1%。本组的脾静脉直径平均>8.5 mm,脾静脉的直径大小在出血组与非出血组间比较,差异无统计学意义(P<0.05),提示脾静脉直径的大小对EVH无显著影响。
肝硬化门脉高压时常为多支静脉分流,凭单支血管评估出血的可能性缺乏全面性或容易出现偏倚。本研究采用对多支血管进行分别评分,计算总分的方式进行总体评估,血管积分总数范围为0~6。结果显示,CTA积分方法评估EVH的ROC曲线显示cut-off值>3时,即积分为4~6时诊断EVH的敏感性为79.5%,特异性为53.3%,AUC线下面积为0.727。将EV胃镜分级与EVH所作的ROC曲线提示胃镜分级>3时,敏感性为81.8%,特异性为73.3%,AUC线下面积为0.773。两种方法联合评价的方式评估EVH的敏感度和特异度均有明显提高,分别为85.7%、79.7%。
将两种方法联合评价的方式用于后期随访病例中,将CTA积分4~6分且胃镜分级为Ⅳ级的纳入出血组,将CTA积分0~3分且胃镜分级为Ⅰ~Ⅲ级的纳入非出血组,与患者临床是否出血相比较后显示,CTA积分联合胃镜分级评估肝硬化门脉高压患者出血的敏感性为77.8%,特异性为70.4%。
CTA积分方法研究分析了肝硬化门脉高压的几支较大的分支血管,对开放侧支血管的系统分析还不够完善,而CTA积分方法联合胃镜分级评估EVH的敏感度及特异度较单独CTA积分评估方法有明显提高。
综上所述,肝硬化门脉高压MSCTA能够准确观察侧支血管的开放情况及程度,其所获得的高空间分辨率的图像以及强大的后处理技术,清晰而全面地展现侧支循环通路的情况。本研究中肝硬化门脉高压血管的积分方法对评估EVH的发生有重要价值。