体外转流联合多种原位开窗技术在主动脉弓部疾病腔内修复的应用*
张 科 侯培勇 李祺熠 魏立春 许太福 苏奕明
(广西医科大学第四附属医院 柳州市工人医院血管外科,柳州 545005)
主动脉夹层和主动脉瘤是病死率极高的凶险疾病[1]。主动脉腔内修复(thoracic endovascular aortic repair,TEVAR)是治疗主动脉弓部疾病的首选方案。主动脉弓部疾病包括累及弓上3个分支的主动脉夹层(壁间血肿、穿透性溃疡、动脉瘤)。主动脉弓部因结构复杂、变异繁多,手术难度极高,导致累及主动脉弓部疾病的治疗一直是血管外科的难点[2,3];同时,脑梗死、死亡等严重并发症发生率高,使主动脉弓部疾病一度成为血管外科“禁区”[4]。在保证足够长度锚定区的情况下,不导致弓上三分支血管闭塞引发脑血管意外,是手术成功的关键。随着腔内新型辅助技术(如杂交技术、烟囱技术、原位开窗技术等)的不断发展,腔内支架技术的不断革新使胸主动脉腔内修复术适应证持续扩大[5]。2016年12月~2018年12月,我们采用体外转流联合激光或穿刺针腔内原位开窗技术进行覆膜支架腔内修复术治疗20例累及主动脉弓部疾病,取得较好疗效,现报道如下。
1 临床资料与方法
1.1 一般资料
本组20例,男13例,女7例。年龄38~78岁,(56±5)岁。急性胸背部剧烈疼痛9例,胸部隐痛闷胀不适11例。发病至手术时间6 h~14 d,(7±2)d。均行全主动脉CTA确诊,其中主动脉Stanford A型夹层5例,升主动脉合并主动脉弓部动脉瘤1例,全程主动脉壁间血肿2例,主动脉Stanford B型夹层12例。均行超声心动图检查明确有无瓣膜病变,其中主动脉瓣关闭不全(中度以上)4例,二尖瓣关闭不全5例,心包积液(大量)2例。合并高血压(高危以上)17例,急性肾功能不全(肌酐平均每日增加≥44.2 μmol/L,表现为少尿或无尿)3例。有吸烟史12例,车祸胸部外伤史1例。
病例选择标准:①首发症状为急性胸背部剧烈疼痛或胸部闷胀不适;②全主动脉CTA或主动脉造影检查明确诊断为累及至少1根弓上分支动脉(左锁骨下动脉、左颈总动脉、头臂干)的主动脉疾病;③Stanford A型夹层破口未累及冠状动脉开口;④Stanford B型夹层或动脉瘤近端没有足够的锚定区;⑤升主动脉近心端锚定区>1.5 cm。
1.2 手术方法(以三分支开窗为例)
1.2.1 建立手术入路 平卧体位,全身麻醉后行经颅多普勒超声(transcranial Doppler,TCD)监护。解剖游离远端双侧颈总动脉,穿刺左肱动脉,双侧股动脉留置8Fr管鞘建立手术通路。
1.2.2 建立脑部体外转流 ①颈-颈动脉转流:在双侧颈总动脉远心端置入8Fr血管鞘,近心端置入16Fr血管鞘,置入升主动脉,再分别连接近远端鞘管,做双侧颈总动脉体外转流。②股-颈动脉转流:在双侧颈总动脉远心端置入8Fr血管鞘,穿刺一侧股动脉置入22Fr血管鞘,置入腹主动脉中上段,再用连接管连接股-颈血管鞘管,做股-双侧颈总动脉体外转流。
1.2.3 术前造影 全主动脉造影,明确破口位置及大小、椎动脉优势及病变累及范围,结合术前CTA测量结果及术中DSA造影结果,按105%~110%比例确定植入覆膜支架近端内径(深圳先建、上海微创或美国戈尔胸主动脉覆膜支架系统,近端直径30~45 cm),标记定位覆膜支架近端锚定区,先植入升主动脉支架,再植入降主动脉段支架,两个支架之间至少重叠3 cm以上。
1.2.4 原位开窗 ①激光原位开窗:胸主动脉支架释放后,在体外将400 μm静脉光纤(意大利优福通公司环形激光)置入4 mm×40 mm PTA球囊扩张导管内,光纤头端外露1 cm,球囊导管尾端用Y阀固定,将Fustar可调弯鞘(深圳先建科技公司,SVA10F-550或SVA8F-550)引入头臂干,将激光光纤置入并抵住胸主动脉支架,通过多角度确定鞘管头端保持与覆膜支架垂直,用12 W激光维持5秒进行原位开窗。②穿刺针原位开窗:胸主动脉支架释放后,将Fustar可调弯鞘引入头臂干,置入穿刺针(深圳先健科技公司腔内穿刺系统)抵住胸主动脉支架,将穿刺系统头端球囊打起固定后再激发穿刺针行原位开窗(图1、2)。
1.2.5 释放支架 若突然有落空感,应立即停止激光灼烧或穿刺针穿刺,避免损伤血管,并行造影证实开窗成功后,依次使用球囊扩张导管扩张覆膜支架穿孔处,再经导丝置入Fluency plus覆膜支架,通过开窗部位重新建立分支动脉。术中交替连接左右颈总动脉鞘管,以保证脑部血供。同样的方法依次重建左颈总动脉和左锁骨下动脉。待全部支架释放完毕后,再行全主动脉造影,了解弓部三分支血供情况、各支架位置及有无内漏(图3)。
1.2.6 缝合切口 撤出动脉鞘,5-0血管缝线缝合双侧颈总动脉穿刺点,并逐层缝合颈部切口,加压包扎左侧肱动脉,血管缝合器缝合股动脉穿刺点。
1.3 随访
出院后1、3、6个月及每年随访,复查全主动脉CTA(图4),必要时行全主动脉造影检查,了解支架位置、有无内漏、主动脉弓部三分支有无血栓或狭窄[6,7]。
2 结果
1例术前评估拟行“三开窗”者,术中造影后升主动脉破裂死亡。19例成功完成原位开窗(应用体外转流10例),具体方法见表1,其中1例因左锁骨下动脉弯曲角度过大未能完成原位开窗,置入烟囱支架。1例三开窗患者,术中TCD监测到有栓子脱落,术后第2天双侧瞳孔不等大,查头颅CT提示大面积脑梗死,术后第3天死亡(图5)。术后早期并发症2例:1例为主动脉三开窗术后神经功能障碍2周(表现为一过性情绪失控、躁狂等),复查颅脑CT无脑梗死,考虑转流后脑血流灌注波动所致,予以镇静、扩张血管、改善脑循环、营养脑细胞等对症治疗,2周后症状消失;1例既往存在慢性阻塞性肺疾病,术前合并肺部感染,术后呼吸功能不全合并感染,经抗感染、止咳化痰等对症治疗,10天后痊愈。存活的18例随访6~30个月,(18±3)月,均无不适,全主动脉CTA显示主动脉弓部病变部位均隔绝良好,无内漏,开窗血管通畅。

表1 19例原位开窗主动脉腔内修复的方法
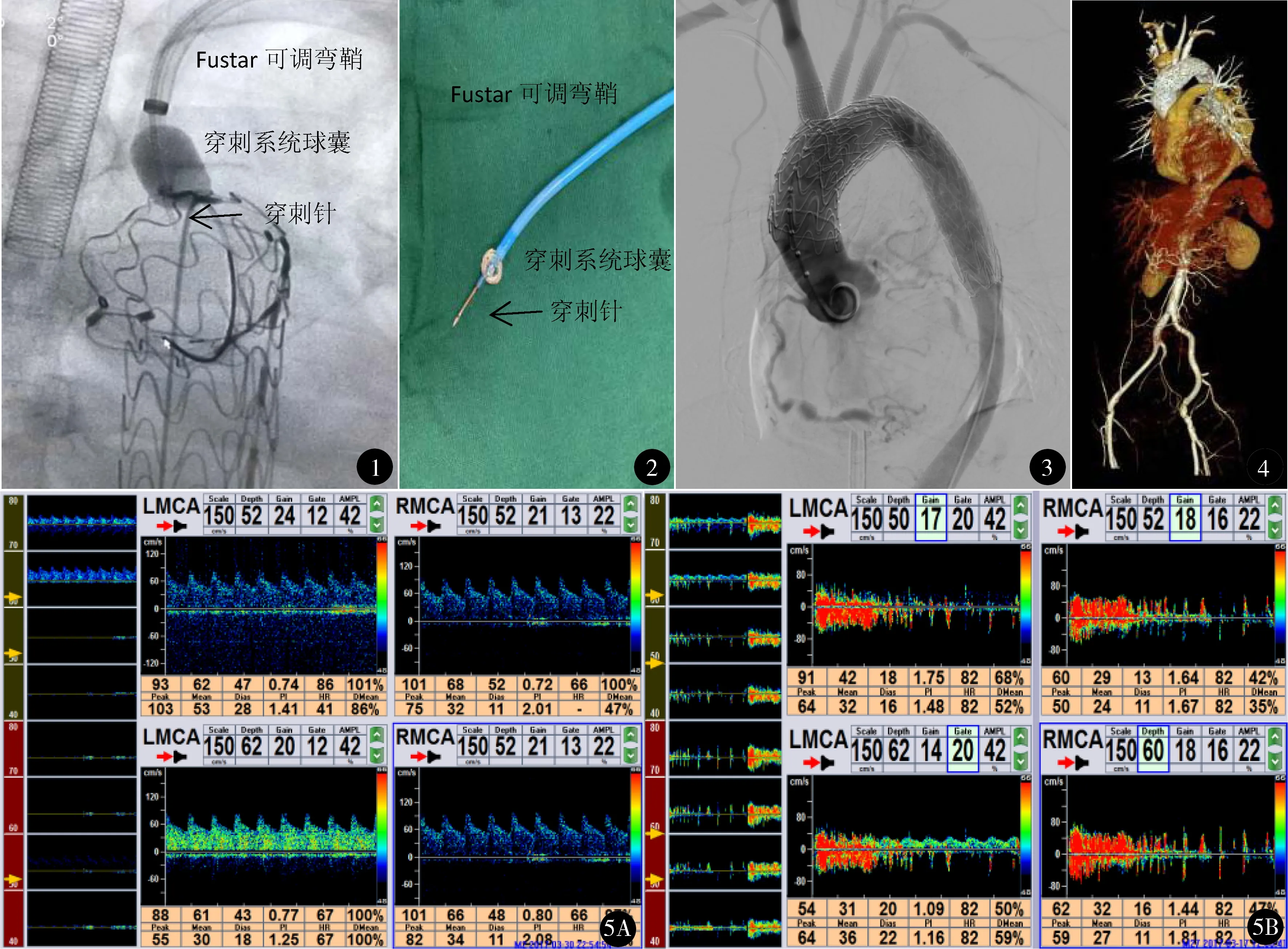
图1 使用穿刺针(腔内穿刺系统)开窗 图2 体外演示穿刺针激发 图3 行三开窗后主动脉造影示主动脉支架位置及形态良好,无内漏,弓上分支血流通畅无狭窄图4 三开窗术后1个月复查CTA示主动脉支架及弓上分支支架位置及形态良好,无内漏,弓上分支血流通畅无狭窄 图5 术前TCD(A)监测颅内持续规则频谱,显示脑血流正常;激光开窗术中TCD(B)监测到红色紊乱频谱,提示有栓子脱落
3 讨论
弓上三分支均受累的主动脉弓部疾病,特别是升主动脉瘤或Stanford A型夹层的治疗,一直是血管外科的“禁区”。其关键是在解决术中脑血供的前提下,快速重建弓上三分支血管,扩大锚定区来完成腔内支架修复问题。我们在主动脉弓部疾病处理中,先建立体外双侧颈动脉转流,保证术中脑循环灌注持续充足的前提下,再配合覆膜支架原位开窗,逐一重建头臂干、左颈总动脉和左锁骨下动脉血供,达到满意的治疗效果。本组7例弓上三分支开窗术,除1例术中升主动脉破裂死亡外,其余6例均获得成功,但1例激光原位开窗者术后因出现大面积脑梗塞死亡,分析该例头臂干开窗困难,使用激光开窗时间稍长,术中TCD监测到血流频谱波动幅度大且紊乱,提示有栓子脱落(图5),栓子可能是动脉斑块脱落,也可能是血栓脱落。
我们总结分析三开窗术后死亡的病例,明确术前评估Willis环和主动脉弓形态的重要性。目前我们常规术前用TCD评估Willis环是否开放,为术中选择何种转流方式做准备,若Willis的前后交通均存在,可只行一侧颈动脉转流,若不存在则需同时行双侧颈动脉转流保证颅内血供。在行体外转流时,完整的Willis环可以减少缺血事件的发生。充分了解主动脉弓形态是弓上动脉介入治疗术前必不可少的[8]。主动脉弓形态有多种分类标准,其中Myla分型[9]以主动脉弓顶至头臂干(brachiocephalic trunk,BCT)垂直距离与颈总动脉直径比值把主动脉弓形态分为3类。经典的是根据BCT发起的水平位置来分型[10]:沿主动脉弓弧形最高、最低点分别作一水平线,根据主动弓上三支的位置判断主动脉弓形态,主动脉弓三分支动脉均在最高点水平线以上者为Ⅰ型,BCT位于上述两水平线之间为Ⅱ型,BCT位于最低点水平线之下为Ⅲ型。本组20例中主动脉弓Ⅰ型5例,Ⅱ型9例,Ⅲ型6例。我们的经验是,Ⅰ型三分支在主动脉弓上较平直,原位开窗成功率高,而Ⅱ、Ⅲ型与主动脉弓形成的角度变小,加大光纤或穿刺针向前向下滑动的几率,增加开窗的难度。因此,术前明确主动脉弓分型,对术中支架的选择、开窗方式的选择及可能出现的情况都有指导作用。
我们开展脑循环体外转流技术,最先采取颈-颈动脉体外转流,因需要将转流的动脉导管插入升主动脉,在处理A型夹层时容易导致血管壁破裂,另外,操作步骤较繁琐,易导致颈动脉斑块脱落,增加脑梗死几率,特别是在开窗困难时尤为突出,因此,我们改用股-颈动脉转流,术中测压显示与颈-颈动脉转流相仿(压力差2~4 mm Hg)[11]。故股-颈动脉转流同样也可以达到持续充足血流量提供脑循环血供的目的(术中使用TCD监测),且具有避免行头臂干和左颈总动脉开窗及支架过程中置入球囊或支架对脑循环的影响,使操作更加方便,降低颈动脉斑块脱落的风险等优势。但在处理A型夹层破口位置较高时,转流的流量无法达到脑部供血所需的最低要求,故应用受限,我们考虑有一部分因素是转流管的接头过多,管径过小,导致血流量不足,为此我们专门设计了新型体外转流管(正在申请国家专利)。或者应用颈总动脉人工血管旁路转流技术、体外循环,虽然增加了手术难度,但转流的效果明确,能很好地起到脑保护作用。
目前国际主流原位开窗技术使用射频探针、穿刺针或尖导丝、原位逆行开窗和激光原位开窗,各具优缺点[12~14]。国内使用较多的是穿刺针和激光原位开窗。激光原位开窗由Murphy等[15]于2009年首次报道,为1例急性主动脉创伤修复术中对Dacron支架行激光原位开窗,重建左锁骨下动脉的年轻病例。张省等[16]报道110例半导体激光原位开窗术也显示该方法的可行性。我们应用激光原位开窗技术行左颈总动脉和左锁骨下动脉腔内重建手术11例均获成功,术后开窗支架通畅性好,无内漏发生。但在应用头臂干开窗时,难度大大增加,特别是Ⅱ、Ⅲ型主动脉弓,因为锐角加大,受力面变小,光纤易向前向下滑动,激光灼烧后,在更换导丝过程中,球囊导管容易移位,导丝再次进入困难。另外,可能因为角度问题导致支架无法完全展开,有可能开窗的位置刚好在支架骨架旁边,使得球囊导管难以进入。这些因素均会延长激光开窗时间,任何型号的激光使用过久均会引起血液凝固,形成血栓,而且反复操作也会引起颈动脉斑块脱落,增加术中脑梗死风险。我们术中使用TCD监测,可明确激光使用时间过长有栓子脱落至颅内的情况,术后头颅CT也证实发生脑梗死。因此,在开窗过程中,如果第一次激光开窗失败,则改用尖导丝开窗;但这一方法容易损伤血管壁,为解决这一问题我们也设计了新的穿刺针(正在申请国家专利)。现在我们使用由王利新等[17]研发的原位开窗系统,该腔内穿刺系统较好地解决了这一问题,配合Fustar可调弯鞘,在穿刺完成的同时,能够直接引入导丝完成开窗,简化操作步骤,我们使用该系统完成8例,术中开窗TCD监测均无栓子脱落。
综上,在累及主动脉弓部疾病中,应用体外转流联合原位开窗技术的胸主动脉腔内修复术安全、有效,具有创伤小、成功率高、并发症少、内漏发生率低等优点,近期效果良好,中远期疗效仍需长期、持续观察与随访。

