内镜联合腹腔镜序贯手术治疗胃-结肠同时性双发癌1例报告*
苏 畅 刘绍群 冯 莉 谢 蕴 申晋疆 张晓红 曹奕鸥
(复旦大学附属中山医院闵行分院胃肠外科,上海 201199)
得益于一次麻醉胃肠镜联合检查的应用推广,临床上胃和结直肠同时性双发癌的检出率有所增加。治疗胃和结直肠同时性双发癌,传统手术方法是开腹胃癌根治术联合结肠癌根治术,带来超大手术切口的同时也影响患者的术后恢复[1]。Tokunaga等[2]提倡全腹腔镜根治术治疗胃-结直肠同时性双发癌,杨宏等[3]认为开腹联合腹腔镜可能是更便捷的治疗方式。然而,无论行开腹、腹腔镜或开腹联合腹腔镜手术治疗胃-结直肠同时性双发癌皆耗时较长,创伤较大,麻醉和手术风险皆较高,并发症较多,不利于患者的恢复。内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗早期胃癌的疗效已得到肯定[4],我们对1例早期胃癌合并中期结肠癌行内镜联合腹腔镜序贯手术,取得较为满意的效果,现报道如下。
1 临床资料
男,75岁。因反复中上腹胀痛不适1月余于2018年3月20日就诊我院。门诊行胃肠镜检查:胃镜检查见胃底小弯黏膜充血(图1A),活检病理为胃底小弯低级别上皮内瘤变,部分腺体高级别上皮内瘤变,局灶癌变;肠镜检查提示结肠肝曲见增殖性肿物,堵塞肠腔,镜身无法通过(图1B),活检病理为升结肠腺癌。诊断“胃底病变、结肠肿物”收治入院。既往无慢性疾病史,近期体重无明显减轻。查体:神清,精神尚好,皮肤、巩膜未及明显黄染,浅表淋巴结未及肿大。腹隆软,全腹无明显压痛、反跳痛,未扪及包块,肝区叩痛阴性,肠鸣音3~5次/min。实验室检查:CEA、AFP、CA125、CA19-9、CA724皆在正常范围内。腹部增强CT提示胃壁局部软组织略增厚,胃周淋巴结无肿大(图1C),升结肠肝曲肠管管壁不规则增厚伴强化,未及明显转移性病灶(图1D)。经胃肠外科、内镜中心、病理科、影像科多学科团队讨论,术前分期T1N0M0(胃),T3N0M0(升结肠)。征得患者及其家属知情同意,决定行胃肿瘤ESD联合腹腔镜结肠癌根治术。
全身麻醉,取左侧卧位。先行ESD切除早癌病灶。内镜下使用氩气刀距病灶边缘5 mm进行标记,于病灶边缘标记点外侧进行多点黏膜下注射1∶10 000肾上腺素生理盐水,见病灶抬举良好、抬举征呈阳性,针形刀预切开起始切开点,IT刀依次电凝电切,完整切除病灶,和谐夹联合尼龙绳封闭创面(图1E),标本送冰冻病理。改仰卧位,于脐下缘置10 mm trocar,建立气腹,置入30°腹腔镜。探查见:胃底小弯浆膜面无明显穿孔;胃周未探及明显淋巴结肿大;结肠肝曲直径5 cm肿物,环腔1周,侵及浆膜外;盆腔、肠系膜、肝脏、腹壁等未见转移性结节,肠系膜血管根部未及明显肿大淋巴结。决定行腹腔镜右半结肠癌根治术,手术径路选择自下而上、由内向外的中间入路。超声刀于回结肠动脉的投影切开系膜,解剖回结肠动、静脉,向上游离找到肠系膜上静脉,清扫周围淋巴组织。于肠系膜上动脉左侧离断回结肠、右结肠动静脉根部,清除主淋巴结;继续向上游离并离断外科共同干结肠支、中结肠动脉右支。打开右结肠系膜,进入结肠系膜后叶与肾前筋膜间的融合筋膜间隙并向头侧分离,显露十二指肠、胰头及右侧输尿管,完整切除结肠系膜前后叶。在胃网膜血管弓下方切开胃结肠韧带,切除右侧大网膜。继续向右离断肝结肠韧带及右膈结肠韧带,切开升结肠右侧侧腹膜,完成右半结肠游离。于脐上缘做一5 cm纵行切口,体外完成标本的切除,并行回肠、结肠端侧吻合。术中冰冻病理:胃病灶切缘阴性,术毕。手术时间180 min,其中ESD 60 min,腹腔镜右半结肠癌根治术120 min。术中出血共100 ml,其中ESD出血30 ml,腹腔镜右半结肠癌根治术出血70 ml。
术后常规禁食、胃肠减压、静脉营养,应用质子泵抑制剂及预防性抗生素。术后第3天下床活动并肛门排气,术后第5天进食流质,无出血、穿孔、吻合口漏、肺部及腹腔感染等并发症发生。术后病理:胃黏膜内癌,标本边缘及基底未见肿瘤(图1F);右半结肠溃疡型腺癌,分化Ⅱ~Ⅲ级;癌组织浸润肌层外纤维脂肪组织;切缘未见癌组织累及,脉管内未见明显癌栓,神经束见癌累及;检出回盲部淋巴结10枚,其中2枚见转移,结肠旁淋巴结1枚,未见癌转移(图1G)。术后2周起予Xelox方案化疗,共8次。术后半年复查胃肠镜,胃镜示胃底小弯ESD术后改变(图1H),活检病理为慢性萎缩性胃炎;肠镜示右半结肠术后改变,吻合口黏膜光整(图1I)。
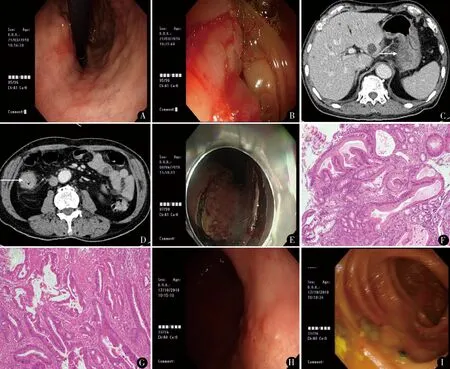
图1 A.胃镜检查示胃底小弯黏膜充血;B.肠镜检查示结肠肝曲见增殖性肿物,堵塞肠腔,镜身无法通过;C,D.腹部增强CT示胃壁局部软组织略增厚,胃周淋巴结无肿大,升结肠肝曲肠管管壁不规则增厚伴强化;E.胃底病变内镜黏膜下剥离;F.胃标本镜下见腺管上皮拥挤、重叠,核大、深染,核/质比增加(HE染色 ×100);G.右半结肠根治标本镜下见瘤细胞呈不规则腺样排列,界限不清,核大、深染,极向消失(HE染色 ×100);H.术后半年复查胃镜:胃底小弯ESD术后改变;I.术后半年复查肠镜:右半结肠术后改变,吻合口黏膜光整
2 讨论
一次麻醉胃肠镜联合检查的应用提高胃结直肠双发癌的检出率,也使胃肠科医师越来越多的面临如下问题:采取何种手术方式可使患者最大程度地获益?胃癌根治联合结肠癌根治术,手术操作流程复杂、清扫淋巴结范围广,不论开腹还是腹腔镜手术,抑或开腹联合腹腔镜手术,手术时间长、创伤大等风险因素皆不可避免,容易继发肺部感染、褥疮、静脉血栓形成等并发症。近年来,ESD治疗早期胃癌的价值愈来愈受到临床重视,ESD切除早期胃癌手术时间、住院日均短于手术组,且并发症发生率亦较低,5年生存率与手术相当[5]。当同时罹患早期和进展期恶性肿瘤时,进展期肿瘤的生物学行为往往决定患者预后[6]。因此,对于早期胃癌同时并发进展期结直肠癌的患者,内镜联合腹腔镜序贯手术成为可供选择的处理方式之一。
本例胃镜提示胃底病变系无溃疡灶形成的黏膜内癌,术前影像学检查亦未见胃周淋巴结转移征象,符合内镜下切除指征[7],综合患者年龄因素,我们采取ESD联合腹腔镜右半结肠癌根治的序贯治疗方式,手术总耗时180 min,明显短于文献报道完全腹腔镜手术(平均390 min)[1,2]或腹腔镜联合开腹手术(平均250 min)[3],手术风险下降,对患者起到很好的保护作用。将腹腔镜手术和ESD结合起来,既保证疗效和安全性,又精简手术过程,降低手术难度,实现全面的微创,使患者最大程度地获益。内镜联合腹腔镜序贯治疗早期胃癌合并进展期结直肠癌需注意以下几点:①序贯治疗的顺序不可颠倒,如内镜下无法切除病灶可直接转腔镜手术,ESD冰冻病理提示切除不完全时可即刻追加手术。②环形切开病灶时深度要足够,充分抬举暴露黏膜下层;完成病灶剥离后需仔细检查、处理创面,预防出血。③ESD术中不宜注气过多,气体建议选用CO2,减少肠道胀气对后续腹腔镜手术的影响。④腹腔镜手术探查中需检查内镜切除处局部有无穿孔或疑似穿孔,必要时缝合修补。⑤行腹腔镜右半结肠癌根治术时,采用自下而上的手术径路可更为便捷地找到肠系膜上静脉并进行周围淋巴结清扫;处理外科共同干和结肠中动脉时,如局部结构不清影响判断,可采用自下而上结合由上而下的手术方法,避免损伤血管。另外,需要指出的是,本联合术式仅适用于特定的患者,如该患者胃病变直径较大、浸润程度较深、淋巴结转移风险较高,应果断实施胃癌根治联合结直肠癌根治术,不能一味地追求微创而忽视肿瘤的根治。

