克罗恩病结肠狭窄内镜下切开术1例报告
向丽园 崔伯塔 张发明
(南京医科大学第二附属医院消化医学中心,南京 210011)
内镜下切开术已应用于内镜黏膜下剥离术[1]等,但在克罗恩病(Crohn’s disease, CD)导致结肠纤维性狭窄的患者中鲜见报道。我科2018年3月成功实施内镜下切开治疗CD结肠狭窄1例,随访14个月,疗效满意,报道如下。
1 临床资料
女,47岁,因反复左下腹痛十年余入院。患者十年来腹痛反复发作,先后经柳氮磺吡啶、泼尼松口服、肠内营养等治疗,病情反复,曾发生肠梗阻。2年前肠镜示距肛门35cm可见肠腔环周型狭窄,镜身无法通过。小肠磁共振示回肠末端、降结肠肠壁增厚,降结肠局部肠管稍狭窄,外院诊断CD。患者于2018年3月入我院治疗。入院查体:左下腹压痛,无反跳痛,未触及包块。实验室血液检查均正常。小肠磁共振示第2组小肠肠壁增厚,肠腔见局限性狭窄,乙状结肠降结肠交界处肠壁稍增厚,肠腔狭窄,狭窄段长约15.23 mm(图1)。结肠镜示乙状结肠与降结肠交界处见一狭窄环,内镜无法通过(图2A)。由于小肠磁共振示乙降结肠交界处狭窄段肠壁稍增厚,轻度强化,周围结构清晰,无瘘管、脓肿及增大淋巴结,肠镜下该狭窄环周围无溃疡,结合小肠磁共振鉴别纤维性狭窄和炎性狭窄的方法[2]及内镜表现,综合考虑该狭窄处为纤维性狭窄,遂行肠镜下狭窄环切开术(图2)。肠镜透明帽辅助,对乙降结肠交接段狭窄环,用钩刀[Olympus公司,KD-620LR,4.5 mm×1.3 mm×1650 mm, 国食药监械(进)字2014第3250214号]放射状切开2处,达肌层,最后补充切开时,出现肉眼可见直径约2 mm穿孔,用3枚钛夹(南京微创医学科技股份有限公司,ROCC-D-26-195-C,2.6 mm×1950 mm)局部夹闭。术后给予禁食、莫西沙星抗感染,生长抑素抑制消化液分泌,肠外营养等治疗。术后当晚患者腹痛进行性加重,左下腹有压痛及反跳痛,考虑局部穿孔刺激腹膜;术后第1天查白细胞19.7×109/L,超敏C反应蛋白67.4 mg/L;术后第2天腹痛明显缓解,开始少量饮水;术后第3天开始肠内营养;术后第5天肠内营养无不适,复查血常规、超敏C反应蛋白正常,停用抗生素;术后第7天病情稳定出院。出院后口服营养粉剂,逐步过渡为普通饮食。2019年5月(术后14个月)随访:1~2次成形便/d,在排便前偶有轻微腹痛;肠镜见狭窄环切开处平坦,周围黏膜光滑,肠镜可顺利通过(图3),虽可见纤维环存在,但是肠镜能通过,未再次切开。
2 讨论
CD治疗包括药物、肠内营养、粪菌移植[3]、内镜以及手术等综合治疗。内镜治疗作为介入炎症性肠病(inflammatory bowel disease, IBD)的手段,主要包括内镜下球囊扩张、切开、支架置入、经内镜肠道植管术[4,5]。2015年Bharadwaj等[6]提出长度<4 cm的良性纤维性狭窄、无严重合并症者适合内镜治疗,长度>4 cm、多段、成角、可疑恶性的狭窄、存在狭窄相关的瘘管、脓肿等相对不适用。对满足内镜治疗适应证的CD合并狭窄,球囊扩张较广泛应用。支架置入可作为难治性CD狭窄的治疗方式之一,但自发移位率较高,临床疗效不确切[4]。
2017年Lan等[7]报道该内镜下切开技术主要用于球囊扩张疗效不佳或操作困难的狭窄。本例术前行影像学评估明确狭窄环位于乙降结肠交界,长度约15.2 cm,为纤维性狭窄。与球囊扩张相比,此处狭窄环内镜下切开有效率高,维持时间长,狭窄复发率更低[8], 故选择内镜下切开治疗。内镜下切开穿孔率低,但出血风险更高[8]。本例内镜下切开术在最后补充切开时出现穿孔,但及时发现并行钛夹夹闭,提示术中切开过深,穿孔风险增加,但穿孔不是中转手术的必须,术后短时间(12~24 h)出现急腹症可能短期不可避免,但在有效夹闭的基础上密切观察病情,患者可能免于手术补救。术后14个月复查肠镜虽然见狭窄环,但是内镜可以顺利通过,暂时不需要再次切开,如果再次出现梗阻症状或者内镜不能通过,可以再次切开。综上,内镜下切开术治疗纤维性狭窄,充分的术前准备,良好的内镜操作技术非常重要。
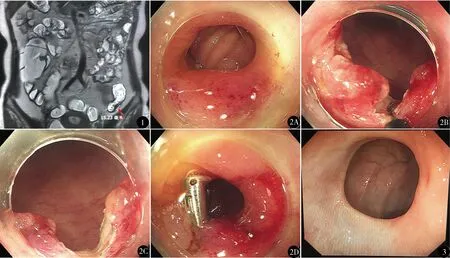
图1 小肠磁共振见乙降结肠交界处长度为15.23 mm狭窄段 图2 内镜下狭窄环切开术 A.内镜下乙降结肠交界处见一狭窄环,内镜无法通过;B.内镜下切开过程;C.钩刀切开后达肌层;D.术中穿孔后钛夹局部夹闭 图3 术后14个月复查肠镜,见狭窄环,但黏膜光滑,肠镜可顺利通过

