腹腔镜下膀胱全切除前后施行盆腔淋巴结清扫术的疗效对比
曾晓明,母健君,白 冰,雷 弋,王 岭
(攀枝花市中心医院,四川 攀枝花,617067)
膀胱癌是泌尿科较常见的恶性肿瘤,20%~40%初诊为浸润性膀胱癌,临床多表现为无痛性血尿、排尿困难等症状[1]。目前,根治性膀胱全切术是膀胱癌的主要治疗方法,但由于浸润性膀胱癌容易出现淋巴结转移,因此盆腔淋巴结清扫对治疗效果存在重要影响[2]。近年,随着腹腔镜在泌尿外科的应用推广,膀胱癌的治疗效果有所提高,但关于盆腔淋巴结清扫术是在膀胱全切术前还是后仍存有较大争议[3]。为此,本研究选取120例男性患者深入分析两种治疗手段的临床疗效。现将结果报道如下。
1 资料与方法
1.1 临床资料 选取2014年7月至2016年7月于本院接受腹腔镜下膀胱全切术+盆腔淋巴结清扫术的120例男性膀胱癌患者作为研究对象,患者均为原位膀胱癌,无中转开放手术。通过随机数字表将患者随机分为两组,A组(n=60)于腹腔镜膀胱全切术前行盆腔淋巴结清扫术,B组(n=60)于腹腔镜膀胱全切术后行盆腔淋巴结清扫术。两组患者年龄、临床分期等差异无统计学意义(P>0.05),见表1。
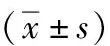
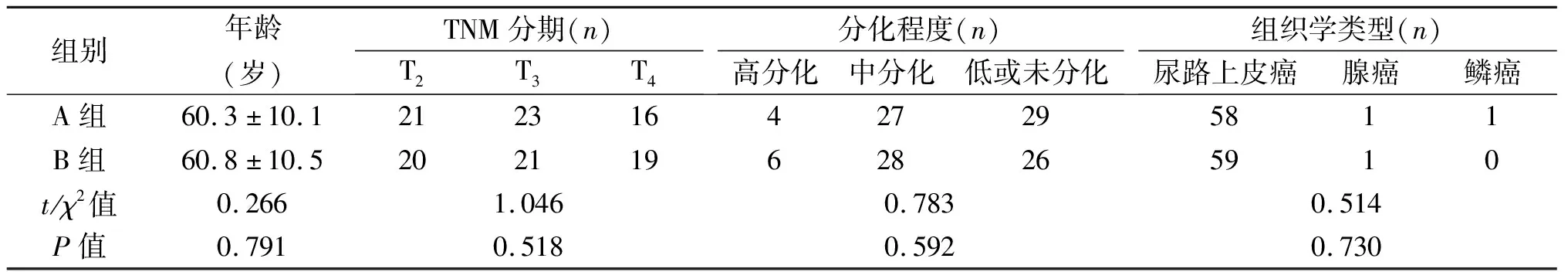
组别年龄(岁)TNM分期(n)T2T3T4分化程度(n)高分化中分化低或未分化组织学类型(n)尿路上皮癌腺癌鳞癌A组60.3±10.1212316427295811B组60.8±10.5202119628265910t/χ2值0.2661.0460.7830.514P值0.7910.5180.5920.730
1.1.1 纳入标准 (1)TNM分期Ⅱ~Ⅳ期;(2)年龄≤75岁;(3)方案经伦理委员会批准,且患者及家属签署知情同意书。
1.1.2 排除标准 (1)既往膀胱及前列腺手术史;(2)尿路上皮肿瘤复发;(3)合并淋巴结与远处转移;(4)凝血功能障碍;(5)精神系统疾病;(6)重要脏器功能障碍;(7)合并其他系统恶性肿瘤;(8)麻醉禁忌证;(9)临床资料不全。
1.2 手术方法 均行气管插管全身麻醉,患者取平卧头低、30°仰卧位,常规5孔法穿刺Trocar。手术均由同一组手术及麻醉医师完成。A组患者于膀胱全切术前行盆腔淋巴结清扫术,B组于膀胱全切术后行盆腔淋巴结清扫术。膀胱全切除术:(1)游离一侧输精管、输尿管、外侧精囊至膀胱壁,解剖出一侧的髂内动脉及其分支,于阴部内动脉下方的脐动脉起始部结扎髂内动脉分支,阻断膀胱、前列腺的主要动脉供血(图1),同法处理对侧输尿管及髂内动脉。(2)于两输尿管之间切开腹膜,游离膀胱及前列腺直肠间隙,至前列腺尖部。(3)标准法清扫完一侧盆腔淋巴结后离断同侧膀胱侧韧带、前列腺侧血管蒂,同法处理对侧盆腔淋巴结及膀胱前列腺韧带。(4)分离耻骨后间隙,游离、显露出背静脉复合体,8字缝扎后切断。(5)用剪刀剪断前列腺尖部尿道。盆腔淋巴结清扫术:采用标准法切除盆腔淋巴结,清扫范围下界至血管穿出腹壁处,即旋髂深静脉跨越髂外动脉处,上界至髂总动脉分叉处,外侧界为生殖股神经,内侧界为膀胱侧壁。清扫方法及手术步骤为:(1)纵行切开髂外动脉血管鞘;(2)游离髂外动脉外侧壁及后壁至腰大肌表面,切除髂外淋巴组织及腹股沟最上淋巴结(Cloquet淋巴结)(图2);(3)游离髂外动脉内侧壁,于髂外静脉后方紧贴盆壁游离淋巴组织至闭孔外侧壁(图3);(4)游离髂外静脉周围淋巴组织;(5)沿闭孔外侧壁向内游离闭孔及骶前淋巴结,用超声刀切断盆底静脉分支,将淋巴组织于髂内静脉及其髂内静脉分支推向膀胱侧壁,充分显露闭孔神经,避免其损伤;(6)整体取出除髂外淋巴结以外的整块盆腔淋巴结及膀胱。
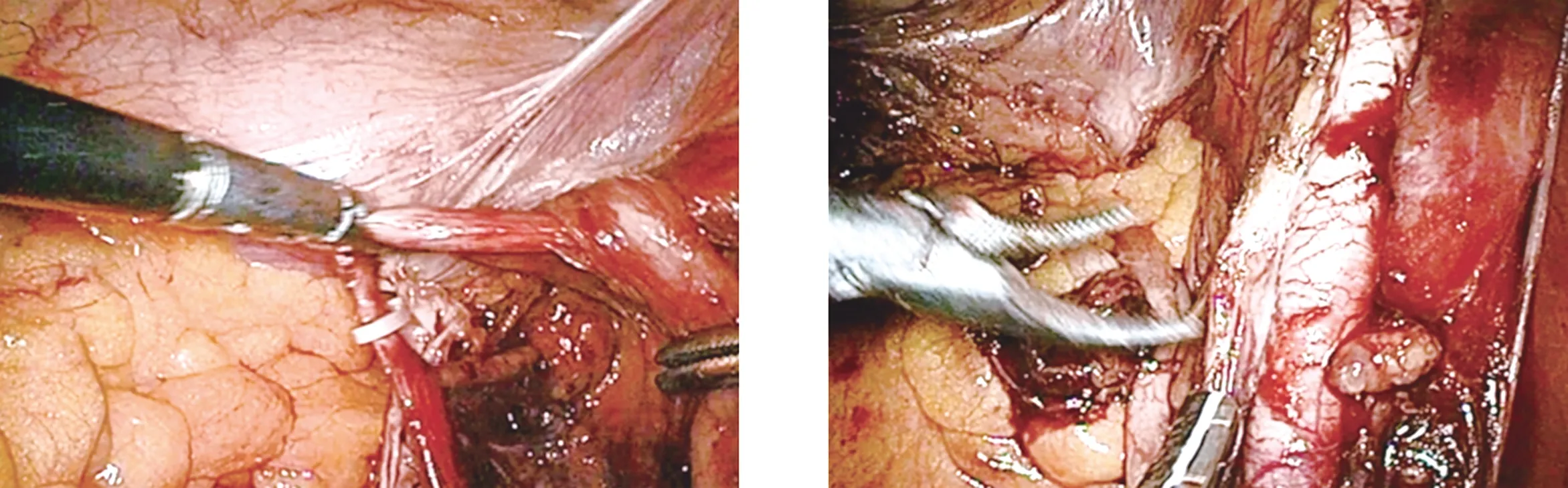
图1 处理髂内动脉分支,阻断膀胱、前列腺主要动脉供血 图2 游离髂外动脉外侧壁及后壁至腰大肌表面,切除髂外淋巴组织
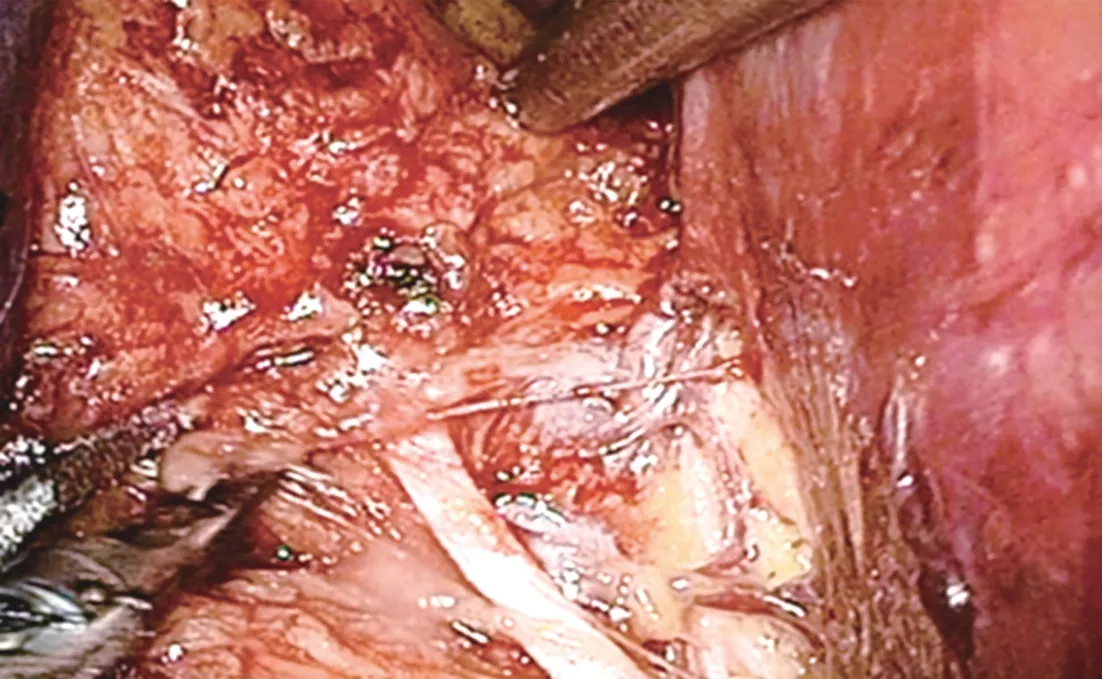
图3 紧贴盆壁游离淋巴组织至闭孔外侧壁
1.3 观察指标 (1)手术时间:记录两组盆腔淋巴结清扫时间、膀胱全切时间。(2)淋巴结清扫情况:记录两组髂内、髂外、髂前、闭孔、骶前与腹膜后淋巴结数量。(3)并发症发生情况:记录两组患者需要输血、静脉损伤及淋巴瘘延迟拔引流管等并发症。
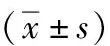
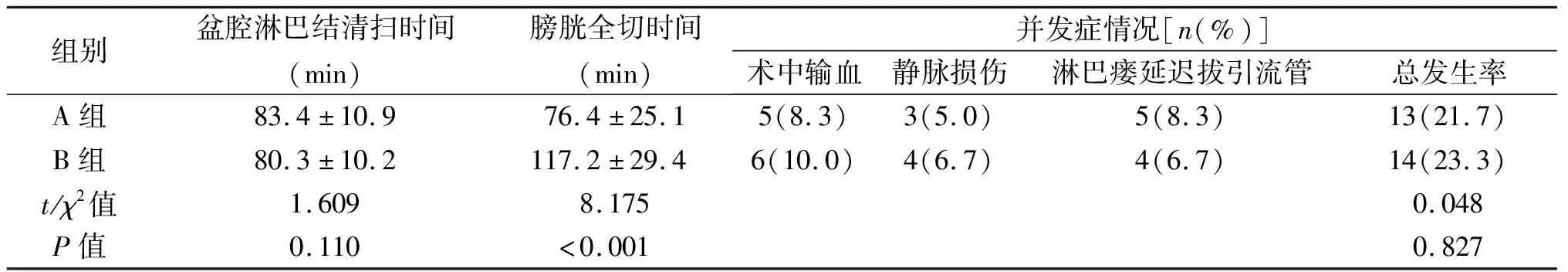
2 结 果
两组盆腔淋巴结清扫时间差异无统计学意义,A组膀胱全切时间短于B组,差异有统计学意义(P<0.05),见表2。A组髂内、髂前、骶前淋巴结清扫数量少于B组,差异有统计学意义(P<0.05);两组髂外、闭孔、腹膜后淋巴结清扫数量差异无统计学意义(P>0.05);A组淋巴结清扫总数少于B组,差异有统计学意义(P<0.05);见表3。A组并发症总发生率[21.7%(13/60)vs.23.3%(14/60)]与B组相比差异无统计学意义(P>0.05),见表2。
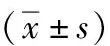
组别盆腔淋巴结清扫时间(min)膀胱全切时间(min)并发症情况[n(%)]术中输血静脉损伤淋巴瘘延迟拔引流管总发生率A组83.4±10.976.4±25.15(8.3)3(5.0)5(8.3)13(21.7)B组80.3±10.2117.2±29.46(10.0)4(6.7)4(6.7)14(23.3)t/χ2值1.6098.1750.048P值0.110<0.0010.827
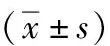
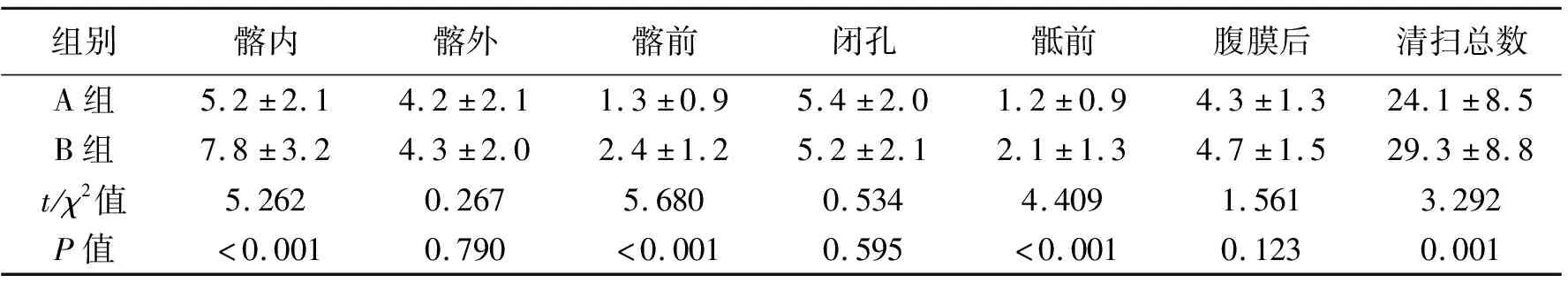
组别髂内髂外髂前闭孔骶前腹膜后清扫总数A组5.2±2.14.2±2.11.3±0.95.4±2.01.2±0.94.3±1.324.1±8.5B组7.8±3.24.3±2.02.4±1.25.2±2.12.1±1.34.7±1.529.3±8.8t/χ2值5.2620.2675.6800.5344.4091.5613.292P值<0.0010.790<0.0010.595<0.0010.1230.001
3 讨 论
根治性膀胱全切术是浸润性膀胱癌的首选治疗手段,近年,随着微创技术在临床上的推广,腹腔镜下行膀胱全切术已逐渐成为主流方式[4-5]。然而,由于浸润性膀胱癌常发生淋巴转移,这导致术后肿瘤复发率上升,因此预防淋巴转移对患者预后的改善尤为关键[6]。盆腔淋巴结清扫术是目前预防淋巴转移的有效手段,可清除盆腔内淋巴结,提高治疗效果,延长患者生存时间,但有关其实施时间仍存在一定争议[7-8]。膀胱全切前行淋巴清扫能更好地暴露解剖层面,但盆腔内操作空间较小,对于膀胱体积较大的患者,操作尤为困难;膀胱全切后行淋巴清扫,手术操作空间更大,但耗时较长[9-10]。
本研究结果显示,两组盆腔淋巴结清扫时间差异无统计学意义,但A组膀胱全切时间短于B组。由于腹腔镜淋巴结清扫术要求操作精细,一方面要保证淋巴结的彻底清除,另一方面要避免对盆腔内脏器造成损伤,因此清扫过程较缓慢,所用时间也很难缩短。但在淋巴结清扫结束后行膀胱全切术时,由于患者盆腔内的神经、血管等结构已骨骼化,膀胱血管蒂更易离断,因此膀胱全切所用时间更短,且能明显减少术中出血量[11-12]。研究认为[13],先行淋巴结清扫,必要时对所得标本进行病理检查,有助于术者更直接地掌握患者的肿瘤分期,行膀胱全切术时做到心中有数[9]。本研究结果显示,A组髂内、髂前及骶前淋巴结清扫数量少于B组,两组髂外、闭孔、腹膜后淋巴结清扫数量差异无统计学意义,A组淋巴结清扫总数少于B组。淋巴结清扫术切除的淋巴结数量与预后密切相关,一般认为,每例患者盆腔淋巴结切除数量超过15枚时,对肿瘤分期、预后评估及生存率已经足够;盆腔淋巴结清扫数量超过20枚时,表明淋巴结清扫已较为细致。本研究中两组淋巴结清扫数量均超过20枚[14]。通过分区比较可发现,髂内、髂前、骶前是发生差异的主要区域,考虑原因可能是膀胱全切术前盆腔内有输尿管、膀胱等器官干扰,导致清扫较困难,因此膀胱全切术后应对这些区域进行细致核查并补充清扫。本研究结果还表明,A组并发症总发生率[21.7%(13/60)vs.23.3%(14/60)]与B组相比差异无统计学意义。表明手术操作步骤并不会导致术后并发症的差异,而主要得益于腹腔镜下操作的精细化[15]。笔者认为,淋巴结清扫术在血管丰富的盆腔内实施需要在明确解剖学标志的前提下,注意对血管的分离,一旦发生出血应用纱布进行压迫止血,不在视野不清的条件下进行电凝、清扫操作。
标准淋巴结清扫临床有三种术式:局限性、标准及扩大淋巴结清扫术。三者应用范围及切除数量不同。本研究结果表明,在不增加手术难度、引起手术并发症的基础上,清扫淋巴结数量应根据预后最佳的手术方案进行。患者身体情况不允许时,可考虑局限淋巴结清扫术。如估计有髂总或骶前的淋巴结转移,则淋巴结清扫扩大至腹主动脉分叉水平。腹腔镜下淋巴结清扫术复杂精细。既要保证清扫彻底,又要尽量避免对盆腔脏器的损伤,以减少术后淋巴瘘的发生风险。本研究中,膀胱全切除前行淋巴结清扫术,能缩短手术时间,利于患者预后。研究表明,淋巴结清扫术后行膀胱全切术时,由于盆腔内血管、神经结构已经骨骼化,更容易控制血管蒂的离断。淋巴结清扫术中常见并发症分为髂血管、闭孔神经损伤与输尿管损伤。术后常见淋巴瘘、淋巴囊肿、肠梗阻、盆腔血肿、下肢深静脉血栓形成及肺栓塞等。本研究中,两组并发症发生率差异无统计学意义,提示精细操作是控制术后并发症的关键。由于淋巴结清扫术主要在血管丰富的盆腔内进行,术者应清楚局部的解剖结构,做到小心分离。偶见出血,可置入纱布压迫止血,或用吸引器吸除,彻底暴露手术视野。
综上所述,腹腔镜下膀胱全切术前行盆腔淋巴结清扫术手术时间较短,但淋巴结清扫数量较少,因此在膀胱切除后需再次对髂前、髂内淋巴结进行核查并补充清扫。

