Klotho蛋白在肾缺血再灌注损伤中的作用
任小山 综述 杨 立 审校
Klotho基因、蛋白及功能简介
Klotho基因是1997年由日本学者Kuro-o等[1]在研究自发型高血压小鼠时发现,以希腊神话中掌控人类生命线的女神Klotho命名,该基因定位于人类第13号染色体上,含5个外显子和4个内含子,全长50 kb。Klotho基因的缺陷加快实验小鼠衰老,早期出现性功能减退、皮肤萎缩、骨质疏松等。
Klotho基因编码的Klotho蛋白主要存在于循环和尿液[2]。该蛋白有膜结合型和分泌型(即αKlotho)两种形式。前者由胞外区域 (约980个氨基酸残基的氨基末端)、跨膜区域和胞内区域 (11个氨基酸残基的羧基端) 构成,其中胞外区域含有2个重复的440个氨基酸残基序列,命名为KL1和KL2。2个重 复 序 列 的 连 接 区 域 为Lys-Lys-Arg-Lys保守序列,是蛋白酶裂解的潜在位点[3](图1)。而分泌型Klotho被选择性剪切释放到胞外,其具有糖苷酶活性,抑制氧化应激,又称为可溶性Klotho[4]。可溶性Klotho在肾脏高表达且优先表达于肾脏,主要在远曲小管分泌产生,有多种的生物学效应,包括细胞保护、抗氧化及抗纤维化[5]。

图1 Klotho蛋白基本结构[6]膜型Klotho蛋白为单向跨膜分子,其基本结构由细胞外功能区域、跨膜区域、胞内区域、连接区域、单序列区组成;分泌型 Klotho 蛋白来源:大部分由解聚素-金属蛋白酶水解膜型Klotho蛋白形成,小部分由 Klotho 基因选择性表达合成
Klotho蛋白与肾缺血再灌注损伤(RIRI)
RIRI指在肾脏缺血的基础上再次恢复血流,组织损伤反而加重的病理现象,其引起的急性肾损伤(AKI)在临床的死亡率很高。发生机制复杂且尚不明确,目前认为与缺血再灌注后的炎症、氧化应激、细胞内钙超载、细胞凋亡等有关。上述损伤机制并非孤立存在,其间存在显著交互作用,共同作用于上游载体“内皮细胞”[7]。内皮细胞是组织缺血再灌注损伤(IRI)发生的前沿细胞,其自身分泌的多种细胞因子亦参与RIRI过程[8]。内皮功能损伤及微循环紊乱是IRI的重要标志和发生基础[9]。
一项研究通过利用H2O2诱导人脐静脉内皮细胞(HUVEC)构建血管内皮细胞氧化损伤模型,发现Klotho蛋白显著提高H2O2氧化损伤后HUVEC存活率,首次证明Klotho蛋白能够减轻血管内皮细胞损伤,其可能机制是Klotho蛋白维持HUVEC细胞完整性并有助于HUVEC抗氧化能力的恢复和抑制HUVEC产生活性氧(ROS)[10]。前人相关研究亦表明 Klotho 蛋白可以缓解HUVEC的凋亡和衰老[11]。Maekawa等[12]已经证实Klotho可能通过丝裂原活化激酶途径保护内皮细胞免于凋亡。有学者通过腺病毒载体将Klotho转染至小鼠体内后发现其明显改善内皮细胞功能[13]。在肾脏中,Klotho亦可通过激活自噬减轻缺血性损伤,减轻肾纤维化,并阻止AKI进展为慢性肾脏病(CKD)[14-15]。 Castellano等[16]通过对尸体捐献者肾脏中的分析表明,Klotho在植入前肾组织检查中显著表达,然而,与早期移植功能恢复患者相比,移植物功能延迟恢复的患者Klotho下调[16]。 Cho等[17]在AKI和CKD的早期阶段观察到血清和尿Klotho水平降低,而晚期阶段逐渐下降。既往有学者用携带Klotho基因的腺病毒转染骨髓间充质干细胞(BMSCs),发现转染Klotho腺病毒的BMSCs更好地缓解RIRI[18]。
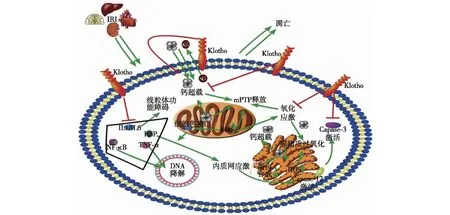
图2 Klotho蛋白与RIRI相关机制[6]RIRI:肾缺血再灌注损伤;IL:白细胞介素;NF-κB:核因子κB;ROS:活性氧;RIRI致细胞内皮损伤,诱发炎症、钙超载、过氧化、线粒体功能障碍及内质网应激,促成一系列胞内胞外反应,导致细胞凋亡,Klotho 蛋白可抑制炎症反应、钙超载、过氧化,减少细胞凋亡,从而保护肾脏结构及功能
Klotho蛋白与炎症炎症反应是缺血再灌注的关键,是一切损伤的开始。组织缺血再灌注可引起中性粒细胞激活并释放炎症细胞因子,细胞因子介导组织损伤、坏死,从而活化炎症细胞释放更多炎症细胞因子。已经有研究表明,Klotho基因编码的Klotho蛋白具有抑制炎症反应等作用,其机制可能与Klotho增加心肌HSP70水平,抑制核因子κB(NF-κB)活化(图2),减少老年内毒素血症小鼠的细胞因子水平和改善的心脏功能有关[19]。同时,相关文献报道,炎性细胞因子TWEAK和TNF通过NF-κB信号通路减少肾脏中Klotho基因表达[20]。Hu等[21]学者研究证实,细胞内Klotho可能参与ATP依赖性RNA解旋酶DDX58(也称为视黄酸诱导基因1蛋白)介导的炎症抑制途径发挥效应。
Klotho蛋白与细胞内钙超载钙离子存在于胞内饰各种角色,可作为第二信使、代谢调节因子、膜稳定剂参与细胞膜生物电和胞内生化、亦参与修复基因转录核蛋白磷酸化和细胞凋亡,在细胞正常机能活动中起重要作用,RIRI后,胞外钙离子大量内流引发钙超载,因过氧化产物持续损伤组织和含巯基的蛋白质和酶,进一步加重钙超载。胞内钙超载则激活钙敏蛋白水解酶、磷脂酶等,使胞膜水解、破坏线粒体正常结构,从而导致ATP产量减少、干扰体内细胞中钙稳态。可能原因是维生素D代谢改变,但存在其他可能性,在肾脏,Klotho增强型小鼠表现出瞬时感受电位V5(TRPV5)的表达增加和钠/钙交换剂的表达降低,进而有利于维持体内钙稳态[22](图2)。有报道提出Klotho可作为辅助因子(体内形成FGF-23 -Klotho轴)调节肾脏钙、磷和维生素D代谢[23-24]。但可溶性Klotho作为一种内分泌因子,具有多种肾脏和肾外效应,亦可独立于FGF-23起作用[25]。Hu等[26]研究表明Klotho通过与肾脏,骨骼,肠道和甲状旁腺中的其他“钙磷酸化调节”激素[如PTH,FGF-23和1,25(OH)2D3]相互作用参与矿物质稳态调节,从而保护肾脏结构和功能。
Klotho蛋白与氧化应激氧化应激是指机体ROS产生过多和(或)抗氧化能力下降,使得ROS大量蓄积而引起的损伤。是目前公认导致缺血再灌损伤的重要机制,ROS、氧自由基等破坏细胞膜、细胞核,激发或加重损伤。有文献提及,Klotho可缓解RIRI,可能通过诱导锰超氧化物歧化酶(MnSOD)表达,即Klotho通过增加一种上调MnSOD的转录因子叉头框蛋白O亚家族3a(FOXO3a) 的磷酸化发挥作用[27]。 Qian等[28]提到Klotho保护来自IRI的管状上皮细胞及其抗坏死作用可能与氧化应激抑制有关(图2)。Drew等[29]研究表明尽管已知低溶解性Klotho水平与氧化应激之间的关联,但关于可溶性Klotho水平与肾功能变化之间的纵向关联的信息仍很少。
Klotho蛋白与细胞凋亡RIRI发生机制十分复杂,其中肾小管上皮细胞凋亡在RIRI诱导的细胞凋亡中起重要作用,是导致肾功能衰竭的重要原因之一[30]。Alexander等[22]研究证实,Klotho通过促进热休克蛋白70(HSP-70)表达减少实验性急性缺血性肾脏的细胞凋亡且增加对氧化应激和细胞凋亡的抵抗力。在心肌细胞中,Klotho通过下调内质网应激抑制小鼠心肌细胞凋亡引起的心脏损伤[31](图2)。 Qian等[28]发现,Klotho可通过靶向抑制肾缺血再灌注氧化反应,从而减少肾脏上皮细胞坏死性凋亡。
前景与展望
近年来,肾移植术后RIRI已成为影响受者预后及术后长期免疫抑制剂疗效的关键因素。Klotho基因编码的Klotho蛋白高表达于肾小管上皮细胞,且具有对抗氧化应激、调节体内钙磷离子代谢、调节细胞凋亡等多种生理功能,通过上调Klotho基因来增加其编码的蛋白在肾脏上皮细胞中产量,从而保护或延缓肾移植术后IRI,同时对于急性或慢性肾病患者,补充外源性Klotho和(或)调节内源性Klotho生成可能是一种可行的治疗策略,有望为今后肾移植工作及急慢性肾脏病的治疗提供新思路。

