隐丹参酮对顺铂耐药肺癌细胞磷酸戊糖途径相关蛋白的影响及机制探讨
谭国耀,洪伟鹏,张蕾,曹霖,王黛菲,金晶
(中山大学药学院,广东 广州 510006)
肺癌是一种起源于支气管黏膜或腺体的恶性肿瘤,其发病率和死亡率居高不下,且增长迅速,对人类的生存和健康构成巨大威胁。虽然目前肺癌的检测和治疗手段在不断进步,但是据统计,患者的5年生存率仍然不足15%[1]。目前,肺癌的常用治疗手段包括化疗、放疗、手术和分子靶向治疗,其中以顺铂等为代表的传统化疗药物仍然是治疗肺癌各个阶段的重要药物[2]。但是随着患者疾病的进展,患者往往会对这些化疗药物产生一定的耐药性。因此,寻找有效的逆转耐药、增加患者对化疗药物敏感性的治疗方式显得非常重要。
磷酸戊糖途径(pentose phosphate pathway,PPP)是葡萄糖代谢的主要途径之一,由氧化分支和非氧化分支构成,主要产物包括NADPH、磷酸核糖以及其他四碳、五碳、七碳化合物,影响细胞的脂质、核酸的合成以及其他代谢途径,是一条具有多功能的重要代谢途径[3]。大量的研究表明,多数肿瘤细胞中PPP的活性异常,PPP的异常改变直接影响了肿瘤细胞的存活、增殖和衰老。除此之外,研究还发现PPP受到包括癌基因蛋白、肿瘤抑制因子和细胞内代谢物等多种因素的影响[4]。因此PPP对于肿瘤的发生发展具有非常重要的作用。
隐丹参酮(cryptotanshinone,CTS)是传统中药丹参中的一种脂溶性的有效成分,最初因其抗心血管疾病的功效引起研究者的关注。而近年来,关于CTS抗肿瘤的研究逐渐增多,大量研究发现,CTS可以通过引起癌细胞周期阻滞、抑制癌细胞增殖、诱导癌细胞凋亡和抑制肿瘤血管生成和迁移等机制来发挥抗肿瘤效果。因此,CTS在抗癌上有着广阔的应用前景。
本研究初步探讨CTS对A549/CDDP细胞PPP相关蛋白表达的影响及其可能的机制,为进一步开展CTS的抗肿瘤作用机制研究提供思路,并为CTS用于肺癌治疗提供理论基础和实验依据。
1 材料与方法
1.1 药物与试剂 CTS(中国药品生物制品检定所);胎牛血清(美国Gibco公司);青霉素链霉素溶液、DMEM培养基、0.25%胰蛋白酶-EDTA(美国Hyclone公司);CCK-8试剂盒(日本同仁化学研究所);Trizol试剂、逆转录、SYBR green试剂(日本Takara公司);RIPA细胞裂解液、BCA蛋白浓度检测试剂盒(美国Thermo Fisher公司);ECL化学发光液(北京Engreen公司);兔抗G6PD、PGD、TKT、GAPDH抗体(美国Cell Signaling Technology公司);兔抗TALDO1(上海生工生物工程股份有限公司);兔抗NRF2抗体(美国Abcam公司)。
1.2 细胞 人肺癌A549细胞和顺铂耐药A549/CDDP细胞由中国医学科学院中国协和医科大学肿瘤研究所馈赠。
1.3 仪器 二氧化碳培养箱(美国Thermo Fisher公司);低温高速离心机(德国Eppendorf公司);PCR仪(德国Eppendorf公司);实时荧光定量PCR系统(美国Applied Biosystems公司);电泳、电转系统(美国Bio-Rad公司);ImageQuant LAS 4000曝光成像仪(美国General Electric公司);多功能酶标仪(美国Thermo Fisher公司)。
1.4 方法
1.4.1 A549细胞和A549/CDDP细胞的培养 A549细胞和A549/CDDP细胞接种于含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养、传代。当细胞处于对数生长期时,可用于实验。
1.4.2 CCK-8法测细胞存活率 将处于对数生长期的A549细胞和A549/DDP细胞分别接种于96孔板中,每孔100 μL,培养24 h。给药分组如下:空白对照组,50 μmol·L-1CDDP组,2.5 μmol·L-1CTS组,2.5 μmol·L-1CTS合用50 μmol·L-1CDDP组,每组设4个复孔,每孔加入100 μL。用不含血清的DMEM培养基稀释药物,使其终浓度分别为上述分组所示,空白对照组为含相同浓度DMSO的DMEM培养基。培养48 h后,将孔中液体吸出,另设4个空白复孔,每孔加入100 μL含10% CCK-8的无血清DMEM培养基,培养1 h后,置于摇床上低速震荡30 s,使孔内颜色分布均匀。检测波长为450 nm的吸光度值(optical density,OD),细胞存活率=(实验组OD - 空白孔OD)/(对照组OD-空白孔OD)×100%。
1.4.3 qPCR检测mRNA表达 取处于对数生长期的A549细胞和A549/CDDP细胞接种于12孔板,待细胞融合度为90%左右终止细胞培养。分别提取两种细胞的总RNA,按照说明书的步骤逆转录成cDNA,以cDNA为模板,qPCR检测PPP相关的G6PD、PGD、TKT、TALDO1的mRNA表达水平,以ACTB作为内参。引物序列见表1。
1.4.4 Western blot检测蛋白表达 A549细胞和A549/CDDP细胞不经药物处理或经不同浓度CTS处理48 h后,终止培养。弃去培养基,PBS洗涤2次,弃去残余的PBS,每孔加入100 μL裂解液,置于冰上裂解30 min,刮取孔内细胞及裂解液收集于1.5 mL EP管中,超声10 s,于4 ℃ 16 000 g离心20 min,获得细胞总蛋白。进行蛋白定量后,加入适量的5×SDS-PAGE上样缓冲液,沸水浴变性10 min。按每孔25 μg总蛋白计算上样量,进行电泳操作,电泳分离后,电转至PVDF膜上,用5%脱脂牛奶室温封闭1 h,加入一抗G6PD、PGD、TKT、TALDO1、NRF2、AKT和GAPDH ,4 ℃孵育过夜,TBST洗膜3次,每次7 min,加入二抗,室温孵育1 h,TBST洗膜3次,每次7 min,显影。使用Image J软件分析结果。

表1 qPCR引物序列

2 结果
2.1 A549细胞和A549/CDDP细胞PPP相关基因mRNA及蛋白表达水平的差异 如图1所示,与A549细胞相比,顺铂耐药A549/CDDP细胞G6PD、GPD、TKT和TALDO1的mRNA水平明显升高(P<0.001);而如图2所示,G6PD(P<0.001)、PGD(P<0.001)和TALDO1(P<0.05)的蛋白表达水平明显上升,表明两种细胞在PPP代谢上存在着差异,A549/CDDP细胞PPP代谢可能更加旺盛。
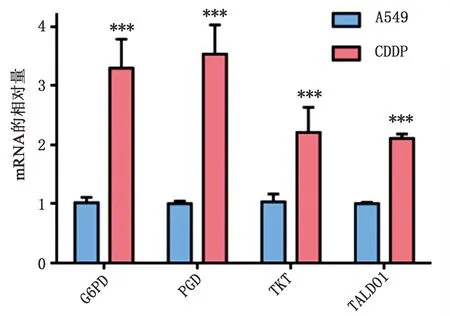
图1 A549细胞和A549/CDDP细胞PPP相关基因mRNA表达水平

图2 A549细胞和A549/CDDP细胞PPP相关蛋白表达水平
2.2 CTS对顺铂处理A549/CDDP细胞后细胞存活率的影响 如图3所示,CTS能够明显降低顺铂处理A549/CDDP细胞后细胞的存活率(P<0.05),而对顺铂处理A549细胞后的存活率影响不明显,表明CTS能增加A549/CDDP细胞对顺铂的敏感性,从而增加顺铂对A549/CDDP细胞的杀伤效果。
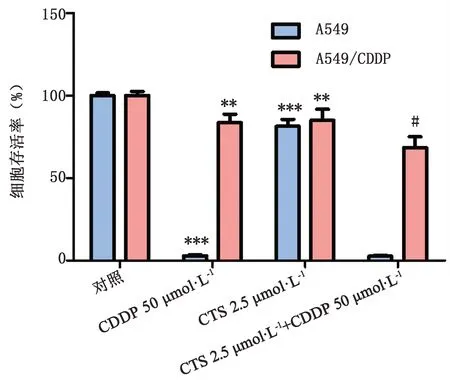
图3 CTS对顺铂处理后细胞存活率的影响
2.3 CTS对A549/CDDP细胞PPP相关蛋白表达水平的影响 如图4所示,CTS处理后,A549/CDDP细胞内TKT蛋白表达水平显著下调(P<0.001),且呈现出一定的剂量依赖性,而G6PD、PGD和TALDO1蛋白表达水平变化不明显,表明CTS对A549/CDDP细胞中PPP相关蛋白TKT的表达具有一定的抑制作用。

图4 CTS对A549/CDDP细胞PPP相关蛋白表达的影响
2.4 CTS对A549/CDDP细胞AKT、NRF2蛋白表达水平的影响 如图5所示,CTS能够明显下调A549/CDDP细胞AKT的蛋白表达水平(P<0.05),且这种调节作用具有一定的剂量依赖性;此外,当CTS浓度超过2.5 μmol·L-1时,能够明显下调A549/CDDP细胞NRF2的蛋白表达水平(P<0.001)。

图5 CTS对A549/CDDP细胞AKT、NRF2蛋白表达的影响
3 讨论
磷酸戊糖途径,也称为磷酸葡萄糖酸途径,是葡萄糖分解代谢的主要途径之一。大量的研究表明,PPP对肿瘤细胞生长增殖具有重要的调控作用[5]。PPP主要包含氧化分支和非氧化分支,G6PD是葡萄糖进入PPP氧化分支中的第一个限速酶,也是控制PPP速率和活性的关键酶,PGD则催化G6PD的催化产物氧化脱羧,生成核酮糖-5-磷酸进入非氧化分支。而TKT和TALDO1是非氧化分支中的两个关键酶,调节PPP两个分支的活性和速率平衡[6]。而研究发现,顺铂耐药A549/CDDP细胞中上述PPP相关蛋白表达升高,提示顺铂耐药的产生可能与PPP相关蛋白的表达升高有关。
CTS是传统中药丹参中的一种有效成分,在抗炎、抗氧化和抗心血管疾病中均有较好的药理作用。在肿瘤治疗方面,研究发现,CTS可以通过上游靶点影响细胞增殖,引起周期阻滞或者诱导凋亡[7-8];另外,CTS可以抑制肿瘤血管的生成并抑制肿瘤的迁移[9-10]。除此之外,CTS在逆转耐药或者抗癌药物的增敏上也具有一定的作用,研究发现,CTS可以通过下调肿瘤细胞中P-gp的表达,是细胞内的药物外排减弱,从而增强化疗药物如阿霉素等的治疗效果,有效逆转肿瘤细胞株的耐药性[11]。本研究发现,CTS可以增加顺铂耐药A549/CDDP细胞对顺铂的敏感性,从而使细胞的存活率降低。
近年来的研究表明,多种致癌途径参与了癌细胞代谢调控。PI3K/AKT通路调控细胞生长和生存,NRF2是维持氧化还原稳态的关键调控因子,对包括侵袭性增殖在内的癌症的恶性表型的维持具有重要的调控作用。研究表明,活跃的PI3K/AKT通路增强NRF2的核累积,激活PPP相关基因的表达,促进细胞代谢活动从而促进癌细胞的增殖[12]。此外,AKT还能通过磷酸化TKT,显著增强其酶活性,增强PPP非氧化分支代谢PPP,从而对癌细胞的生长具有非常重要的作用[13]。研究发现,CTS可以显著下调A549/CDDP细胞中TKT的蛋白表达水平,同时CTS还可以显著下调A549/CDDP细胞中AKT和NRF2的蛋白表达水平,提示CTS很有可能通过下调AKT和NRF的表达,从而抑制PPP相关蛋白TKT的表达,抑制耐药细胞相关的代谢途径,从而使耐药细胞对顺铂的敏感性增加,从而对耐药细胞的生长和增殖起到抑制作用。
综上所述,CTS能够增加顺铂耐药A549/CDDP细胞对顺铂的敏感性,其机制可能通过抑制AKT和NRF2的表达从而抑制PPP相关蛋白TKT的表达,抑制细胞的PPP代谢,从而增加细胞对顺铂的敏感性,使细胞生长受到抑制。本研究为开展CTS的抗肿瘤相关机制研究提供思路,并为CTS用于肺癌治疗提供理论基础和实验依据。

