FKS 家族基因对酿酒酵母压力耐性的影响
杨 歌,王金晶,李 佳,郑飞云,刘春凤,李永仙,钮成拓,李 崎*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 酿酒科学与工程研究室,江苏无锡 214122)
酿酒酵母与人类的生活息息相关,并被誉为工业上最重要的微生物之一,它在发酵、烘焙、酿造、药物和化工生产中有着重要的作用,尤其在啤酒行业,酿酒酵母对啤酒的质量起决定性的作用[1-2]。酿酒酵母在发酵过程中受到来自发酵环境和工艺操作的胁迫,酵母细胞需要应对高渗透压、乙醇的积累和营养物质匮乏等压力[3-4],这些压力可能降低酿酒酵母酵母活性、促进细胞的自溶甚至死亡[5]。酿酒酵母的自溶对啤酒的质量包括啤酒的风味和品质有严重的负面影响[6-7]。因此,提高酿酒酵母的压力耐受性对发酵行业、工业等都存在重大意义。
酵母细胞壁作为保护细胞的第一层屏障,主要的作用是维持内部渗透压、保护细胞免受机械压力的破坏以及维持酵母的细胞形态等[8-9]。酵母细胞壁是双层网状结构,主要由电子透明的内层和电子不透明的外层构成,几丁质和β-葡聚糖构成内层物质,甘露聚糖构成外层物质[10-11]。其中β-葡聚糖由1,3-β-葡聚糖(80%~90%)和1,3-β-葡聚糖(10%~20%)构成,是细胞壁结构重要的基础单元。1,3-β-葡聚糖螺旋结构使细胞壁灵活多变、一定的弹性以及较强的拉伸强度[12]。催化合成1,3-β-葡聚糖最主要的酶是1,3-β-葡聚糖合成酶(1,3-β-glucan synthase,GS)[13]。GS 中两个相似度为88%的催化亚基是Fks1p、Fksp2 分别由FKS1 和FKS2 催化合成,Fks3p 与Fks1p 有56%的同源性[14-15]。研究人员通过过表达FKS1 基因,发现突变菌株的耐受性和抗自溶能力均高于原始菌株[16]。另有研究报道FKS3 基因敲除菌株所产生的芽孢对温度、乙醇等的抗性发生改变,Fks3p 会影响芽孢的生殖,但是其作用机制尚不清楚[17-18]。FKS 家族基因对细胞壁的代谢合成及细胞耐受能力有一定协调的作用。
本研究通过同源重组的方法,构建了三株FKS家族基因缺陷菌株,对比了重组菌株和原始菌株环境抗逆性、酵母细胞活性、合成乙醇能力等,为研究酿酒酵母耐受性及选育优良耐受性的酿酒酵母提供理论基础。
1 材料与方法
1.1 材料
1.1.1 本研究所用质粒及菌株 本研究所用的质粒和菌株如表1 所示。

表1 本研究所用所用质粒和菌株Table 1 Strains and plasmids used in this study
1.1.2 培养基及试剂
1)LB 培养基:氯化钠10 g/L,酵母提取物5 g/L,胰蛋白胨10 g/L。筛选阳性转化子时加入Amp 150 μg/mL,固体培养基添加琼脂量为18~20 g/L。
2)YPD 培养基:葡萄糖20 g/L,酵母提取物10 g/L 胰蛋白胨20 g/L。筛选转化子时需添加G418 至200 μg/mL,固体培养基添加琼脂量为18~20 g/L。
3)环境胁迫抗性平板:在YPD 平板上填加无水乙醇至8%浓度、NaCl 至0.4 mol/L 浓度。
4)麦汁培养基:将经过糖化工艺的麦汁过滤后煮沸60~80 min。并添加酒花,添加量为0.3 g/L,酒花分三次加入,刚煮沸时加入1/2,煮沸30 min 添加1/4,煮沸前10 min 添加1/4。
5)柠檬酸盐缓冲液:柠檬酸10.5 g/L,柠檬酸三钠14.7 g/L,用1 mol/L 柠檬酸溶液调至pH=4.0。
Amipicillin、IPTG Dioxane Free(IPTG)与Magenta-Gal(X-Gal)购自生工生物(上海)股份有限公司;质粒提取试剂盒、胶回收试剂盒与胶纯化试剂盒均购自美国欧米茄公司;克隆载体pMD 19T-simple、T4DNA 连接酶、感受态细胞制作试剂盒均购自TaKaRa 公司;G418 购自TIANGEN 生化科技有限公司;其他实验用试剂均购自Sinopharm Chemical Reagent Co.Ltd.公司。
1.2 实验方法
1.2.1 基因克隆及质粒的构建 根据pUG6 质粒的序列以及SGD 公布的FKS家族基因序列,引物序列如表2 所示。以pUG6 质粒为模板,表2 所示序列为引物,通过PCR 分别扩增含有KanMX 基因和FKS1、FKS2、FKS3 同源臂的目的基因片段(中断盒),将PCR 产物回收纯化后的与载体pMD 19Tsimple TA 连接得到重组质粒。重组质粒构建流程如图1 所示,将重组质粒分别转入大肠杆菌JM109 中保存。

表2 敲除盒扩增引物Table 2 Primers for amplification of disruption cassettes
将得到重组质粒按照醋酸锂转化法转化到原始菌株W303 中,为能达到高效的同源重组,设计引物中两个核苷酸序列之间同源序列为50 bp 左右[20]。转化后先涂布到YPD 平板上,在28 ℃条件下,培养至肉眼可见菌菌落,采用平板影印法影印到含有200 μg/mL G418 的平板上,对长出的菌落进行验证。验证所需引物如表3 所示。
1.2.2 酵母生长性能分析 将原始菌株和重组菌株活化后以转接至200 mL YPD 液体培养基中培养中,接种后的菌浓约为106个/mL。28 ℃180 r/min掊养。在此培养过程中每2 h 取一次样品,吸光光度法测定菌液在560 nm 下的吸光值,并绘制生长曲线。
1.2.3 酵母细胞壁多糖分析 培养收集酵母泥5 g,加入100 mL 醋酸锂-SDS 溶液(醋酸锂50 mmol/L,SDS 0.034 mol/L)溶液,在70℃水浴温育10 min,每隔2.5 min 将三角瓶内的液体摇匀。将提取液在5 000 r/min 下离心10 min,除去菌体碎片。将上清液收集后,用1 倍体积的95%乙醇在4℃沉淀多糖[21]。加入75 μL 72%(w:v)浓硫酸,20~25 ℃放置3 h,中间间隔一定时间混合体系。3 h 后,加入950 μL 纯水稀释浓硫酸至1 mol/L 硫酸,准确沸水浴4 h。反应结束后,滴加饱和Ba(OH)2至中性,4 ℃静止过夜,第2 天测定溶液pH 在6~9 之间可进行下一步反应。离心去除沉淀,调整体积至20 mL[21]。将细胞壁酸解液稀释至适合浓度,经0.45 μm 滤膜过滤后上高效离子色谱进行分离检测。

图1 重组质粒构建示意图Fig.1 Construction of the recombinant plasmid

表3 重组菌验证引物Table 3 Primers for verified transformants
1.2.4 酵母抗胁迫能力分析 抗性平板分析:对原始菌株和重组菌株的各项耐压性能的评价是根据菌体在不同压力YPD 平板上的生长情况。将菌种活化后,取5 mL 菌液转移到30 mL YPD 培养基中,饥饿培养则接入相同体积的无菌水中培养6 h。收集菌体并用无菌水洗涤两次,用血球计数板镜检计数,根据稀释倍数比例,调节菌体浓度为107个/mL,10 倍梯度稀释,依次取3.5 μL 菌液点种在含有8%(v/v)乙醇、0.4 mol/L NaCl 的抗性平板上,培养2~3 d,观察生长情况。
1.2.5 液体发酵抗性分析 在斜面上取一环菌接种于10 mL 麦汁培养基中,活化36 h,在9 mL 麦汁试管接入1 mL 菌液,活化48 h,将全部菌液接入70 mL三角瓶中于培养48 h,所有活化温度都为28 ℃。离心收集酵母泥,按照0.5%(w/v)的比例接入300 mL厌氧瓶中于28 ℃下发酵,在发酵第3,7 d 和12 d分别取样。
1)测定酵母死亡率,取得的样品与亚甲基紫染色液混合,染色5 min,将混合液滴在血球计数板上镜检计数。红色为死亡细胞,无色为活细胞,计数并计算酵母死亡率。酵母死亡率计算公式如下
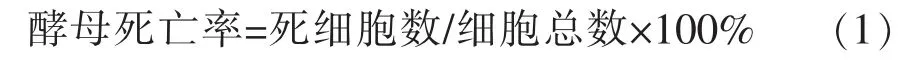
2)将收集的发酵液离心收集菌体,2.5%的戊二醛固定后,用扫描电镜(SEM)进行细胞显微学在6 000 的倍数下观察细胞形太。
3)发酵结束后,测定发酵液酒精度。
2 结果与分析
2.1 FKS1、FKS2 和FKS3 基因缺失型菌株的构建
将该基因中断盒转化入原始菌株W303,通过同源重组法用KanMX 替换FKS1 基因,从而敲除FKS1 基因。将得到的转化子提取基因组,进行PCR验证,结果如图2 所示,图2(a)设计引物是FKS1 基因上游同源臂和KanMX 之间的序列,扩增的是阳性结果为1 213 bp;图2(b)设计引物是扩增FKS1基因上下游同源臂之间的序列。重组菌PCR 结果为2 100 bp,原始菌株结果为5 844 bp,不添加模板结果为空白,验证结果符合理论值,构建的重组菌命名为fks1-QT。

图2 P CR 验证重组菌中fks1-QT 中FKS1 基因敲除Fig.2 PCR verification of the FKS1 knocked-out in fks1-QT strain
同样的分子操作构建FKS2 和FKS3 缺陷型菌株。FKS2 和FKS3 缺陷菌株的基因组分别DNA 用F2-UF/F2-UR、F2-DF/F2-DR 和F3-UF/F3-UR、F3-DF/F3-DR 引物对进行PCR 验证,结果如图3和图4 所示,验证结果符合理论值,将重组菌株命名为fks2-QT 和fks3-QT。

图3 P CR 验证重组菌中fks2-QT 中FKS2 基因敲除Fig.3 PCR verification of the FKS2 knocked-out in fks2-QT strain

图4 P CR 验证重组菌中fks3-QT 中FKS3 基因敲除Fig.4 PCR verification of the FKS3 knocked-out in fks3-QT strain
2.2 重组菌生长性能分析
酵母的生长活性对酵母的工业应用有重要作用,图5 所示为各重组菌株与原始菌的生长曲线,由图5 可知,重组菌株fks2-QT 和fks3-QT 的生长速度和原始菌株W303 差异不大,而重组菌种fks1-QT 的生长速度始终慢于原始菌株。FKS1 基因是合成细胞壁葡聚糖酶的关键基因,敲除FKS1 基因的菌株合成酵母细胞壁葡聚糖的能力减弱,酵母细胞壁的正常代谢功能受到影响,从而影响酵母的生长。FKS2 基因对合成细胞壁葡聚糖有一定影响较小,FKS2 基因的缺失并没有影响酵母细胞的生长。FKS3 对酵母细胞的生长并无太大影响。因此,FKS1基因对维持酵母细胞活性有一定作用,FKS1 基因的缺陷导致细胞的生长速度减缓,FKS2、FKS3 基因对酵母的生长率没有明显的影响作用。

图5 重组菌株和原始菌株的生长曲线Fig.5 Growth curves of the recombination strains and wild type strain
2.3 不同菌株细胞壁多糖含量的分析
重组菌株和原始菌株酵母细胞壁多糖的含量如图6 所示,重组菌株fks1-QT(1.77±0.11)mg/g,3-β-葡聚糖的含量相对于原始菌株W303(3.44±0.097)mg/g 降低了约60%。重组菌 株fks2-QT(2.76±0.13)mg/g 和fks3-QT(3.10±0.15)mg/g 的1,3-β-葡聚糖的含量相对于原始菌株W303 分别降低了19.5%和3.8%,变化程度不大。FKS1 基因的缺失导致酵母菌株细胞壁1,3-β-葡聚糖的含量大幅度降低。FKS2 基因缺失导致酵母菌株细胞壁1,3-β-葡聚糖的含量明显降低,FKS2 基因对和细胞壁葡聚有影响但作用不大。FKS3 基因缺失对酵母菌株细胞壁1,3-β-葡聚糖的含量并无太大影响。
重组菌株fks1-QT 细胞壁中甘露聚糖的含量为(3.42±0.10)mg/g,相对于原始菌株W303(2.81±0.09)mg/g 增加了17.8%,重组菌株fks2-QT 和fks3-QT 细胞壁甘露聚糖的含量相对W303 有一定程度减少。重组菌株fks1-QT(0.28±0.04)mg/g 细胞壁中几丁质相对于原始菌株W303(0.12±0.03)mg/g增加了57.1%,重组菌株fks2-QT 和fks3-QT 细胞壁几丁质的含量相对W303 没有太大变化。突变菌株细胞壁中1,3-β-葡聚糖的含量都有不同程度的降低,酵母细胞壁成分是动态的,为了维持细胞壁完整性,其他多糖会随之产生变化。

图6 细胞壁多糖含量Fig.6 Content of polysaccharides in cell wall
2.4 抗环境胁迫能力分析
酵母菌株在工业应用中要面对发酵液中环境的压力,是反映酵母性能的重要指标。原始菌株和重组菌株对渗透压、酒精浓度以及对饥饿的抗性如图7 所示:在含有0.5 NaCl mg/g 及饥饿培养条件下,原始菌株W303 的生长优势最明显,而重组菌株fks1-QT 的生长性能最差,而在在10%乙醇的环境压力下,原始菌株W303 的抗性最差。酵母细胞壁有抵抗外界渗透压的作用,细胞1,3-β-葡聚糖的含量减少,导致酵母细胞细胞壁抵抗外界渗透压能力变弱,突变菌株在在含有0.5 NaCl mg/g 的条件下生产性能较差。细胞壁1,3-β-葡聚糖的含量减少导致突变菌尤其是FKS1 基因缺失菌株对环境适应能力变弱,在饥饿培养条件下生长状况较差。在10%乙醇环境压力下,原始菌株的生长状况较差。该结论可以证明,FKS 家族基因对细胞抗渗透压和饥饿的能力有重要作用,而对抗酒精胁迫的能力有负面影响。
2.5 酵母液体发酵实验
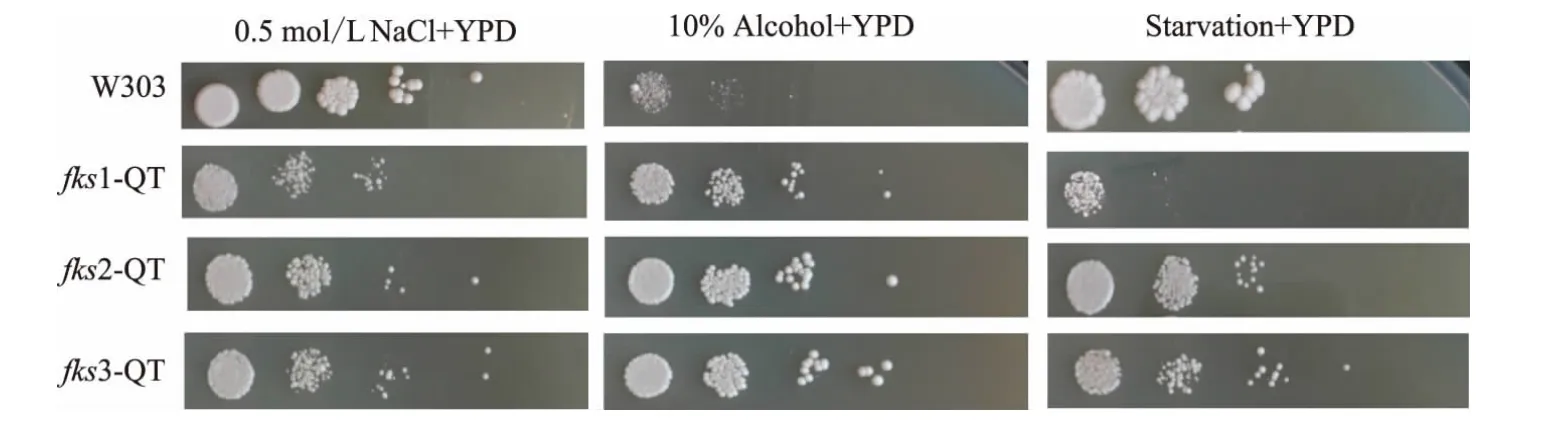
图7 不同菌株在抗性平板上的生长状况Fig.7 Different strains growth condition in stressful environment
为判断不同菌株在啤酒发酵条件下的状况,将菌株置于麦汁培养基中发酵,模拟发酵环境。分别于第2、7 和12 天取发酵液,测定酵母死亡率,并扫描电镜观察酵母的形态(图8)。如表4 所示,第2 天不同菌株的死亡率差异不大,酵母细胞的形态都是饱满、圆润、没有破损的,随着时间的推移不同菌株酵母的死亡率差异越大。第12 天时,fks1-QT 菌株的死亡率最高,观察SEM 图片,细胞出现较大范围的自溶状况,细胞内容物流出,严重干瘪变形。fks2-QT 菌株的死亡率与原始菌株W303 接近,且与原始菌株W303 相同部分酵母开始有破损,小范围的酵母出现自溶状况。重组菌株fks3-QT 的死亡率低,并且低于原始菌株W303 的死亡率,细胞依旧圆润,比较完整,良好的抵抗外界压力。由此证明,FKS1 基因通过控制对细胞壁的完整性对抵抗发酵环境的压力有重要的作用,FKS3 基因对细胞抵抗发酵环境的压力作用有负面作用。
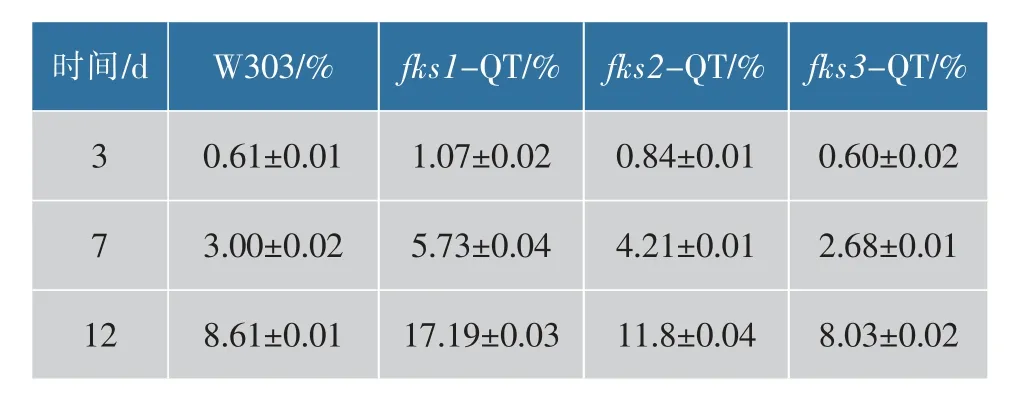
表4 细胞在发酵液中的死亡率Table 4 Mortality rate of yeast cells in the fermentation broth

图8 原始菌株和重组菌株的扫描电镜(SEM)分析Fig.8 SEM analysis of wild type strain and mutant strains
2.6 FKS 家族基因对酵母合成乙醇能力的影响
模式菌株W303 不具备工业酵母良好的发酵性能,但有完整的合成乙醇的途径,测定重组菌株和原始菌株的酒精度,可反映FKS 家族基因对酵母细胞合成乙醇的影响,对工业酵母有一定的指导意义。经过15 d 的发酵后测定发酵液的酒精度(图9),重组菌株fks3-QT(1.53±0.031)%的酒精度最高,之后依次为W303(1.23±0.032)%、fks2-QT(0.85±0.031)%、fks1-QT(0.485±0.031)%。根据2.5节的分析FKS 家族基因对酵母的活性、对外界环境的耐压性有不同的影响,抗发酵环境压力强的菌株fks3-QT 活性更强导致发酵合成的乙醇浓度最高,抗发酵环境压力较弱的菌株fks1-QT 活性更弱导致发酵合成的乙醇浓度最低。因此,FKS 家族基因通过影响酵母在发酵时的细胞状态,从而影响酵母合成乙醇的能力。

图9 不同菌株发酵酒精度Fig.9 Fermentation liquid alcohol of different strains
3 结语
酵母抵抗外界环境的压力对酵母在发酵工业中,尤其是啤酒行业的生产起着关键的作用。了解酵母抗压力机制,对选育强壮的酵母有重要的指导作用。酵母也常被用来作为模式生物研究真核细胞的遗传学和生理学,但是多倍体酵母中,多位基因存在时在基因改良过程中有可能发生回复突变[23],单倍体W303 模式菌株则可以避免这些问题。
本研究运用生物学手段得到FKS 家族基因单个敲除的重组菌株,比较原始菌株和重组菌种的生长状况、细胞壁多糖含量、抗胁迫能力以及在发酵环境下的死亡率等。发现重组菌株fks1-QT 细胞壁1,3-β-葡聚糖相对于原始菌株W303 的含量降低了60%,且生长性能较差,但抗酒精胁迫抗性更强,而渗透压和饥饿耐受性较差,在发酵环境中也更容易死亡。重组菌种fks2-QT 细胞壁中β-葡聚糖的含量略低于原始菌株W303,其他生理形状与原始菌株相差不大。重组菌株fks3-QT 在发酵环境中的死亡率低于原始菌株,SEM 电镜中fks3-QT 的状态、酒精代谢活性也优于原始菌株,因此FKS1 基因对酵母维持细胞耐受性、保证细胞正常生长有重要的作用,而FKS3 基因对酵母耐受性有负面作用,但其作用机理仍待研究。

