单核细胞/高密度脂蛋白胆固醇比值与ST段抬高型急性心肌梗死患者梗死相关动脉自发再通的关系
季莹莹, 汤建民,王丰云,杨雁华, 宿东升, 朱银川, 赵一品, 王顺利, 来桂颗
郑州大学第二附属医院心内科 郑州 450014
研究[1-3]显示梗死相关动脉(infarct-related arteries, IRA)自发再通的ST段抬高型急性心肌梗死(ST segment elevation acute myocardial infarction, STEMI)患者有较小的梗死面积、较低的冠状动脉(冠脉)微循环阻塞率、心功能不全发生率和病死率,表现为良性趋势的预后。自发再通是指未经溶栓或介入治疗的IRA在行急诊冠脉造影(coronary angiography,CAG)时心肌梗死溶栓临床试验(thrombolysis in myocardial infarction, TIMI)血流分级达2~3级[4]。单核细胞参与冠心病的各阶段,在动脉粥样硬化的发生、斑块进展及血栓形成等病理生理过程中起促炎、促氧化作用。而高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)在动脉粥样硬化过程中发挥抗炎、抗氧化及抗血栓形成的作用。单核细胞与高密度脂蛋白胆固醇比值(monocyte to high density lipoprotein cholesterol ratio, MHR)可代表机体炎症与氧化应激状态,并用于心血管疾病的诊治和预后评估。MHR与STEMI患者冠脉病变程度、近远期不良心血管事件的发生及冠脉慢血流或无复流的发生相关[5-6]。本文旨在探讨MHR与STEMI患者IRA自发再通的关系。
1 对象与方法
1.1研究对象收集2015年9月至2016年12月于郑州大学第二附属医院心内科就诊并行急诊CAG的STEMI患者155例,其中男123例,女32例,年龄33~79(60.6±9.9)岁。研究对象的纳入标准:①符合2015年中华医学会心血管分会制定的STEMI诊断标准[7]。②发病12 h内。排除标准:使用溶栓药物,陈旧性心肌梗死,既往行冠脉旁路搭桥术或经皮冠脉介入治疗术(percutaneous coronary intervention, PCI),合并心肌病、瓣膜性心脏病、严重心力衰竭、心律失常等,肝肾功能不全,近期外伤、大出血、外科手术史,合并甲状腺疾病、卒中、感染性疾病、肿瘤、血液系统疾病及自身免疫性疾病等,相关研究资料不全。试验前经医院伦理委员会批准,并取得患者知情同意。
1.2资料收集收集所有患者临床资料,包括性别、年龄、身高、体重、吸烟史、高血压病史、糖尿病病史及用药史等,所有患者入院后均抽取静脉血行血常规、肾功能、血脂、高敏C反应蛋白(high sensitivity C-reactive protein, hs-CRP)、心肌损伤标志物等生化检查。同时分别计算中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)及MHR。记录入院后24 h内床旁心脏彩色多普勒检查结果左心室射血分数(left ventricular ejection fraction, LVEF)值。
1.3介入治疗及分组患者行CAG前均给予口服负荷剂量的拜阿司匹林肠溶片300 mg和替格瑞洛180 mg,并由2名经验丰富的医师经桡动脉或股动脉(左侧或右侧)途径完成CAG。根据TIMI血流分级分为自发再通组(TIMI血流2~3级),共43例;非自发再通组(TIMI血流0~1级),共112例。
1.4统计学处理采用SPSS 22.0分析。两组临床项目定量资料的组间比较采用两独立样本t检验,服从偏态分布的采用M(Q1,Q3)表示,应用两独立样本的秩和检验;采用χ2检验行定性资料的组间比较。采用Pearson相关分析探讨MHR与NLR、血尿酸、hs-CPR、MPV、LVEF的关系。单因素分析中有意义的变量纳入logistic回归模型,并采用逐步后退条件法分析IRA自发再通的影响因素。ROC评价MHR对IRA自发再通的预测价值。检验水准α=0.05。
2 结果
2.1两组临床资料的比较见表1。非自发再通组MHR水平明显高于自发再通组。
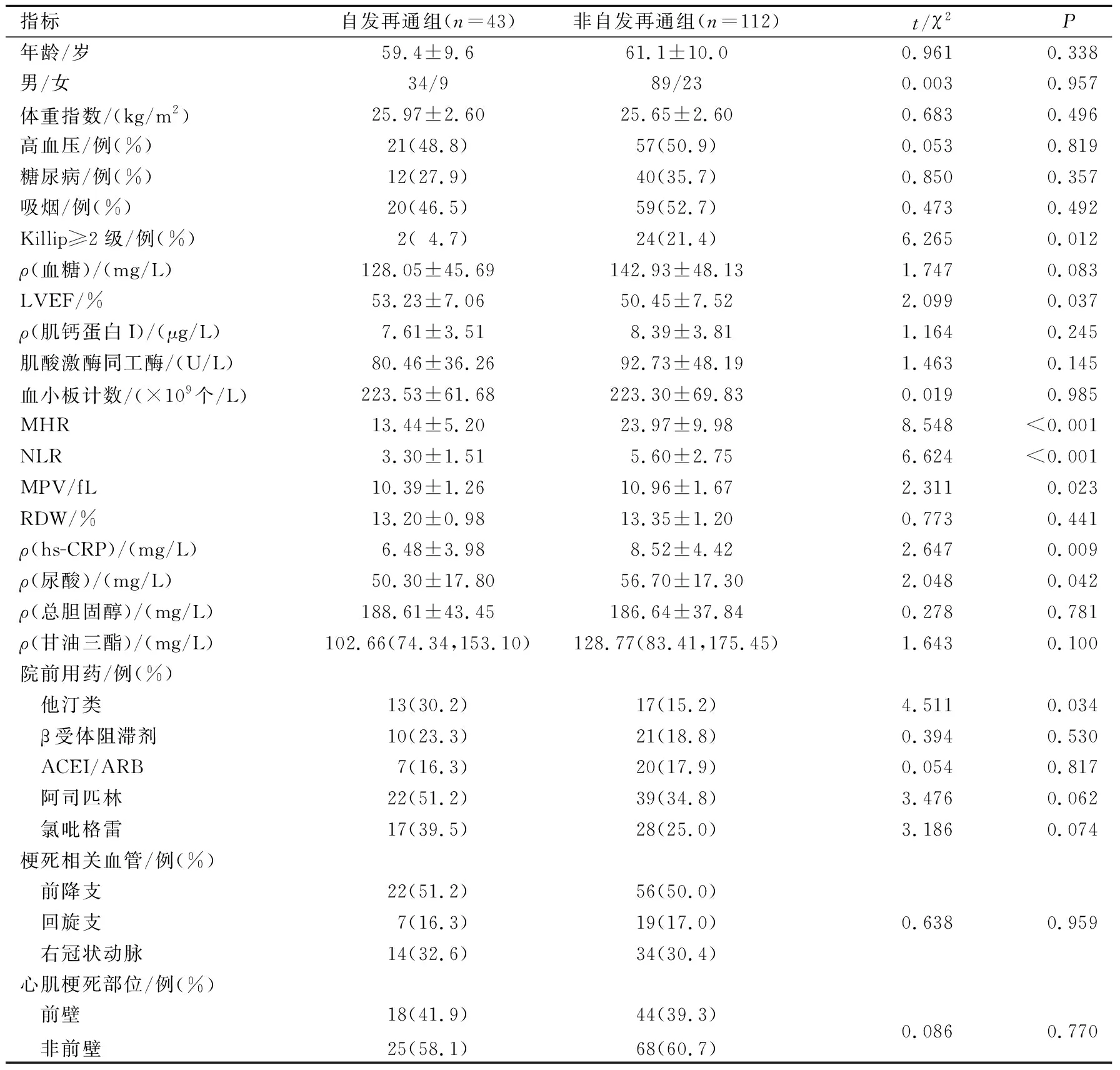
表1 两组临床资料的比较
ACEI/ARB:血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂;MPV:平均血小板体积;RDW:红细胞分布宽度
2.2相关性分析MHR与NLR呈正相关(r=0.273,P=0.001),与血尿酸(r=0.147,P=0.068)、hs-CRP(r=0.094,P=0.244)、MPV(r=0.046,P=0.566)、LVEF(r=0.135,P=0.095)无相关性。
2.3IRA自发再通影响因素的分析将单因素分析中有统计学意义的变量Killip≥2级(是=1,否=0)、服用他汀类药物(是=1,否=0)、LVEF、MHR、NLR、血尿酸、hs-CRP及MPV纳入logistic回归模型,并采用逐步后退条件分析方法分析显示MHR是IRA自发再通的独立危险因素(表2)。
2.4MHR对IRA自发再通的预测价值MHR预测IRA自发再通的ROC曲线下面积为0.821(95%CI=0.754~0.887);MHR为18.23时的敏感度为83.7%,特异度为67.0%。结果见图1。
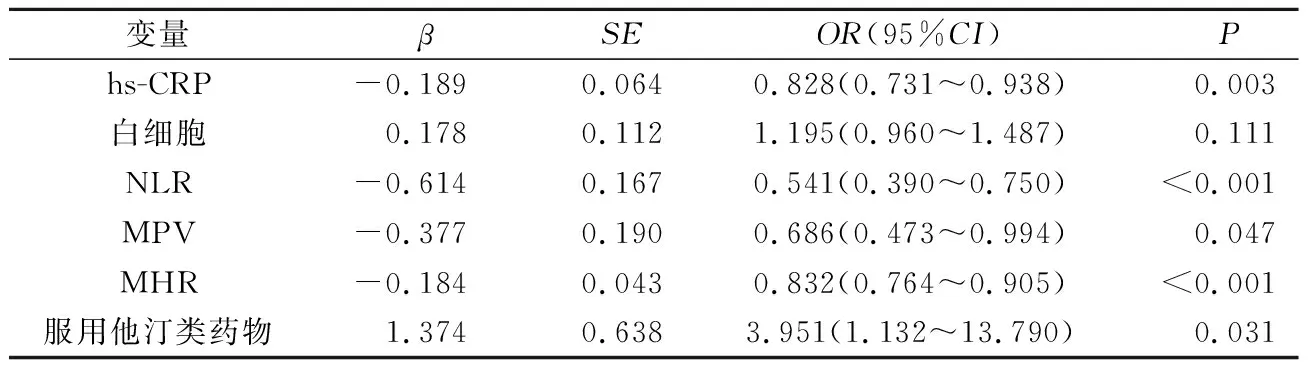
表2 STEMI患者IRA自发再通的logistic回归分析
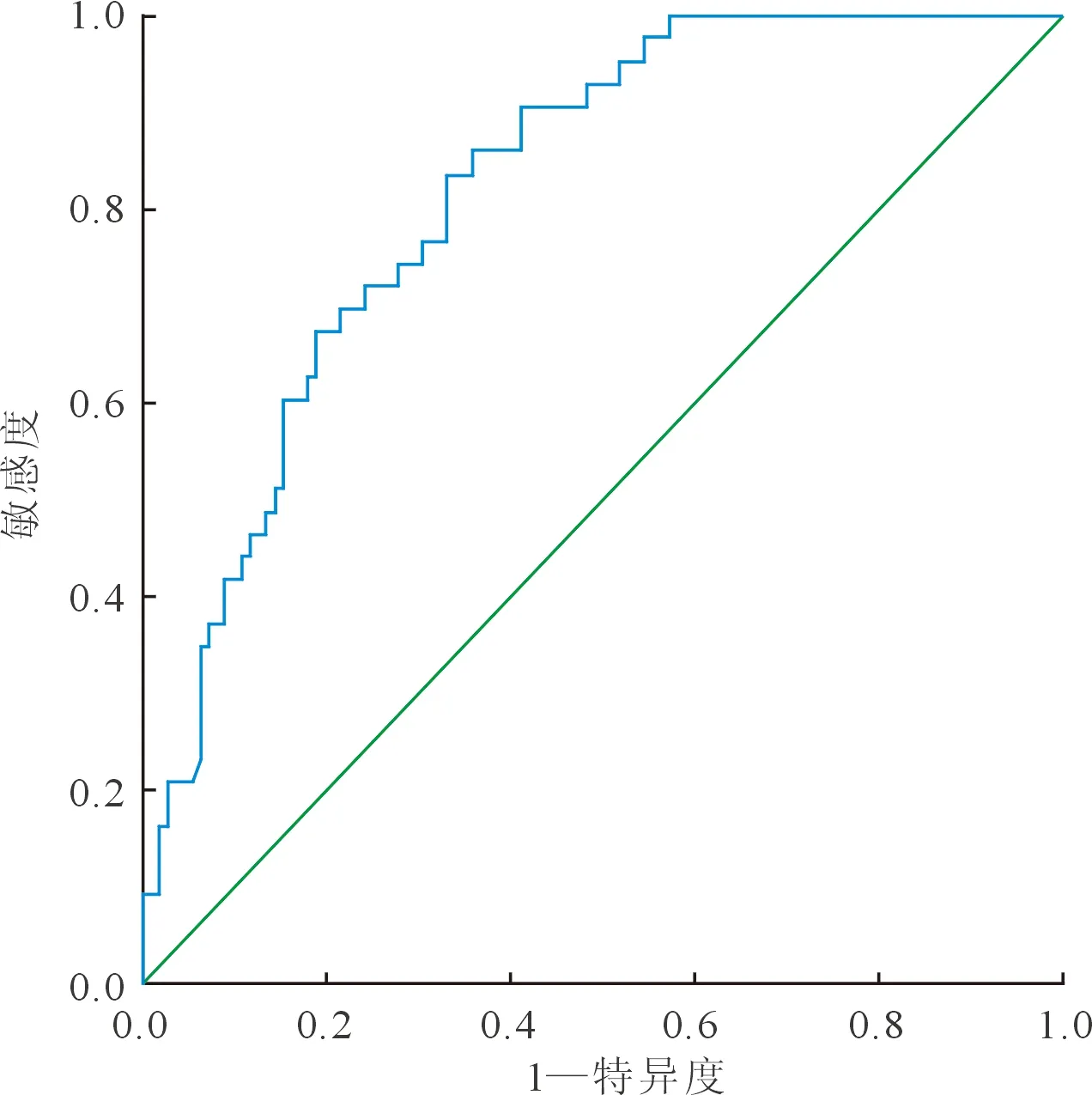
图1 MHR预测IRA自发再通的ROC曲线
3 讨论
尽早行PCI术开通IRA是改善STEMI患者预后最有效的措施。IRA自发再通的STEMI患者较非自发再通患者有更好的预后。早期进行自发再通的筛选对于STEMI患者下一步治疗方案的制定意义重大,但临床上目前预测自发再通的指标不多。文献[8-9]报道自发再通可能与多种病理过程有关,包括内源性血栓自发溶解、冠脉血管痉挛、炎症反应、氧化应激等,但是IRA自发再通的具体机制尚未阐明。
炎症反应贯穿于动脉粥样硬化发生、斑块进展和破裂以及血栓形成中。单核细胞在趋化因子作用下黏附至功能失调的血管内皮,随后分化为巨噬细胞,并在吞噬低密度脂蛋白胆固醇后形成泡沫细胞,最终与血管平滑肌细胞等相互作用形成斑块;分泌金属基质蛋白并诱导释放细胞因子、生长因子等,促进血管生成、易损斑块形成及破裂,发挥促进炎症和氧化应激的作用[10]。单核细胞还可与血管内皮细胞及血小板相互作用发挥促炎、促氧化及促血栓形成的作用[11-12]。Chapman等[13]研究发现单核细胞计数是健康人群颈动脉斑块形成的独立预测因子。陈洁霞等[14]报道循环中单核细胞增多时冠脉不稳定斑块中单核细胞聚集增加、吞脂及黏附纤维蛋白原的能力增强,提示单核细胞升高与斑块的形成及进展有关。因此,单核细胞计数可能与冠心病的发生、进展相关。流行病学研究[15]结果显示HDL-C可作为人群心血管疾病发病风险的独立预测因子并与心血管疾病的发病风险呈负相关。HDL-C可通过促进胆固醇的逆向转运、抑制低密度脂蛋白的氧化及保护内皮发挥动脉血管的保护作用。研究[16]显示HDL-C除具有抗炎及抗氧化的作用外,还可抑制单核细胞的活化及其祖细胞的增殖及分化,从而发挥心血管保护作用。鉴于单核细胞和HDL-C各自在动脉粥样硬化过程中的作用,MHR可能与心血管疾病的发生、进展及预后相关。熊伶俐等[17]对接受PCI术治疗的冠心病患者进行1 a以上的随访,结果发现MHR是支架内再狭窄的独立预测因子。Arisoy等[18]认为MHR对预测STEMI患者高血栓负荷有一定价值。
本研究结果显示急诊行CAG术的STEMI患者中自发再通患者MHR水平明显低于非自发再通患者,MHR是自发再通的独立预测因子,提示急诊行PCI术的STEMI患者MHR水平可能与IRA早期自发再通存在相关性。MHR可能与降钙素原、氧化应激指数等代表机体炎症及氧化应激状态的指标一致[9,19],均可预测自发再通。以上结果同时也进一步提示炎症及氧化应激参与了自发再通的发生。MHR与IRA自发再通相关的可能机制为炎症与氧化应激反应影响。
本研究为单中心研究,入组人群较少且主要为男性,还需多中心大规模的研究来进一步证实。
综上所述,MHR是预测STEMI患者IRA发生自发再通的独立危险因子,可用于临床上对早期发生自发再通的患者进行预估,辅助用于STEMI患者个体化治疗方案的制定。

