太平洋牡蛎防御素在毕赤酵母中的重组表达及其抑菌活性
崔旭,陶妍,王强厚,张亚莉,颜倩倩
上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306
防御素是生物机体在长期进化过程中保留下来的自身防御机制中的重要组成成分,是机体抵御外来病原微生物入侵的重要屏障,在机体的先天性免疫中发挥重要的作用[1-4]。1960年美国洛克菲勒研究所Cohn等[5]首次从兔的多形核白细胞中提取出此类具有杀菌活性的阳离子蛋白,其具有抑制革兰氏阳性菌和革兰氏阴性菌的作用,并能抑制蛋白水解酶的作用,他们将其命名为“Phagocytin” (吞噬素);六年以后,北卡罗莱纳大学医学院的Zeya等[6-7]经过一系列研究证实了“吞噬素”实际上是存在于胞质颗粒内的富含精氨酸和半胱氨酸的碱性阳离子多肽, 并称之为“Lysosomal cationic proteins” (溶酶体阳离子蛋白),且此类多肽显示了对大肠杆菌的抑制作用。20世纪80年代中期,加州大学洛杉矶分校医学院的Ganz等[8]首次以“Defensin” (防御素) 命名此类多肽;之后人体内存在的3种α-防御素(HNP-1、HNP-2、HNP-3) 被证实对病原微生物、流感病毒、巨细胞病毒和水泡型口炎病毒等具有杀灭或抑制作用[9-10];并且,研究显示,经HNP免疫的小鼠血清中免疫球蛋白的量明显增加[11]。21世纪初,美国洛克菲勒大学华人科学家张林琦在Science发表论文,称其用蛋白芯片法分离并识别出人体内T-细胞分泌的具有抑制艾滋病病毒复制作用的因子,即为α-防御素,为艾滋病的治疗提供了新的方向[12]。综上所述,防御素具有较广谱的抑菌作用、抗炎和免疫调节功能,是开发天然免疫蛋白和天然抑菌剂的良好候选者。
迄今为止,国内外在防御素的研究方面取得了较大进展,已从多种生物 (人、鸡、马和玉米等) 机体中分离获得防御素基因[13-16],其在基因工程研究领域中的应用正在不断扩大。水产生物的栖息环境复杂,近年来出现的严重水域污染使它们比其他生物更易遭受病原微生物的侵染[17]。换言之,水产生物的机体必须拥有比其他生物更强的免疫系统才能适应这种复杂的生存环境,尤其是贝类等软体动物在缺乏具有“记忆效应”的特异性免疫机制的情况下,仍然能抵御各种病原微生物的侵染,而防御素则是其先天性免疫系统中的重要免疫因子[18]。Zhao等[19]从海湾扇贝Argopecten irradians中提取大防御素AiBD基因,构建了重组表达载体,通过在毕赤酵母中的表达获得重组AiBD,抑菌试验显示该重组蛋白对多种革兰氏阳性和阴性菌具有抑制作用;之后,他们又将从菲律宾蛤仔Venerupis philippinarum中克隆到的大防御素VpBD基因通过大肠杆菌表达系统获得重组VpBD,其对金黄色葡萄球菌Staphylococcus aureus和恶臭假单孢菌Pseudomonasputida具有抑菌活性[20]。据 Guenguen等[21]报道,他们从太平洋牡蛎Crassostrea gigas外套膜中也发现了一种新型防御素基因,将其命名为Cg-def,通过原核表达系统获得的重组Cg-def对革兰氏阳性菌具有较好的抑菌活性,但对革兰氏阴性菌无明显作用。众所周知,原核表达系统存在一定的缺陷,比如不能对表达产物进行翻译后加工修饰,以致表达的目的蛋白会形成不溶性的包涵体,需要经过复杂的复性才能恢复构象和活性。而与原核表达系统相比,巴斯德毕赤酵母Pichia pastoris作为真核表达的宿主,其有助于表达产物空间构象的形成,进而获得具有生物学活性的重组蛋白,并可实现目的蛋白的细胞外分泌表达以方便表达产物的后续处理,是目前公认的外源蛋白表达的良好宿主[22]。最近,我们报道了基于毕赤酵母表达系统获得的斑马鱼Danio rerio重组β-防御素 (zfDB3),它对大肠杆菌Escherchia coli、铜绿假单孢菌Pseudomonas aeruginosa和单增李斯特菌Listeria monocytogenes等显示了良好的抑菌活性[23]。本研究以上述太平洋牡蛎防御素基因作为重组表达的目标,拟通过毕赤酵母表达系统获得具有生物学活性的重组蛋白,以期为开发能够替代或部分替代抗生素的天然抗菌剂提供良好的候选者和技术途径。
为了实现上述目标,首先通过RT-PCR从太平洋牡蛎外套膜中分离编码防御素的cDNA片段;通过设计添加和不添加6×His标签的两种目的基因,以pPICZαA为表达载体,构建重组表达载体;在毕赤酵母X-33中使用甲醇诱导表达重组蛋白,并通过固化金属离子亲和层析 (IMAC) 和MALDI-TOF/TOF质谱分析对表达产物进行纯化和结构鉴定,最终检测太平洋牡蛎重组防御素的抑菌活性。
1 材料与方法
1.1 材料
1.1.1 实验动物、菌株和载体
鲜活的太平洋牡蛎购自上海市芦潮港海鲜市场;毕赤酵母X-33和表达载体pPICZαA购自Invitrogen公司 (美国);克隆载体pMD19-T购自TaKaRa公司 (日本);大肠杆菌 DH5α购自天根生物科技有限公司 (北京);金黄色葡萄球菌和铜绿假单孢菌由本实验室保藏。
1.1.2 主要试剂和设备
RNAiso plus、限制性内切酶(SacⅠ、XhoⅠ和XbaⅠ)、T4 DNA连接酶和TaqDNA聚合酶均购自TaKaRa公司;3′-RACE试剂盒购自Invitrogen公司;DNA分子量marker、DNA回收试剂盒、质粒小提试剂盒和酵母基因组DNA提取试剂盒均购自天根生物科技有限公司;超低蛋白质分子量marker购自中科瑞泰生物科技有限公司 (北京);Western blotting试剂盒购自康为世纪生物科技有限公司 (北京);PCR仪、聚丙烯酰氨凝胶电泳仪、电转仪和IMAC柱均来自BIO-RAD公司(美国)。引物合成、DNA测序由生工生物工程 (上海) 股份有限公司完成;MALDI-TOF-TOF质谱分析由上海中科新生命生物科技有限公司完成。
1.2 方法
1.2.1 总RNA提取及第一链cDNA合成
鲜活太平洋牡蛎运至实验室后,取其外套膜,采用RNAiso Plus试剂提取总RNA;通过3′-RACE法合成第一链cDNA:总RNA 2 µL、通用引物(5 µmol/L) 1 µL、5×PrimeScript缓冲液2 µL、dNTPs (10 mmol/L) 1 µL、RNase抑制剂 (40 U/µL)0.25 µL、PrimeScript RTase (200 U/µL) 0.25 µL,用RNase Free dH2O调至10 µL;42 ℃反应60 min,然后70 ℃保温15 min,获得第一链cDNA保存于–20 ℃。
1.2.2 添加和不添加6×His标签的目的基因的cDNA克隆
以第一链cDNA为模板,参考多种软体动物防御素基因设计正向引物CgD-F和反向引物CgD-R (表1),通过PCR扩增编码太平洋牡蛎防御素的cDNA片段,反应体系和条件如下:10×Taq缓冲液2 µL、dNTPs (10 mmol/L) 1.6 µL、正向和反向引物 (10 µmol/L) 各0.8 µL、第一链cDNA 0.2 µL、TaqDNA聚合酶 (2.5 U/µL) 0.2 µL,无菌水调至20 µL;94 ℃ 3 min、94 ℃ 40 s、53.5 ℃30 s、72 ℃ 1 min、72 ℃ 10 min,反应进行30个循环;该片段经连接至pMD19-T simple载体后转入大肠杆菌DH5α,37 ℃过夜培养后选择阳性克隆由生工生物工程 (上海) 股份有限公司进行DNA测序。以此cDNA片段为模板、采用CgD-F1和CgD-R1以及CgD-F1和CgD-R2两对引物 (表1),通过两次PCR扩增5′端含XhoⅠ酶切位点和Kex 2信号肽识别位点,3′端含6×His标签、终止密码子和XbaⅠ酶切位点的目的基因CgDH+;另一方面,以CgD-F1和CgD-R3为引物 (表1),通过PCR扩增5′端含XhoⅠ酶切位点和Kex 2信号肽识别位点、3′端含终止密码子和XbaⅠ酶切位点的目的基因CgDH-。扩增该两种目的基因的所有PCR反应体系和条件基本同上,除了退火温度有所改变(扩增CgDH+的两次PCR的退火温度分别为56.8 ℃和56.5 ℃;扩增CgDH-的退火温度为54.2 ℃)。扩增到的两种目的基因同上处理后由生工生物工程 (上海) 股份有限公司进行DNA测序,通过ExPASy软件(http://web.expasy.org /compute.pi/)预测它们编码的蛋白质的分子量和等电点。
1.2.3 重组表达载体的构建及电转至毕赤酵母X-33
采用XhoⅠ和XbaⅠ分别对pMD19-T-CgDH+和pMD19-T-CgDH-进行双酶切,获得目的基因CgDH+和CgDH-后,在T4 DNA连接酶作用下,将其与经同样限制性酶处理过的pPICZαA按1∶1(V/V) 连接 (16 ℃,1 h) 以构建重组表达载体pPICZαA-CgDH+和pPICZαA-CgDH-;两者被转入大肠杆菌DH5α感受态细胞中,通过菌落PCR对其进行鉴定并测序。经确证的pPICZαA-CgDH+和pPICZαA-CgDH-用限制性内切酶SacⅠ处理后,分别与毕赤酵母X-33感受态细胞以1∶8 (V/V)混合,转入预冷的0.2 cm电转杯中冰浴5 min,2 000 V、25 μF和200 Ω条件下电击5 ms;立即加入1 mL预冷的1 mol/L山梨醇。另外,将pPICZαA(空载体) 电转至毕赤酵母X-33,以此作为阴性对照。

表1 引物序列Table 1 Sequences of primers
1.2.4 高拷贝酵母转化子的筛选
将上述电转后的溶液置于30 ℃恒温箱中保温2 h,离心后将菌体涂于含100 μg/mL博来霉素的YPD平板(酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L)上,于29 ℃孵育至单克隆产生;选择长势良好的菌落分别接种至含高浓度博来霉素(1000 μg/mL)的YPD及MM(YNB 13.4 g/L、生物素0.4 mg /L、甲醇5 mL/L、琼脂15 g/L)和MD(YNB 13.4 g/L、生物素0.4 mg/L、葡萄糖20 g/L、琼脂15 g/L)平板上,29 ℃培养8 h。对筛选获得的甲醇利用快速型高拷贝酵母转化子提取基因组DNA,并以此为模板,采用pPICZαA上的通用引物5ʹAOX1和3ʹAOX1 (表1)进行PCR鉴定。
1.2.5 目的蛋白在毕赤酵母X-33中的表达及表达条件的优化
将上述经PCR鉴定获得的两株酵母转化子(含pPICZαA-CgDH+和pPICZαA-CgDH-)分别接种于5 mL YPD液体培养基中,29 ℃、250 r/min培养24 h后,取500 μL转接至50 mL MGY培养基 (酵母粉10 g/L、蛋白胨20 g/L、YNB 13.4 g/L、生物素0.4 mg /L、甘油 10 mL/L、磷酸钾缓冲液100 mmol/L,pH 6.0) 中,相同条件下培养24 h;全部转入MM培养基 (配方同MGY培养基,除了10 mL/L的甲醇取代甘油) 中,29 ℃、250 r/min培养72 h,每隔24 h补加甲醇至1.0%。培养液经超滤浓缩后,通过Tricine-SDS-PAGE对其进行分析,电泳条件:0.1 mol/L N-三(羟甲基) 甲基甘氨酸,浓缩胶、夹层胶和分离胶的浓度分别为4%、10%和16.5%。同时,将MM培养基中的甲醇浓度设为0%、0.5%、1%、1.5%和2%,选取含pPICZαA-CgDH-的酵母转化子同上条件进行培养,以确定最适甲醇浓度;在此基础上,进一步对同一酵母转化子进行不同时间段的培养,以确定最佳表达时间。
1.2.6 表达产物的纯化及Western blotting分析和结构鉴定
将上述筛选到的含pPICZαA-CgDH+的酵母转化子扩大培养至1 L,在最适条件下进行培养;培养液经离心后收集上清,经赛多利斯切向回流超滤器浓缩后,通过Profina蛋白质纯化仪进行固化金属离子亲和层析 (IMAC);纯化产物经Tricine-SDSPAGE分析后,切下目的条带由上海中科新生命生物科技有限公司进行MALDI-TOF- TOF质谱分析。采用BCA试剂盒测定蛋白质浓度。此外,将电泳后的凝胶电转至PVDF膜上 (100 V,1 h),采用Western blotting试剂盒进行分析,具体操作如下:加封闭液反应1 h后洗膜,加入鼠单克隆抗体 (一抗) 室温孵育2 h;洗膜后加入辣根过氧化物酶标记的山羊抗小鼠IgG (二抗) 室温孵育1 h;洗膜后用HRP-DAB显色试剂盒进行显色。
1.2.7 重组蛋白的抑菌活性测定
以金黄色葡萄球菌和铜绿假单孢菌为试验菌,将两者分别接种于5 mL Luria-Bertani (LB)液体培养基中,于37 ℃、150 r/min条件下培养至对数生长期;菌液经10倍稀释后取1 μL分别与100 μL的含重组蛋白CgDH+和含重组蛋白CgDH-的培养液上清 (蛋白质总浓度分别为2.4 mg/mL和2.69 mg/mL) 混合,37 ℃保温2 h,取30 μL涂于LB平板,再37 ℃培养24 h,观察细菌生长情况。另外,以含pPICZαA (空载体) 的酵母转化子的培养液上清作为阴性对照。
2 结果与分析
2.1 目的基因CgDH+和CgDH–的PCR扩增及其序列分析
以太平洋牡蛎外套膜的第一链cDNA为模板,使用引物CgD-F和CgD-R,扩增到146 bp的编码防御素的cDNA片段。以此cDNA片段为模板,一方面通过使用两对引物CgD-F1和CgD-R1以及CgD-F1和CgD-R2,扩增得到含6×His标签的171 bp的目的基因CgDH+;另一方面,通过使用CgD-F1和CgD-R3引物,扩增得到不含6×His标签的目的基因CgDH-。DNA测序结果显示相关酶切位点和6×His标签被正确添加(图1);CgDH+和CgDH-分别编码了由49个和43个氨基酸残基组成的多肽,内含8个高度保守的半胱氨酸残基,它们在空间上可以形成4对二硫键,以稳定蛋白质结构并赋予其生物学活性。经ExPASy软件预测,两种目的蛋白CgDH+和CgDH-的理论分子量分别为5.78 kDa和4.95 kDa,等电点分别为7.77和7.70。

图1 目的基因CgDH+和CgDH–的核苷酸及推断的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of target genes, CgDH+ and CgDH-.Underlines represent restriction sites; italics represent Kex 2 protease recognition site; shaded letters represent conserved cysteine residues;box represents 6×His; asterisks represent stop codons.
2.2 重组表达载体和高拷贝酵母转化子的鉴定
使用载体上的通用引物5ʹAOX1和3ʹAOX1对pPICZαA-CgDH+和pPICZαA-CgDH-进行大肠杆菌菌落PCR鉴定,获得4个含pPICZαA-CgDH+的阳性菌落和3个含pPICZαA-CgDH-的阳性菌落;各选1株菌用于DNA测序,结果显示两个目的基因分别与表达载体pPICZαA正确连接,未发现任何核苷酸突变。将纯化的pPICZαA-CgDH+和pPICZαA-CgDH-分别电转入毕赤酵母X-33后,经含高浓度博来霉素的MM和MD平板筛选,各取3株长势良好的菌株提取其基因组DNA为模板,使用5ʹAOX1和3ʹAOX1进行PCR鉴定,结果证明pPICZαA-CgDH+和pPICZαA-CgDH-已成功嵌合进毕赤酵母X-33基因组。
2.3 在毕赤酵母X-33中表达目的蛋白及其表达条件的优化
从上述两种酵母转化子中各选1株用于目的蛋白的表达,经Tricine-SDS-PAGE分析表明 (图2A),含pPICZαA-CgDH–和pPICZαA-CgDH+的两种酵母转化子的培养液上清均在近7.8 kDa处有明显蛋白质条带,前者位置略低于后者 (两者理论上相差0.83 kDa),而含空载体的酵母转化子的培养液上清则无此条带。鉴于后者培养液上清中的目的蛋白含6×His标签,在对其扩大至1 L培养后,通过IMAC法获得纯化产物,电泳结果显示该纯化产物为分子量近7.8 kDa的单一条带,证明其纯度较高,该条带用于Western blotting和MALDI-TOF/TOF质谱鉴定。经BCA法测得纯化的重组蛋白浓度为0.58 mg/mL,推算至表达量为2.32 mg/L。

图2 纯化的CgDH+(A) 以及不同甲醇浓度 (B) 和不同表达时间 (C) 下的培养液上清的Tricine-SDS-PAGE分析Fig.2 Tricine-SDS-PAGE analysis for the purified CgDH+ (A) and culture medium supernatants from yeast transformants induced with different concentrations of methanol (B) and expressed for different time (C).M: protein marker; CK: yeast transformant harboring pPICZαA; 1: yeast transformant harboring “pPICZαA-CgDH-”; 2: yeast transformant harboring “pPICZαA-CgDH+”; 3: purified CgDH+.
在上述实验的基础上,考察不同甲醇浓度对含pPICZαA-CgDH-的酵母转化子表达量的影响,结果如图2B所示。1.0%甲醇浓度下的表达产物中杂蛋白较少,并且目的蛋白的条带最清晰,故在分时段表达时采用1.0%的甲醇浓度。同样以该酵母转化子为例,考察不同培养时间对表达量的影响,由图2C可见,培养24-120 h时都有目的蛋白表达,在48 h时表达量已较高,之后随着培养时间的延长,表达量并无明显增加。据此,一方面考虑到杂蛋白的影响和降低成本,另一方面据文献报道[21],防御素对真菌有一定的抑制作用,随着防御素含量的增加,酵母细胞的生长可能会受到影响,并且目的蛋白可能会被蛋白酶降解。因此,选择最佳的诱导培养时间为48-72 h。
2.4 重组蛋白CgDH+的Western blotting分析及MALDI-TOF-TOF质谱鉴定
含重组蛋白CgDH+的培养液上清和纯化产物经Western blotting分析后显示 (图3A、3B),在10 kDa附近都存在单一明显条带,此位置的分子量明显高于理论分子量5.78 kDa,究其原因可能是因为超低分子量蛋白质marker与显色染料共价偶联,在电泳时影响了其迁移速度,以致显示目的蛋白的分子量比理论分子量高。纯化产物的MALDI-TOF-TOF质谱分析显示 (图4),在m/z799.0-4 013.0之间捕捉到7个肽段,其覆盖的残基数约占重组蛋白CgDH+氨基酸序列总长的83.67%;其中m/z为841.3713和1217.540 9的两个峰分别代表自N端起44-49残基 (HHHHHH)和22-31残基 (AGYCDFWTVR) 的肽段,该两段序列分别与相应位置的理论序列相符,由此证明,纯化产物即为预期的重组蛋白CgDH+。
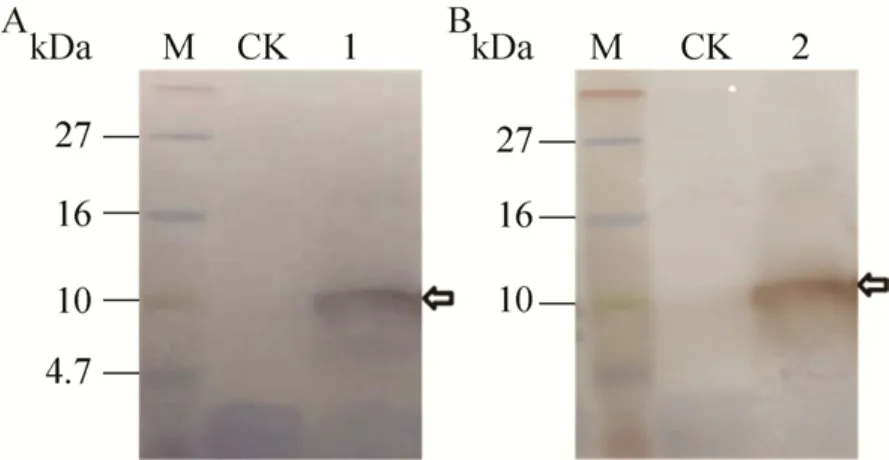
图3 含pPICZαA-CgDH+的酵母转化子的培养液上清 (A) 和纯化CgDH+(B) 的Western blotting分析Fig.3 Western blotting analysis for the culture medium supernatant from yeast transformant harboring pPICZαA-CgDH+(A) and purified CgDH+ (B).M: protein marker; CK: yeast transformant harboring pPICZαA; 1:yeast transformant harboring “pPICZαA-CgDH+”; 2:purified CgDH+.

图4 纯化的CgDH+的MALDI-TOF-TOF质谱分析Fig.4 MALDI-TOF-TOF analysis for the purified CgDH+.
2.5 重组蛋白CgDH+和重组蛋白CgDH–的抑菌活性
由图5所示,与阴性对照 (两种试验菌与含空载体的酵母转化子的培养液上清作用) 相比,革兰氏阳性的金黄色葡萄球菌和革兰氏阴性的铜绿假单孢菌经与含重组蛋白CgDH+和重组蛋白CgDH-的培养液上清作用,平板上的菌落数明显减少,表明这两种培养液上清显示的抑菌活性分别来源于重组蛋白CgDH+和重组蛋白CgDH-。另一方面,该结果也初步证明重组蛋白中6×His标签的存在与否并不影响其生物学活性。
3 讨论
软体动物进化地位较低,而它们在生物界中发展和进化的历史却比脊椎动物长得多;它们虽然缺乏特异性的免疫系统,但从物种生存以及繁衍的角度看,其机体的防御体系并不逊色于脊椎动物,而防御素则是它们机体细胞中关键的免疫因子[18,24]。由此可以推测,较脊椎动物而言,来自软体动物的防御素具有更为天然的优势成为天然抗菌剂开发的良好候选者。本研究聚焦于太平洋牡蛎防御素的重组表达,经优化表达条件,建立了毕赤酵母表达系统;通过该系统获得了含6×His和不含6×His的两种重组太平洋牡蛎防御素。根据ExPASy软件预测,这两种重组蛋白的理论分子量分别为5.78 kDa和4.95 kDa,但Tricine-SDS-PAGE分析显示目的条带的分子量偏高 (图2),其原因可能是因为目的蛋白的分子量过小且带正电荷,SDS不能完全屏蔽蛋白质分子间的电荷差异和结构差异,导致其电泳时的位置偏高[25]。基于MALDI-TOF-TOF质谱分析的结构鉴定进一步证明了上述目的条带为预期的目的蛋白。另一方面,通过本研究建立的毕赤酵母表达系统,获得了表达量仅为2.32 mg/L的重组蛋白CgDH+,这种低表达量的现象可能与本研究使用的编码太平洋牡蛎防御素的天然cDNA有关;根据Graphical Codon Usage Analyser (http://www.gcua.schoedl.de/)预测,该cDNA中存在17个低频密码子,它们可能影响了目的蛋白在毕赤酵母中的高效表达。Yang等[26]对黑曲霉Aspergillus nigerlip2基因的密码子进行优化后在毕赤酵母细胞中表达重组蛋白,发现其表达量和生物学活性分别提高了11.6和5.3倍;王方芹等[27]根据酿酒酵母的密码子偏爱性优化了黑曲霉的α-L-鼠李糖苷酶基因rha,发现重组rha的表达量提高了2.9倍,并且其酶活力也提高了2.7倍。此外,我们最近报道的在毕赤酵母X-33中表达的斑马鱼重组β-防御素 (zfDB3) 与本研究获得的两种重组目的蛋白相比,显示了更好的抑菌活性[23],而zfDB3的编码基因中有28个密码子是被优化过的。据此,后续研究将根据毕赤酵母的密码子偏爱性进一步对目的基因进行密码子优化,以期提高表达量。

图5 含重组目的蛋白的培养液上清的抑菌活性Fig.5 Antibacterial activity of the culture medium supernatants containing recombinant target proteins.CK: yeast transformants harboring pPICZαA; 1: yeast transformants harboring “pPICZαA-CgDH-”; 2: yeast transformants harboring “pPICZαA-CgDH+”.
众所周知,对重组蛋白添加6×His标签将有利于其纯化及其结构鉴定,但是否会影响重组蛋白的生物学活性依据各种蛋白质的结构和性质是不同的[28-30]。本研究设计了C端含6×His和不含6×His的重组蛋白CgDH+和CgDH-,抑菌试验显示两者对金黄色葡萄球菌和铜绿假单孢菌都具有抑菌活性 (图5),与马君燕等[30]的研究结果一致。在过去的两年中,我们曾开展了斑点叉尾鮰 C型溶菌酶在毕赤酵母X-33中的表达研究,获得了含6×His和不含6×His的3种重组溶菌酶,发现不含6×His和C端含6×His的重组溶菌酶均具有抑制枯草芽孢杆菌Bacillus subtilis的活性,而N端含6×His的重组溶菌酶则无抑菌活性[31]。产生上述现象的原因被推测为可能是N端的6×His在一定程度上改变了蛋白质的一级结构,进而影响了溶菌酶活性中心的形成;而C端存在的6×His并不影响重组溶菌酶和重组蛋白CgDH+的空间结构。
考虑到对目的蛋白进行大规模发酵时不可能对其进行纯化处理,故本研究分别考察了含重组蛋白CgDH+和重组蛋白CgDH-的培养液上清的抑菌活性,证明两者均显示了抑制革兰氏阳性的金黄色葡萄球菌和革兰氏阴性的铜绿假单孢菌的活性,该结果为今后进一步通过发酵罐发酵制备产品及确定产品的形式提供了重要的依据。
4 结论
本研究从太平洋牡蛎外套膜中分离获得防御素基因,确定其在毕赤酵母X-33中的最适表达条件为:29 ℃、250 r/min、1.0%甲醇、培养72 h;表达的两种目的蛋白(CgDH+和CgDH-)均显示了对于金黄色葡萄球菌和铜绿假单孢菌的抑菌活性。根据纯化的重组蛋白CgDH+的蛋白质浓度推算表达量为2.32 mg/L。本研究结果为软体动物防御素的基因工程制备奠定了重要的研究基础。

