脯氨酸羟基化促进芋螺毒素lt3a的氧化折叠∗
王磊,曾夏芸,任政华
(1.华南农业大学材料与能源学院制药工程系,广东 广州 510642;2. 中山大学生命科学学院,广东 广州 510275)
芋螺毒素是新型海洋药物的重要资源库,在芋螺毒素中存在大量、高丰度的翻译后修饰。芋螺毒素是直接的基因产物,其多种多样的修饰是由不同的酶系统在基因翻译后催化生成的。芋螺毒素编码基因在核糖体中经过翻译后,产生70-120个氨基酸的前体肽,前体肽到成熟肽的过程中发生了蛋白酶切割、二硫键形成等过程,除此之外,还存在很多针对单个氨基酸的翻译后修饰,如脯氨酸的羟化、谷氨酸的羧化和色氨酸的溴化等,在芋螺毒素中已发现了10种以上的翻译后修饰[1-2]。
芋螺毒素翻译后修饰可使单一基因生成不同化学结构的多肽分子,大大增加了芋螺毒素的多样性,增强了毒素对靶分子的识别能力与专一性,同时也提高了芋螺毒素分子对蛋白酶的抗性,改变了修饰后毒素的物理化学性质[3]。翻译后修饰在不同的芋螺毒素中的分布很不均一,有些芋螺毒素除了基本的蛋白酶切割和二硫键形成外没有其他修饰,而有些芋螺毒素家族则被高度修饰,如仅13个氨基酸组成的芋螺毒素tx5a,就含有两个羧化谷氨酸、一个溴化色氨酸、一个羟化脯氨酸和一个糖基化的苏氨酸,再加上二硫键的形成,总共涉及到5种不同的翻译后修饰体系[4]。
羟化脯氨酸(hydroxyproline, Hyp)是一种在芋螺毒素中广泛存在的翻译后修饰。最早在μ-芋螺毒素GIIIA中发现含有多个Hyp[5],随后在多个超家族芋螺毒素中均发现含该修饰的残基,但是羟化脯氨酸在芋螺毒素中起的作用尚不能明确。据文献报道,含不同羟脯氨酸残基的μ-芋螺毒素GIIIA和GIIIB都有生物学活性,说明Hyp不影响GIIIA和GIIIB生物学活性[6];芋螺毒素ε-TxIX序列中的含有的Hyp可能对受体的识别和结合有所影响[7]。Contryphan家族的Lo959和Am975具有同样的氨基酸序列,区别是前者在第3位上是脯氨酸,后者是Hyp,两者的受体都是高电压激活的Ca2+通道,但是作用却完全相反,Lo959能增大Ca2+电流,而Am975具有抑制Ca2+电流的活性,不过这种相反的作用结果有待进一步验证[8]。ω-芋螺毒素GVIA 的Hyp10和Hyp21被脯氨酸替换后,对毒素的生物学活性及对受体N型电压门控钙离子通道的作用没有影响,NMR结果显示仅对毒素的三维结构有一定的影响[9]。ω-芋螺毒素MVIIC的序列中脯氨酸突变为羟脯氨酸后,会提高多肽体外折叠的效率[10]。上述的研究表明,Hyp对芋螺毒素的体外折叠和活性都有一定的影响,但其在芋螺毒素中存在的生物学意义及其作用机制还有待进一步的阐明[10]。
我们在前期研究中,从信号芋螺(Conuslitteratus)毒管中分离鉴定得到一个M-超家族芋螺毒素lt3a,经过Edman降解和质谱分析,推测lt3a含有两个羧化谷氨酸和一个羟化脯氨酸,进一步的对其cDNA序列进行分析,确定芋螺毒素lt3a的氨基酸序列为DγCCγOQWCDGACDCCS, γ 代表羧基化谷氨酸,O代表羟基化脯氨酸[12-13]。为进一步研究芋螺毒素中脯氨酸羟基化修饰的功能,本研究应用化学合成的方法,制备了未经脯氨酸修饰的多肽lt3a和第6位为Hyp的lt3a[P6O],并进一步的对其氧化折叠效率、热稳定性和生物学功能进行了研究。该研究为阐明芋螺毒素羟脯氨酸的功能提供参考。
1 材料与方法
1.1 试剂
Fmoc保护修饰的氨基酸购自成都凯泰;Fmoc-L-4-Hydroxyproline购自J&K chemical Ltd.;树脂购自上海吉尔生化;氧化型和还原型谷胱甘肽(GSSG和GSH)购自Amresco公司。CHCA(α-Cyano-4-hydroxycinnamic acid)、DTT、碘乙酰胺、碳酸氢铵购自Sigma, ZipTip购自Millipore;其他试剂均为国产分析纯。
1.2 溶液配制
裂解液试剂R:φ, 三氟乙酸 90%,苯甲硫醚5%,二巯基乙烷3%,苯甲醚2%。
茚三酮指示剂: 2.5 g茚三酮固体溶于50 mL无水乙醇,充分振摇使固体完全溶解,保存在棕色试剂瓶中。
GSSG/GSH氧化溶液:100 mmol Tris-HCl,0.1 mmol EDTA,1 mmol GSSG, 1 mmol GSH,pH7.8。
任氏液:NaCl 6.5 g,KCl 0.14 g,CaCl20.12 g,NaH2PO40.01 g,pH 7.2,定容至1 L。
1.3 主要仪器
Waters公司Delta 600E高效液相色谱仪;C18反相柱为Waters公司Symmetry 300 C18色谱柱, 规格5 μm, 250 mm×4.6 mm;LABCONCO公司FREEZONE PLUS 12冷冻干燥机;美国Thermo公司LCQ DECA XP高效液相色谱-质谱联用仪(LC/MS);日本JASCO公司J-810圆二色谱仪;美国Accelry公司insight II分子模拟软件;成都泰盟科技有限责任公司BL-420E生物机能系统和神经屏蔽盒。
1.4 芋螺毒素lt3a和lt3a[P6O]的固相合成
参照文献方法进行[14],称取0.1 mmol的树脂,装入合成柱中,加入2-3 mL的w=20%哌啶/DMF脱去Fmoc保护。分别根据lt3a和lt3a[P6O]的序列,按C端到N端顺序,偶联上第一个氨基酸,脱Fmoc保护基团后,活化下一个氨基酸并加入柱中,继续去保护、活化,偶联,直到偶联上最后一个氨基酸,脱Fmoc保护基团后,加入2-3 mL裂解液至肽树脂,将合成的粗肽裂解下来,并用预冷的10倍体积乙醚沉淀和洗涤粗肽约5次,冻干备用。
1.5 lt3a和lt3a[P6O]氧化折叠比较
采用GSSG/GSH法进行多肽的氧化折叠,将精确称量的多肽固体,用小量体积的超纯水溶解后,加入到GSSG/GSH氧化溶液中,使终浓度为0.3 mg/mL。在室温下用磁力搅拌器进行搅拌,在所选时间点取样加入φ=0.8%的甲酸终止反应。并将多肽冻干浓缩体积,将冻干后的多肽用适当体积的φ=0.1%三氟乙酸溶解后直接上Waters公司的Symmetry 300 C18反相柱 (30 nm, 5 μm, 4.6 mm ×250 mm) 进行检测。线性梯度洗脱,程序如表1所示,同时检测215 nm和280 nm吸收峰,使用仪器自带分析软件进行谱图处理,根据保留时间和峰值判断多肽的氧化折叠情况。
表1 反相高效液相色谱洗脱梯度
Table 1 Gradient of reverse-phase HPLC

时间/min流速/(mL·min-1)A/﹪B/﹪曲线﹡1.0955﹡201.05956
A:φ=0.1%三氟乙酸;B: 乙腈
A:φ=0.1%TFA;B: Acetonitrile
1.6 多肽的质谱鉴定
多肽的质谱鉴定参照文献[15]所述方法进行,在中山大学测试中心的LC/MS上进行,直接将HPLC收集的目标峰取5 μL进样,在正离子模式下进行质谱检测。
1.7 lt3a和lt3a[P6O]的热稳定性比较
精确称量纯化好的lt3a和lt3a[P6O],配成终浓度为100 μmol/L的多肽溶液,在空气浴加热仪上100 ℃分别加热0.5、1、2、4和8 h。待冷却到室温后进行HPLC分析。
1.8 lt3a和lt3a[P6O]结构分析
lt3a和lt3a[P6O]圆二色光谱分析参照文献方法进行[16]:使用圆二色谱仪在25 ℃下测定远红外190-260 nm的光谱。测定样品的浓度为100 μmol/L,样品杯光径0.1 cm。分辨率0.5 nm,带宽1 nm,灵敏度50 mdeg,速度50 nm/s,数据用Origin6.0进行作图。
多肽三级结构模拟:使用分子模拟软件insightII (Accelry, USA)对这两个多肽进行结构的模拟。通过对lt3a序列的比对,根据M超家族内第3个环内氨基酸的数目分类方式,lt3a属于m-1家族。而之前的研究显示,m-1家族通常是1-5,2-4,3-6的二硫键连接方式。所以模拟采用m-1家族的连接方式形成二硫键。模拟条件设定:结构优化选择conjugate收敛方式,设置R值为0.001,每次计算1 000次。优化结构直到能量达到最低,构象不再变化为止,模拟出来的结构用pymol 软件进行显示。
1.9 lt3a和lt3a[P6O]对神经干复合动作电位的影响比较
按照生理学实验的方法制备蛙坐骨神经干标本: 蛙(蟾蜍)毁脑脊髓,去上肢和内脏,下肢剥皮浸于任氏液中,分离出坐骨神经,室温条件下将制备好的神经标本纵向放于神经屏蔽盒的电极上,接好刺激电极和记录电极。神经干应与每个电极密切接触。盒内注入少量任氏液,盖上盒盖,使神经盒封闭,防止神经干燥。进入BL-420E工作界面,选择实验项目-肌肉神经实验-神经干兴奋传导速度测定。引导、记录及观察蟾蜍坐骨神经干的复合动作电位:待引导出的复合动作电位较稳定后,将一小团加药棉花贴附在刺激电极和记录电极中间的神经上,间隔不同的时间进行记录和观察复合动作电位的变化。
2 结果与分析
2.1 lt3a与lt3a[P6O]的固相化学合成
为了研究羟脯氨酸的功能,首先应用固相化学合成的方法合成了没有羟基化修饰的多肽lt3a和第6位上为羟脯氨酸的多肽lt3[P6O],经过 RP-HPLC纯化后,进行氧化折叠,并对合成的多肽进行质谱检测,结果如图1所示,lt3a预测相对分子质量为1 859.5,质谱测定结果为1 859.3,lt3a[P6O]预测相对分子质量为1 875.5,质谱测定结果为1 877(938.5为二价离子峰),合成的多肽均与预期相符。
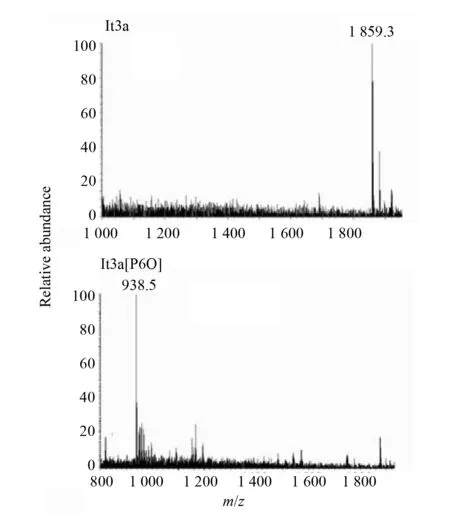
图1 lt3a和lt3a[P6O]合成多肽的质谱图Fig.1 Mass spectra of synthetic peptides lt3a and lt3a[P6O]
2.2 lt3a与lt3a[P6O]的氧化折叠比较
羟脯氨酸在胶原及某些芋螺毒素中具有促进蛋白或多肽进行正确折叠的功能,本研究试图通过比较lt3a和lt3a[P6O]氧化折叠的差异,以验证羟脯氨酸对毒素体外氧化折叠时形成正确构象的影响。尚未氧化折叠的lt3a和lt3a[P6O]在氧化/还原型的谷胱甘肽溶液中进行折叠反应,分别取不同时间点用甲酸终止后进行反相HPLC检测。得到的谱图如图2所示,通过Empower软件对目的峰进行积分,计算出各时间点的正确折叠产物的得率,作出时间-得率图如图3所示。从图2和图3中lt3a和lt3a[P6O]的氧化折叠比较发现,lt3a[P6O]在90 min时就达到了氧化折叠的终点,而lt3a在120 min以后才到了氧化折叠的终点。由表2可知,lt3a[P6O]和lt3a的折叠终产率分别为39.9%和40.6,没有显著差异,说明Hyp对氧化的终产率没有太大的影响,这可能跟lt3a本身就具有较高的氧化折叠效率有关。但是lt3a[P6O]的氧化折叠速率是lt3a的两倍。说明Hyp的存在提高了折叠速率,使lt3a[P6O]更早地达到氧化终点。

表2 lt3a和lt3a[P6O]的最终得率和折叠速率Table 2 Folding product and kinetics of lt3a and lt3a[P6O]
图2 lt3a和lt3a[P6O]不同氧化折叠时间的HPLC分析Fig.2 HPLC analysis of lt3a and lt3a[P6O] in different oxidative folding time
图3 lt3a和lt3a[P6O]氧化折叠速率比较图Fig.3 Folding kinetics of conotoxins lt3a and lt3a[P6O]
2.3 lt3a和lt3a[P6O]的结构比较
首先对合成的多肽lt3a和lt3a[P6O]进行圆二色谱的测定,图4的结果表明, lt3a和lt3a[P6O]的二级结构主要由β结构组成, 含有部分自由卷曲,没有α-螺旋结构,两种多肽的圆二色谱图极其相似,都在201 nm处有一个特征吸收峰。这说明羟化脯氨酸的存在对lt3a的二级结构没有显著的影响。
图4 lt3a和lt3a[P6O]的圆二色谱图Fig.4 Far uv of circular dichroism spectra of lt3a and lt3a[P6O]
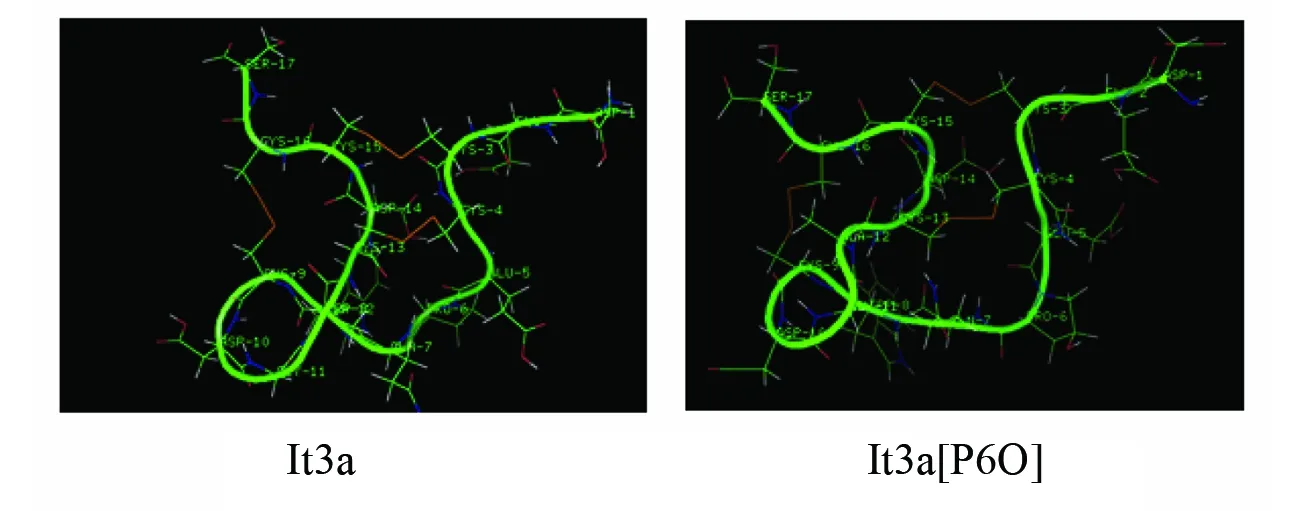
图5 lt3a和lt3a[P6O]的分子结构模拟Fig.5 The molecular structure simulation of lt3a and lt3a[P6O]
进一步的应用模拟软件insightII对lt3a和lt3a[P6O]进行三维结构模拟,结果表明结果lt3a[P6O]与lt3a的三级结构类似(见图5),lt3a[P6O]在C端形成一个大的略扭曲的Loop环。羟脯氨酸的存在没有对lt3a整体的结构产生明显的影响。
2.4 lt3a和lt3a[P6O]的热稳定性比较
合成并纯化后的lt3a和lt3a[P6O]在100 ℃的空气浴中处理不同时间后,用HPLC检测毒素的降解情况,应用Empower软件对峰面积进行积分后,计算出不同处理时间点的未降解毒素比率,作出时间和未降解毒素的曲线图,结果如图6所示。芋螺毒素lt3a[P6O]的降解速度略快于lt3a,两者在100 ℃下经过8 h的解热,都发生了完全的降解。说明Hyp对热稳定性影响不大。
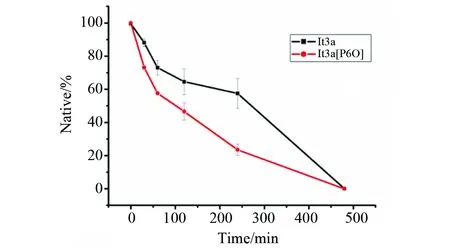
图6 lt3a和lt3a[P6O]热稳定性比较Fig.6 Comparison of thermal stability between lt3a and lt3a[P6O]
2.5 lt3a和lt3a[P6O]对神经干复合动作电位的作用比较
本实验分别在两种浓度下测定了lt3a和lt3a[P6O]对神经干复合动作电位的抑制活性。由图7的结果知,在低浓度(0.25 mmol/L)下,lt3a与其羟化脯氨酸异构体lt3a[P6O]具有相同的动作电位抑制活性,在高浓度下(2.5 mmol/L),用药后前15 min内,lt3a起效更快,用药20 min时,两者达到相同的抑制活性,该结果说明Hyp的存在对毒素的活性影响不大。
图7 lt3a和lt3a[P6O]对神经干复合动作电位的作用Fig.7 The effect of lt3a and lt3a[P6O] on compound action potential of nerve trunk
3 讨 论
羟脯氨酸是哺乳动物中常见的一种经翻译后修饰的氨基酸,由脯氨酸经脯氨酸羟化酶(prolyl hydroxylase)催化生成,一般羟化发生在4位上。这种氨基酸在哺乳动物的胶原蛋白、补体成分C1q和乙酰胆碱酯酶(AChE)等蛋白中广泛存在[17]。在非脊椎动物线虫的微胶原蛋白(minicollagen)[18]以及芋螺的毒素多肽中也有发现。羟化脯氨酸在胶原蛋白中的功能已经得到了阐明[19-21]。研究发现,胶原蛋白中脯氨酸选择性的羟化是蛋白合成后的分泌以及三级螺旋结构的形成所必需的。在本研究中我们通过合成羟脯氨酸的取代物,验证了羟脯氨酸能够帮助芋螺毒素的体外折叠,其原因推测可能是由于脯氨酸肽键和羟脯氨酸肽键在溶液中具有不同的顺反异构(cis-trans isomerizaiton)转换率有关[22]。正常肽键反式构象的能量比顺式构象的能量低约2.5×4.184 J/mol,所以自然状态下的肽键绝大多数采取的是反式构象,顺式肽键在蛋白中很少见。但是脯氨酸肽键的反式构象能量仅比顺式构象低约0.5×4.184 J/mol,且顺反异构的能量壁垒是13×4.184 J/mol,而正常肽键的能量壁垒为20×4.184 J/mol[23]。脯氨酸肽键在适当条件下可以克服这个能量壁垒进行构象转换。而且羟脯氨酸的存在使多肽的构象更快到达平衡状态,从而加快了折叠的效率。
虽然脯氨酸的羟化修饰可能会带来体外折叠效率的提高,但在体内是否也有相同的作用以及是否需要用这种修饰来促进毒素折叠还不得而知。不过脯氨基-4-羟化酶(prolyl-4-hydroxylase, P4H)的一个亚基与蛋白二硫键异构酶(protein disulfide isomerase, PDI)高度同源[18],有可能在体内也会对毒素多肽的折叠产生一定的影响。然而目前还没有研究表明P4H具有体内催化多肽氧化折叠的作用。
对lt3a和lt3a[P6O]热稳定性的研究发现,羟脯氨酸的存在没有增加芋螺毒素lt3a的热稳定性,而哺乳动物中胶原蛋白则可以提高其热稳定性,此外,圆二色谱的结果显示lt3a和lt3a[P6O]都没有α螺旋,这可能解释了羟脯氨酸在芋螺毒素中没有增加热稳定性的原因,是与lt3a没有螺旋结构以及足够多的Hyp有关。胶原蛋白具有稳定的三股螺旋结构,而羟脯氨酸如星罗点缀于其间,羟基伸向螺旋外侧吸引着水分子,与水分子形成“水桥”,氢键的形成大大提高了胶原蛋白的热稳定性。芋螺毒素和胶原蛋白的结构完全不同,所以羟脯氨酸在它们之中的作用也大有差异。同时,羟脯氨酸对lt3a的活性似乎也没有太大的影响,从组织水平上的实验看来,lt3a和lt3a[P6O]具有相同的抑制动作电位的活性。可能是羟脯氨酸的氢键和受体分子没有相互作用,所以不影响毒素的活性。
——从一道浙江选考生物学试题谈起

