预氧化对一种镍基单晶高温合金的热腐蚀影响
王盼航,余竹焕,张 洋,刘蓓蕾
(西安科技大学 材料科学与工程学院, 西安 710054)
镍基高温合金由于具有良好的高温强度以及组织稳定性,被广泛应用于发动机涡轮叶片、地面燃气轮机等热端部件,其所占的质量百分比越来越高[1].高温合金的工作环境通常非常的苛刻,在长期服役的过程中会经受高温氧化和腐蚀的损坏,极易造成灾难性后果[2].高温合金的热腐蚀过程分为起始阶段和增长阶段, 热腐蚀环境多种多样,最常见的是Na2SO4- NaCl的沉积盐膜腐蚀.纯的Na2SO4和NaCl盐的熔点分别为884℃和801℃,当合金发生热腐蚀的温度高于884℃时Na2SO4-NaCl体系是完全熔融的,发生的热腐蚀为高温热腐蚀.涂盐腐蚀实验能够有效的模拟合金的热腐蚀环境,其起始阶段较短[3].Na2SO4-NaCl盐膜积聚在合金的表面,在高温下会引起严重的热腐蚀并加速合金的失效[4-8].因此需要对合金进行表面处理,以防止或延缓合金的氧化和腐蚀,延长合金的使用寿命,例如在合金表面涂覆金属或陶瓷涂层[9-11]等.
前人研究出了有代表性的MCrAlY 型(M=Co,Ni或它们的组合)涂层等来抵御恶劣的热腐蚀环境[12].但由于涂层的制备工艺相对复杂,且成本高;而采用预氧化处理能够使合金氧化形成优良致密的氧化膜,阻碍合金在工作期间的氧化和腐蚀,且制备、实施工艺步骤相对简单.研究发现,预氧化处理有利于提高材料的抗氧化[13-14]和盐雾腐蚀[15]性能.刘晓亮[16]发现预氧化生成的Cr2O3氧化膜能够明显降低Fe-20%Cr合金的热腐蚀速率,减轻腐蚀对基体的破坏.谈萍等[17]人研究指出预氧化处理生成了比较连续、致密的Al2O3氧化膜阻挡层,有效地阻止了硫分子和金属离子的扩散,极大地提高了Fe-Cr-Al多孔材料的抗硫化腐蚀性能.Liu等[18]人研究发现氧化物保护膜可以有效降低DZ68合金的腐蚀速率,当氧化层受损,腐蚀速率就会增加,并伴随着腐蚀产物的明显剥落.
关于通过预氧化来提高合金抗腐蚀性能的研究很少,而针对相同预氧化处理温度和较短的预氧化时间下的热腐蚀研究尚未有报道.本实验在900℃下预氧化并在该温度下研究高温合金在Na2SO4-NaCl盐膜条件下的热腐蚀行为.通过腐蚀动力学,横截面微观结构的观察确定了影响,旨在更好地为高温耐热腐蚀合金提供成分设计参考.
1 实 验
本实验所采用材料为一种第一代镍基单晶高温合金,其主要成分为 (wt,%):C0.045、Co5.34、Al6.02、W4.88、Mo2.25、Ti1.94、Ta3.94、Cr7.82、余量为Ni.采用籽晶法在高梯度定向凝固炉中制备出抽拉速率为200 μm/s,温度梯度为300~400 K/cm的单晶高温合金.将合金加工成Φ4 mm×70 mm 的试棒,经800#~2 000#砂纸的磨制与抛光后用丙酮清洗表面,吹干表面后用BSA224S型电子天平称重(感量为0.1 mg).在900 ℃的空气中分别预氧化处理3、6、9 h,然后将试样冷却至室温.将饱和75%Na2SO4-25%NaCl盐溶液(体积比3∶1)均匀涂覆在试样的表面,通过称重控制涂盐量在2 mg/cm2左右,然后将涂盐试样放入耐高温的Al2O3瓷舟内,将瓷舟置于SK-2.5-13S型管式炉中随炉升温至900 ℃,保温10 h.平行试样为每组3个,每隔2 h将试样取出称重记录数据并再次涂盐.热腐蚀结束后,把瓷舟从管式炉中取出,待冷却后取出试样,用超声波沸水将试件表面的盐分除去,然后称重.用MH-5L金相显微镜,JSM-6390A扫描电镜及XRD-7000自动X 射线衍射仪对腐蚀产物的相组成进行分析,用分散X射线光谱法(EDS)对表面和横截面的形态和组成进行表征.
2 结果与分析
2.1 合金的热腐蚀增重
图1所示为经不同预氧化时间处理的合金以及未经预氧化处理的原始合金在900 ℃、75%Na2SO4-25%NaCl盐膜条件的热腐蚀动力学曲线.由图可知,未经过预氧化处理的合金的腐蚀动力学曲线遵循抛物线规律;合金在2~4 h区间的腐蚀增重最快,热腐蚀速率约为5× 10-3mg/cm2·h;在热腐蚀10 h的增重质量最多,约为0.033 mg·cm-2,之后还有继续增加的趋势.经过预氧化处理后的合金热腐蚀速率明显降低,其中预氧化9 h的腐蚀速率最低,腐蚀增重变化最小;预氧化3 h的腐蚀速率略低于未氧化的腐蚀速率,这是由于合金在预氧化3 h后表面并未形成完整的氧化膜抵御腐蚀侵袭, 合金外部的O、S元素能够通过氧化层
图1合金在900℃75%Na2SO4-25%NaCl中的腐蚀动力学曲线
Fig.1 Corrosion kinetics curves of alloy coated with 75% Na2SO4-25% NaCl in air at 900 ℃
侵入基体;而预氧化6 h则介于两者之间.与未经过预氧化处理的合金相比,经过预氧化后的合金显著地降低了腐蚀速率,具有更好的耐热腐蚀性能.在0~2 h区间内增重曲线出现下降趋势,是由于涂敷在表面的腐蚀介质在高温下部分蒸发导致质量减少所致.
2.2 腐蚀产物分析
图2为热腐蚀后合金试样表面的XRD分析结果.可以看出, 经4种方法处理合金的腐蚀产物不完全相同.未经过预氧化处理的合金,表面腐蚀产物主要是NiO,并有少量TiC、NiS2、Al2O3和TiO2.经过预氧化处理的合金,表面腐蚀产物主要为NiO及NiCr2O4,Al2O3和TiO2.未经过预氧化处理的合金热腐蚀后出现了峰值较弱的NiS2,而在预氧化3、6、9 h后逐渐消失.NiS2的出现是由于合金表层的O、S等元素通过缺陷扩散侵入基体,与基体发生反应所形成.研究发现,随着预氧化时间的增加,预氧化处理形成的致密Al2O3,TiO2氧化膜,能够有效阻止O、S元素的扩散,降低合金的热腐蚀速率.
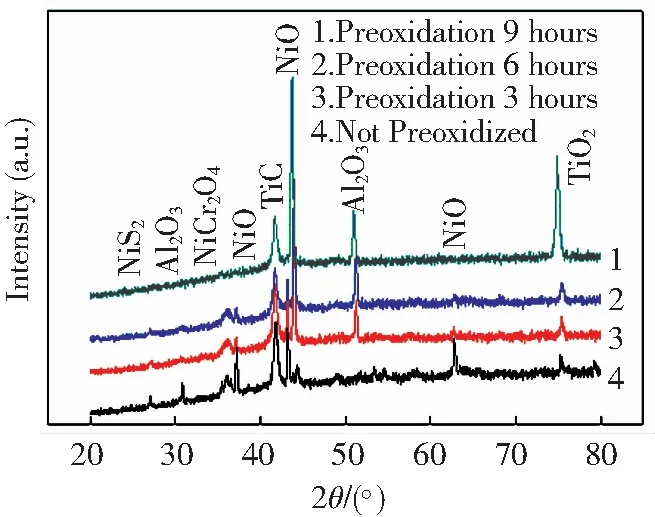
图2合金在900℃75%Na2SO4-25%NaCl下的热腐蚀XRD图谱
Fig.2 Hot corrosion XRD pattern of alloy coated with 75% Na2SO4-25% NaCl in air at 900 ℃
2.3 合金的热腐蚀
2.3.1 腐蚀产物的表面形貌
图3所示为经不同预氧化时间处理的合金以及未经预氧化处理的原始合金保温10 h后在金相显微镜下的表面形貌照片.从图3可以看出,未经过预氧化的合金表面有明显的大的腐蚀凹坑,热腐蚀非常严重.经过预氧化的合金表面凹坑小且少,随着预氧化时间的增加合金的耐热腐蚀性能得到了显著提升.观察合金热腐蚀后的表面形貌,发现合金的腐蚀呈不均匀分布.导致合金腐蚀不均匀的原因可能是合金未经过热处理内部组织的不均匀性导致,也可能是由于涂敷在合金表面75%Na2SO4-25%NaCl混合盐溶液的不均匀分布导致,也存在两者共同作用的可能.

图3 合金在900 ℃75%Na2SO4-25%NaCl下的表面形貌
Fig.3 Surface morphology of alloy coated with 75% Na2SO4-25% NaCl in air at 900 ℃ (a) preoxidation 3 h; (b) preoxidation 6 h; (c) preoxidation 9 h; (d) not preoxidazed
2.3.2 腐蚀产物截面形貌
图4(a)为预氧化3 h试样的腐蚀截面,观察其腐蚀层厚度约为120 μm,腐蚀外层约50 μm;图4(b)为预氧化6 h试样的腐蚀截面,其腐蚀层厚度约为100 μm,腐蚀外层约30 μm;图4(c)为预氧化9 h试样的腐蚀截面,其腐蚀层厚度约为80 μm,且并未出现明显的分层现象.研究发现,随着预氧化时间的增加,合金的腐蚀层厚度显著减小,合金的热腐蚀抗力逐渐增强.从图中可以看出:预氧化3 h试样出现了明显的分层现象,6、9 h分层并不明显,而且预氧化6和9 h也比3 h的热腐蚀更加均匀,这是由于预氧化6和9 h生成的氧化膜成分更加均匀致密,抵御腐蚀更充分有效.图4(a)EDS选区成分分析,腐蚀外层的元素主要是O、Cr、Ni、Al.黑色的腐蚀产物为富铝的氧化物,即为Al2O3;亮白色的腐蚀产物为富镍的氧化物,即为NiO.随着预氧化时间的延长,氧化层外层形成的尖晶石相NiCr2O4[19]含量逐渐减少,Al2O3含量逐渐增多,合金的耐腐蚀性能大幅度提高.EDS分析腐蚀内层O、S元素含量降低,主要元素为合金基体元素,表明预氧化形成的致密氧化膜能够有效的隔绝了基体与外界的联系[20].

图4 合金在900 ℃75%Na2SO4-25%NaCl下的截面SEM形貌
Fig.4 Cross-section SEM morphology of alloy coated with 75% Na2SO4-25% NaCl in air at 900 ℃: (a) preoxidation 3 h;(b) preoxidation 6 h;(c) preoxidation 9 h
研究发现,熔融态的NaCl和合金表面预氧化生成的Cr2O3发生反应,生成了易挥发的金属氯化物[21],因此也是导致腐蚀初始阶段(<2 h)重量减轻的原因之一.而未经过预氧化的合金并未发生上述反应,因此在腐蚀的开始阶段便发生了迅速增重的现象.合金在热腐蚀发生的后期,表面主要发生的是选择性氧化反应,生成了Ti、Cr、Ni和Al的氧化物,随着腐蚀过程的进行,预氧化生成的氧化膜与熔融盐发生反应而逐渐失效.
腐蚀过程生成的易挥发性氯化物通过缺陷进行扩散,由于氧分压的升高而又重新转变为氧化物出现,而释放出的氯元素再次进入基体参与反应,如此循环,直到氧化膜消耗殆尽.预氧化过程中产生的氧化物的热膨胀系数各不相同,在较高热腐蚀温度条件下,氧化层内部会产生非常大的应力,会导致预氧化形成的混合氧化物膜表面产生裂痕,氧化膜的完整性将会遭到破坏.熔盐中含有的Na2SO4在高温下分解产生的S元素通过氧化膜中的裂纹或缺陷进入合金基体,与合金中的元素反应生成硫化物.
(1)
合金在900 ℃下形成的致密Al2O3层能够明显的阻碍S元素的扩散,随着预氧化时间的延长,硫化孕育期也延长[22].试验中发现经预氧化3、6、9 h后的硫化物(NiS2)含量逐步减少.本试验结果可以用硫化氧化理论[23-28]加以解释.
首先,硫酸钠中还原出的硫与合金中的镍元素发生反应生成NiS,然后与金属接触生成金属-金属硫化物液态共晶.
Ni+2S=NiS2,
(2)
Ni+NiS2=Ni·NiS2(共晶) .
(3)
其次,硫化物共晶被穿过盐膜的氧分子所氧化释放出硫化物,重新与金属基体的组元形成新的共晶.
(4)
Ni+NiS2=Ni·NiS2(共晶) .
(5)
合金在预氧化过程中消耗了大量的O元素,生成了Al2O3、TiO2等氧化产物,在有效的预氧化时间内这些产物持续产生,最终形成了致密的氧化物保护层.预氧化形成的氧化层可以防止外界环境中的O、S元素侵入基体,同时也可以消耗合金内因热腐蚀而产生的O元素.预氧化处理抑制了热腐蚀反应中与O元素结合的反应步骤,式(4),进而阻碍了合金热腐蚀循环反应的进行,提高了合金的耐热腐蚀性能.而热腐蚀形成的NiO产物与形成的Cr的氧化产物反应形成尖晶石型氧化物NiCr2O4(式6),促进了热腐蚀循环反应的进行.由EDS
NiO+Cr2O3=NiCr2O4.
(6)
分析,Cr元素含量的强度峰值从预氧化3 h~9 h逐渐降低,Cr的氧化物含量降低,公式(6)的反应被抑制,导致NiCr2O4相含量降低.这与XRD的分析结果相一致,由图2可以看出,NiCr2O4相的峰值从未预氧化到预氧化9 h逐渐减缓,而TiO2氧化物的峰值却呈相反的趋势.随着预氧化时间的延长,合金表面的O元素更多的是与Ti元素结合,从而与Cr元素形成了竞争机制,TiO2氧化物含量的增多伴随着Cr的氧化物含量的降低.因此,预氧化处理能够有效的提高合金的耐热腐蚀性能,而热腐蚀过程中产生的腐蚀产物可能会对合金的耐热腐蚀性能产生不利的影响.
2.3.3 化学反应热力学计算
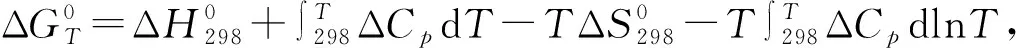
表1化学反应的ΔH,ΔG计算值
Table 1 Calculated values of ΔHand ΔGkJ/mol
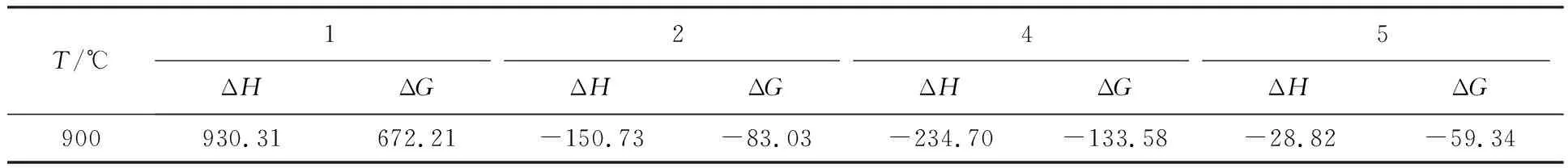
合金在900 ℃下发生热腐蚀反应主要是通过元素在基体内部的相互扩散发生的,表1中有ΔG4<ΔG2<ΔG5<ΔG1,且ΔH与ΔG的大小呈现相同的次序.分析发现,式(1)的ΔG最大,而式(4)ΔG最小,当合金的热腐蚀温度达到一定范围,Na2SO4发生分解(式(1))产生硫元素;硫元素进而与合金发生自发反应形成硫化物(式(2)、(3));而硫化物与氧结合的反应(式(4))在900 ℃下能够迅速进行,促进热腐蚀反应的进行.可以看出,式(4)反应对合金热腐蚀产生的影响非常大,而预氧化对其形成的竞争机制能够有效阻碍热腐蚀的进行.
3 结 论
1) 未经预氧化处理的合金在高温下被严重侵蚀,在2~4 h区间的热腐蚀速率最快,约为5× 10-3mg/cm2·h,热腐蚀10 h后热腐蚀增重质量最多,约为0.033 mg·cm-2,且合金表面存在较大且不均匀的腐蚀凹坑.
2)经过预氧化产生的腐蚀层厚度随着预氧化时间的增加从170 μm降低至80 μm,在较短的热腐蚀时间下,预氧化处理能够显著提高合金的耐热腐蚀性能.
3)在900 ℃较短的腐蚀时间下,合金经预氧化处理后,合金的热腐蚀均匀地向基体推进,且腐蚀增重明显减小;预氧化生成的Al2O3层对合金在Na2SO4-NaCl盐膜下的热腐蚀起保护作用,能降低腐蚀速率,减轻腐蚀对基体的破坏并维持氧化膜的完整性.
4)合金热腐蚀过程中主要发生氧化与硫化反应,腐蚀产物主要有NiO、Al2O3、NiCr2O4、TiO2、NiS2,致密的氧化物保护层能够显著阻止硫元素的扩散,提高合金的耐热腐蚀性能.

