miR-21下调程序性死亡细胞4对抑制裸鼠肾细胞癌肿瘤转化和增殖的实验研究
吴佳成,陆雅君,姜力
肾细胞癌(RCC)是第三种最常见的泌尿系癌[1],其中一些RCC患者发生转移性疾病,而这些患者的5年生存率仅为2%[2],因此,对新的治疗方法进行进一步的筛选和研究是十分必要的。
miRNAs是一种非编码的小RNA[3-4],它的异常表达与人类疾病有关,尤其是恶性肿瘤。有越来越多的报道显示某些miRNA的异常表达可导致肿瘤生长或者减弱恶性肿瘤对放化疗的敏感度[5-6]。miR-21的过表达参与了与癌发生相关的各种过程,包括抑制凋亡、促进细胞增殖和刺激肿瘤生长[7-8]。程序性细胞凋亡因子4(PDCD4)已被证明是肿瘤转化的抑制剂。PDCD4基因在小鼠表皮克隆遗传变异体JB6细胞系统中的表达产物被鉴定为64 kDa蛋白质,在抗肿瘤细胞中优先表达[7,9]。研究表明PDCD4含有miR-21结合位点,并通过调节与癌症进展相关的各种过程而起到肿瘤抑制剂的作用[7-10]。有研究证明miR-21在RCC组织和细胞系中显著过度表达,而PDCD4受miR-21负调控[11]。
本研究的目的是确定PDCD4和miR-21在裸鼠肾癌模型中的作用和两者之间的相互作用,以及沉默PDCD4对RCC肿瘤细胞生长和侵袭的影响,而这有望成为治疗肾癌的有效新策略。
1 材料与方法
本实验于2017年9月—2018年1月于中国医科大学沈北新校区实验中心完成。本研究严格按照我国“国家卫生研究院实验动物护理和使用指南”的建议,所有手术均在1%戊巴比妥钠麻醉下(70 mg/kg)进行,并尽一切努力减少动物痛苦。
1.1 饲养裸鼠和细胞培养物 雄性BALB/c裸鼠(n=40)获自中国医科大学动物实验中心。周龄5~6周,体质量20~23 g,在20~26℃的SPF(无特定病原体)食物条件下,实验前饲喂1周,相对湿度40%~70%和12 h的明暗循环。所有食物都用高温蒸汽消毒(45 min,120℃)进行处理。所有的水用盐酸酸化并调节至pH 2.5~2.8。肾细胞癌786-O细胞获自中国医学科学院协和医学中心(北京),并在细胞库建议的条件下培养。试剂:0.05 mg/ml牛垂体提取物、5 ng/ml人重组表皮生长因子,50 mg/ml青霉素和50 mg/ml链霉素(美国赛默飞世尔科技公司),10%胎牛血清(美国亚特兰大生物制品公司)。将细胞维持在37℃的潮湿空气和5%CO2的培养箱中。染料木黄酮和10%二甲基亚砜(15ml)处理亚混合的786-O细胞(60%~70%混合)。
1.2 RNA干扰测定 在转染前将786-O细胞(1×106个细胞,60%~80%混合)在不含抗生素的6孔组织培养皿中温育24 h。用PDCD4 siRNA和阴性对照siRNA转染786-O细胞,并研究沉默PDCD4对肿瘤细胞生长、增殖和侵袭的影响。将小干扰RNA(siRNA)转染试剂复合物(#AM16708A; Invitrogen; Thermo Fisher Scientific,Inc。)与Lipofectamine 2 000(Invitrogen; Thermo Fisher Scientific,Inc。)混合,随后加入细胞。在本研究中使用的siRNA的序列如下:NC siRNA引物序列,5'-GCUGCUUTGGACAAGGCUATC-3'和5'-UAGCCUAGUCCAAAGCAGCAT-3';PDCD4 siRNA引物序列,5'-GCUGCUUUGGACAAGGCUATT-3'和5'-UAGCCUUGUCCAAAGCAGCTT-3'。在37℃孵育6 h后,更换培养基并将细胞在补充有10%热灭活的FBS的RPMI-1640(Gibco; Thermo Fisher Scientific,Inc。)中培养不同的时间。同时,用对照siRNA作为对照组转染细胞。
1.3 裸鼠肾癌模型建立 将24只雄性裸鼠按随机数字表法分为3组以调查miR-21的作用:阴性对照组(NC,n=8),miR-21模拟物组(n=8)和miR-21抑制剂组(n=8)。将0.1 ml 786-O细胞悬液(1×106个细胞)皮下移植到小鼠的腋下,随后每天注射NC siRNA(#AM17110; Invitrogen; Thermo Fisher Scientific,Inc。),pre-miR-21(模拟)或抗miR-21(抑制剂)(#A25576; Invitrogen; Thermo Fisher Scientific,Inc。)。引物的序列如下:pre-miR-21引物序列,5'-CATCCTUCUTGAAGUGACUC-3'和5'-CGCUCUAUGACGUAUGGAGGU-3';抗miR-21引物序列,5'-GATCCAUCUTCGAAGUGACTT-3'和5'-UGCUCU TUGACGUAUGGAGTT-3'; NC siRNA引物序列,5'-UUCACCGUACGUCUCACCUGT-3'和5'-ACUGGAACCUCUCGCGGAATT-3'。进行MTT分析(Roche Diagnostics GmbH,Mannheim,Germany)以检测细胞活力。将细胞接种到96孔板(6.0×103个细胞/孔)中并在正常培养条件下放置。将细胞与MTT(每孔5 mg/ml)一起温育4 h。用二甲基亚砜溶解甲crystals晶体。使用PBS作为对照。使用Infinite M200 PRO多模式酶标仪(Tecan Benelux BVBA,Mechelen,Belgium)测量490 nm波长处的吸光度。在注射细胞之前检测细胞活力以确保细胞处于对数期。移植后共16 d,肿瘤形成率为100%,处死小鼠,收集肿瘤并称重。使用逆转录—定量聚合酶链式反应(RT-qPCR)分析癌组织中miR-21和PDCD4 mRNA的表达。
1.4 使用免疫组织化学和蛋白质印迹 将16只BALB/c雄性祼鼠按随机数字表法分为2组:NC(n=8)和PDCD4siRNA(n=8)。将786-O细胞皮下移植到小鼠的腋下,然后每日注射NC siRNA或PDCD4 siRNA(#AM16708A; Invitrogen; Thermo Fisher Scientific,Inc。)。 NC siRNA,5'-GCUGCUUTGGACAAGGCUATC-3'和5'-UAGCCUAGUCCAAAGCAGCAT-3'; PDCD4 siRNA,5'-GCUGCUUUGGACAAGGCUATT-3'和5'-UAGCCUUGUCCAAAGCAGCTT-3'。移植后将肿瘤从小鼠中取出并称重16 d。将戊巴比妥钠(150 mg/kg,1%)注射到每只小鼠中进行安乐死。
1.5 免疫组化染色 对于免疫组织化学分析,将小鼠癌组织用10%福尔马林缓冲液固定并包埋在石蜡中。切片(2 μm厚)在使用前1天切割。所有切片脱蜡并用分级乙醇脱水(99%、95%、85%和75%)。然后将切片在磷酸盐缓冲盐水(PBS,pH7.2; 37℃)中洗涤10 min。通过在室温下在含有3%H2O2的甲醇中温育10 min来淬灭内源性过氧化物酶活性,然后在95℃加热30 min以修复抗原并最终用PBS洗涤。为了最大化免疫组织化学信号,使用以下2种策略:柠檬酸盐缓冲液中的抗原修复和生物素化酪胺的信号放大。将组织切片在4℃用PDCD4抗体(稀释液,1∶100;#ab105998; Abcam,Cambridge,UK)温育过夜。随后使用生物素化山羊抗兔抗体(稀释度,1∶5 000;#SAB4504290; Sigma-Aldrich; Merck KGaA)进行检测,并将组织切片在37℃孵育20 min。使用二氨基联苯胺作为发色团,并将载玻片用Mayer's苏木精复染。由2位病理学专业人员在400倍的荧光显微镜(Olympus BX41; Olympus Corporation,Tokyo,Japan)下独立观察结果。NC组一抗用10%非免疫山羊血清代替[6]。
1.6 Western印迹分析 进行蛋白质印迹分析以确定PDCD4的表达。根据制造商的建议,使用总蛋白提取试剂盒(南京凯基生物技术有限公司)从组织提取总蛋白。使用BCA测定试剂盒(南京Keygen生物技术有限公司)测量蛋白质的浓度。使用SDS-PAGE将蛋白质样品在10%聚丙烯酰胺凝胶上分离,并转移到hybond polyvinylidene difluoride膜(GE Healthcare Bio-Sciences,Pittsburgh,PA,USA)上。随后将膜在室温下在5%无脂牛奶中封闭2 h。在4℃孵育过夜后,用兔或针对PDCD4(1∶10 000;目录号ab80590; Abcam)或GAPDH(1∶200; Santa Cruz Biotechnology,Inc.,Dallas,TX,USA)的山羊一级抗体温育过夜,在室温下以1∶5 000的稀释度用山羊抗兔(#SAB2502080; Sigma-Aldrich; Merck KGaA)或小鼠抗山羊二抗(#G8795; Sigma-Aldrich; Merck KGaA)探测膜2 h。使用Super Enhanced Chemiluminescence Plus试剂盒(南京Keygen生物技术有限公司)检测信号并使用UVP软件(BioDoc-It成像仪系统; UVP,LLC,Upland,CA,USA)定量。使用积分光密度(IOD)比值IO DPDCD4 / IOD GAPDH来表示PDCD4蛋白在280 nm波长处的相对表达[10]。
1.7 RT-qPCR分析 按照生产商的方案,使用RNA分离试剂盒从肿瘤中提取总RNA。如前所述进行成熟miR-21的茎环RT-qPCR(28)。使用PowerSYBR Green PCR Master混合物(Agilent Technologies,Inc.,Santa Clara,CA,USA)以20 μl的终体积进行PDCD4的RT-qPCR,所述终体积包含100 ng cDNA,10 μl主混合物,1 μl ROX和每个引物0.4 pmol/μl。 qPCR循环条件如下:95℃ 2min,然后95℃ 15 s 和55℃ 30 s,40个循环,接着60℃ 1 min。熔化曲线是65~95℃。人类U6 mRNA用于标准化茎环RT-qPCR,GAPDH用于标准化PDCD4 RT-qPCR。将荧光信号正常化至这些内参基因,并将阈循环(Cq)设定在PCR的指数阶段内。通过比较每个靶PCR的循环时间来计算相对基因表达。目标PCR Cq值通过减去提供Cq值的U6或GADPH Cq值进行标准化。然后使用以下等式计算处理之间的相对表达水平:相对基因表达=2(Cqsample-Cq对照)[11]。
1.8 EdU掺入细胞增殖测定 将转染的786-O细胞以4×104个细胞/孔的密度接种于24孔板中,使其黏附5 h时,用PBS洗涤,然后在含有10 μmol/L EdU(广州瑞宝生物工程有限公司广州,中国)在37℃孵育2 h。随后用PBS洗涤细胞,然后在含有2%甲醛,0.5%Triton X-100和300 mmol/L蔗糖的PBS中37℃固定并透化15 min。用PBS洗涤后,使用10%FBS的PBS溶液在环境温度下封闭细胞30 min,并通过与荧光叠氮化物偶联溶液(#C10310-3; Apollo;广州RiboBio有限公司)一起孵育以检测掺入的EdU,在环境温度下30 min,用含有0.05%Tween-20的PBS洗涤细胞3次,用DNA染色染料Hoechst 33342孵育30 min钟并用PBS洗涤。使用荧光显微镜拍摄图像,并从5个不同视野中随机选择的≥50个非S期细胞计算核荧光强度。
1.9 软琼脂克隆形成测定 除5×102个转染的786-O细胞外,用含10%FBS、100 U/ml青霉素和100 mg/ml链霉素的RPMI 1640培养基制备板的顶层(0.3%低熔点琼脂糖)。 培养板在37.8℃和5% CO2的恒温培养箱中培养。 在第14天捕获平板的图像,并使用Quantity One软件(版本4.0.3; Bio-Rad Laboratories,Inc.,Hercules,CA,USA)定量集落的数量。 测定进行3次。 数据以平均值表示。
1.10 细胞侵袭测定 使用Transwell小室(BD Biosciences,Franklin Lakes,NJ,USA)进行细胞侵袭测定。 使用转染的NC siRNA细胞作为对照组。 测定进行3次。 在侵袭测定中,将2×104个在无血清培养基中转染的细胞接种到用Matrigel(BD Biosciences)预先包被的顶部室中。 在37℃孵育24 h后,使用甲醇(100%)将膜固定,然后用0.1%结晶紫染色。 在光学显微镜下计数通过膜的细胞数量[1]。
1.11 统计学方法 采用SPSS 22.0统计软件分析所有数据。正态分布计量数据用均数±标准差表示,采用t检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 miR-21的沉默抑制小鼠肾癌模型中的肿瘤生长 为研究miR-21抑制剂是否抑制肿瘤生长,在miR-21抑制剂治疗后测量肿瘤的重量。3组(NC、miR-21模拟物和miR-21抑制剂)的裸鼠模型的肿瘤质量比较见图1A。与NC组相比,miR-21模拟组的肿瘤重量显著增加(t=10.31,P<0.01),miR-21抑制剂组的肿瘤重量显著降低(t=8.52,P<0.01)。
2.2 miR-21表达的下调增加小鼠肾癌模型中PDCD4蛋白的表达 为评估裸鼠RCC模型中PDCD4和miR-21之间的关联,确定用miR-21模拟物或miR-21抑制剂移植786-O细胞是否影响PDCD4的表达。与NC组相比,miR-21抑制剂下调内源性miR-21导致PDCD4蛋白表达显著增加(t=5.89,P<0.01)。相反,与NC组相比,miR-21模拟组PDCD4蛋白水平显著降低(t=6.58,P<0.01),见图1B、C。与NC组相比,miR-21模拟物组表达显著上调,而miR-21抑制剂组显著降低(t=12.11,P<0.05),见图1D。然而,3组间PDCD4 mRNA表达无显著差异(P> 0.05),见图1E。
PDCD4的免疫组织化学分析,表明PDCD4定位于细胞质。在miR-21模拟物组中检测到PDCD4表达的减少或完全丧失。 NC组免疫细胞化学染色深度适中。相反,在miR-21抑制剂组中观察到PDCD4的强免疫阳性(图2见封3)。
2.3 沉默PDCD4诱导肿瘤细胞增殖、集落形成、迁移和侵袭 沉默PDCD4对细胞增殖的影响通过将PDCD4 siRNA和对照siRNA转染到786-0细胞中进行研究。检查转染后增殖细胞786-O细胞的数量是否有变化,用EdU标记细胞以测量活性DNA合成,用Hoechst 33342标记细胞以说明所有细胞的细胞核。确定PDCD4的沉默显著促进细胞增殖。根据荧光显微镜分析的结果,包含EdU的新形成的细胞的平均百分比在NC siRNA组中为28.6%,在PDCD4 siRNA转染的细胞中为44.7%(t=7.99,P<0.01),见图3A。
进行集落形成测定以确定PDCD4敲低是否促进786-O细胞的集落形成能力集落形成实验表明,与NC组相比,PDCD4siRNA转染组中的集落总数显著增加(t=8.11,P<0.01),见图3B、C。
3 讨 论
本研究首次证明PDCD4受miR-21负调控,此外还能抑制裸鼠肾癌模型中的肿瘤生长和转移。在先前的研究中,揭示了在核苷酸228-249的PDCD4 3'非翻译区内存在miR-21的保守靶位点[7]。据报道,miR-21能够调节Ras /丝裂原活化蛋白激酶/细胞外信号调节激酶信号通路,因此影响肿瘤的形成。此外,一项荟萃分析表明,miR-21能够作为各种癌症预后的重要生物标志物[12]。 Xu等[13]证明miR-21的下调增加了肺癌细胞对顺铂的体外和体内敏感性。Wang等[14]报道肝细胞癌组织中miR-21表达明显高于正常肝组织,miR-21在转录后水平上对肿瘤抑制基因PDCD4有负调控作用,miR-21诱导RCC细胞增殖和侵袭/转移。PDCD4的表达也与RCC转移、肿瘤分期和分级显著正相关。
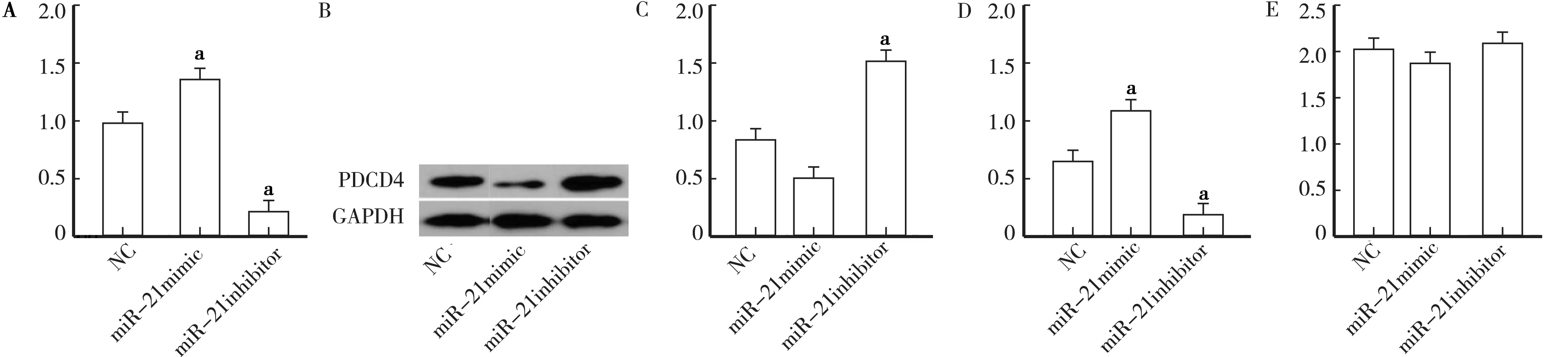
注:A.各组肿瘤质量比较;B、C.蛋白质印迹的PDCD4图像和相对于GAPDH蛋白密度分析;D.RT-qPCR确定的miR-21的相对表达; E.通过RT-qPCR测定的PDCD4 mRDN的相对表达。与NC组比较,aP<0.01
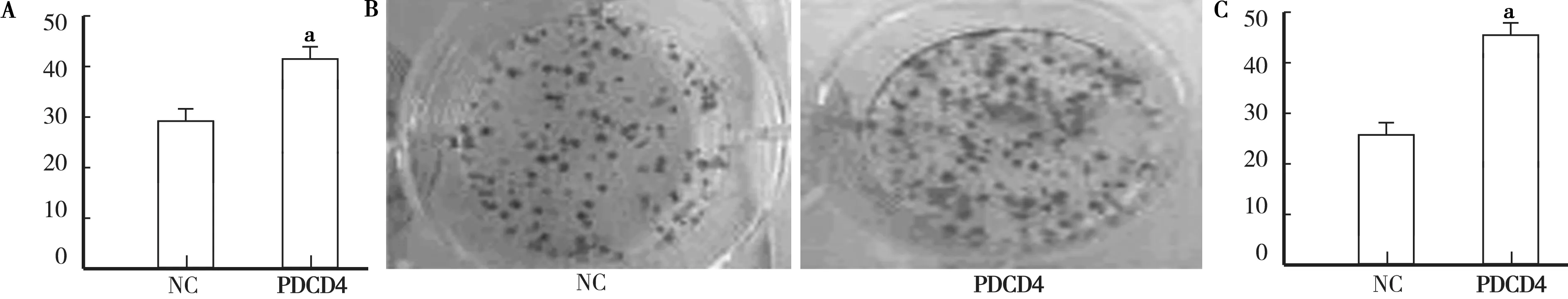
注:A.用PDCD4 siRNA和NC siRNA转染后786-O细胞的增殖能力;B.第14天捕获的NC siRNA和PDCD4 siRNA转染的786-O细胞的集落形成测定的图像;C.在PDCD4 siRNA转染的组中,786-O细胞的集落形成能力显著高于转录后14天NC组。与NC组比较,aP<0.01
为了进一步研究PDCD4和miR-21之间的关联,在本研究中使用BALB / c雄性裸鼠和786-O细胞建立裸鼠肾细胞癌模型。发现miR-21模拟组的肿瘤重量与NC组相比显著增加,miR-21抑制剂组的肿瘤重量与NC组相比显著降低。Western blot分析NC组、miR-21抑制剂组和miR-21模拟组PDCD4的表达。在miR-21模拟组中PDCD4蛋白的表达缺失或减少; 然而,与NC组相比,PDCD4蛋白在miR-21抑制剂组中高度表达。免疫组化显示相似的结果。另外,3组之间PDCD4 mRNA水平没有显著差异。本研究的结果与先前发表的人肾癌组织和细胞系研究相似[11],表明miR-21在转录后水平下调PDCD4,并促进细胞集落形成和增殖裸鼠肾癌模型。
研究表明PDCD4是一种肿瘤抑制基因和抗肿瘤治疗的潜在靶点。据报道,在5种类型的人类肿瘤中,包括肺、脑、乳房、结肠和胰腺中的PDCD4表达降低。在结肠癌细胞系中,Wang等[14]已经证明PDCD4的下调导致结肠癌细胞侵袭的增加,此外,研究还表明PDCD4的敲低与E-钙黏蛋白表达的显著降低和活性β-连环蛋白在这些细胞核中的积累有关。在同一系列实验中,PDCD4敲低导致激活蛋白(AP)-1依赖性转录增加。这些结果表明,PDCD4表达降低促进癌细胞侵袭,并且这与β-连环蛋白,E-钙黏蛋白和AP-1-依赖性转录的活化相关。另一项研究表明,PDCD4表达下降与腺样囊性癌的临床分期密切相关。同时PDCD4表达下降与RCC中转移、肿瘤分期和分级显著正相关。
本研究中关注了PDCD4对miR-21表达的影响。将PDCD4 siRNA转染入786-O细胞,发现PDCD4 mRNA和蛋白水平与NC组相比显著降低。沉默PDCD4也显著促进了786-O细胞的增殖、迁移和侵袭,与miR-21过表达后观察到的效果类似。
总之,本研究和先前研究结果表明,PDCD4和miR-21在RCC肿瘤发生、发展中起重要作用。促进PDCD4表达或抑制miR-21表达有望成为治疗肾癌的有效新型治疗策略。
利益冲突:无
作者贡献声明
吴佳成:设计研究方案,实施研究过程,分析试验数据,论文撰写。陆雅君:实施研究过程,资料搜集整理,数据统计学分析。姜力:设计课题,提出研究思路,论文审核

