赖氨酸-葡萄糖模拟体系中吡咯素生成条件的研究
张瑛,袁鑫乐,王静
(北京工商大学,北京100048)
食品加工中的热加工技术可以极大地改变食品 的化学成分,尤其是加工过程发生的美拉德反应(maillard reaction)。在美拉德反应中,还原糖的羰基与多肽或者蛋白质以及游离型氨基酸中的氨基最终生成棕色混合物[1-2]。美拉德反应分为3个阶段,包括早期、晚期和末期[3]。1984年Brownlee等科学家首次提出晚期糖基化终产物(advanced glycation end products,AGEs)的概念[4]。AGEs是指在非酶条件下发生的美拉德反应,生成一类稳定、不可逆的化合物,能够通过膳食而进入人体[5]。AGEs会加速人体产生视网膜病变,神经病变和肾脏疾病以及与之相关的糖尿病微血管并发症[6-7]。AGEs种类繁多,主要包括羧甲基赖氨酸(Nε-(carboxymethyl)lysine,CML)[8-10]、戊糖素(pentosidine)[11-12]、吡咯素(pyrraline)[13-14]和丙酮醛(methylgalyoxal,MG)[15]。而对吡咯素的研究相较于其他AGEs较少,因此本文将通过葡萄糖-赖氨酸模拟体系来研究吡咯素的生成规律,为食品加工工艺提供理论支持。
吡咯素最先被Nakayama等[16]在模拟体系中发现,是AGEs的主要存在形式之一,含有一个Lys残基,其生成机理是由Lys中的氨基与美拉德反应中期产物的降解物3-脱氧葡萄糖醛酮通过化学反应生成,其性质为无荧光性、非交联产物,属于一种Lys衍生物。吡咯素在结构上属于C6-吡咯化合物[17],在体内体外的形成路径包括多元醇路径和美拉德反应路径,3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)是吡咯素生成的重要的中间产物,既可以通过多元醇途径的3-磷酸果酸产生,也可以通过Amadori产物降解生成[3]。有研究发现,糖尿病患者血清中的吡咯素浓度高于健康人[18]。此外,免疫学研究发现动脉粥样硬化患者体内的吡咯素会在肾小球基底膜中积聚,最终导致肾功能衰竭[19]。因此,可以作为人类健康和AGEs定量检测指标的吡咯素受到极大的关注。Wellner A等发现未加工的生胡萝卜中未检测到吡咯素的存在,而加工后的胡萝干中吡咯素的含量高达378 mg/kg Pro[20]。Liang等报道了27种富含肽类的固体饮料中吡咯素含量为150 μg/L~760 μg/L[21]。Yu等发现在早餐谷物,面类食物和烘焙产品中,吡咯素及其结构类似物的含量高达34.8 mg/kg[22]。研究加工过程各条件对吡咯素形成的影响,对于有效控制并降低在食品加工和贮藏过程中的形成具有重要意义。
该文选用食品中常用的葡萄糖以及生成吡咯素所必需的反应物赖氨酸来构建葡萄糖-赖氨酸(glucose-lysine,Lys-Glu)模拟体系,采用高效液相色谱法(high performance liquid chromatography,HPLC) 检测吡咯素的含量,研究加热温度与时间、原料配比和体系pH值对吡咯素形成的影响,为食品加工过程中吡咯素的形成和抑制提供理论基础。
1 材料与方法
1.1 材料与试剂
赖氨酸、葡萄糖(纯度>99%):郑州博研生物科技有限公司;磷酸氢二钠、磷酸二氢钠(分析纯):西陇科学股份有限公司;氨水(5%)、甲醇(分析纯)(纯度≥99.5%):北京化工厂;三氟乙酸(TFA)、乙腈、甲醇(色谱纯):北京百灵威科技有限公司;超纯水(≥18 MΩ·cm-1):美国 Labconco-WaterPro 超纯水仪。
1.2 仪器与设备
JA5003电子天平:上海精密科学仪器有限公司;HH-2恒温水浴锅:金坛市杰瑞尔电器有限公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;OasisTMHLB 固相萃取柱(3 cc,60 mg):沃特世科技(上海)有限公司;Starter2000 pH计:美国奥豪斯(上海)有限公司;LC-20AT高效液相色谱仪、Inertsil ODS-SP(4.6 mm×250 mm,5 μm)色谱柱:岛津(中国)有限公司;UGC-24M氮吹仪:北京优晟联合科技有限公司。
1.3 方法
1.3.1 加热时间对Lys-Glu模拟体系中吡咯素形成的影响
准确称取2.923 8 g赖氨酸和3.603 2 g葡萄糖置于烧杯中,用磷酸盐缓冲溶液(phosphate buffer solution,PBS)(0.1 mol/L,pH=7.4)将其溶解,并定容至 200 mL,配制赖氨酸和葡萄糖浓度为0.1 mol/L的标准溶液。分别准确移取3 mL赖氨酸与葡萄糖的标准混合溶液于5 mL可密封的耐高压高温玻璃管中,在80℃的水浴条件下分别加热 10、20、40、60、80 min,随后置于冰水浴中冷却至25℃。测定不同加热时间下Lys-Glu模拟体系中吡咯素的生成情况。每个梯度做3次平行试验。
1.3.2 加热温度对Lys-Glu模拟体系中吡咯素形成的影响
Lys-Glu模拟体系构建方法见1.3.1。为模拟低温和高温热加工环境,试验中采用水浴加热和油浴加热的两种加热模式。将若干装有3 mL赖氨酸-葡萄糖模拟体系的耐高压高温玻璃管分别置于80、90、100、110、120℃条件下加热40 min,然后取出置于冰水浴冷却至室温。测定不同加热温度下Lys-Glu模拟体系中吡咯素的生成情况。平行试验同1.3.1。
1.3.3 pH值对Lys-Glu模拟体系中吡咯素形成的影响
准确配置 pH 值分别为 6.0、7.0、7.2、7.4、7.6、7.8的PBS缓冲溶液。后续处理同1.3.1。在80℃条件下加热40 min后,放于冰水浴冷却至室温待测。探究在不同pH值的PBS缓冲溶液条件下Lys-Glu模拟体系中吡咯素生成量的变化。平行试验同1.3.1。
1.3.4 原料配比对Lys-Glu模拟体系中吡咯素形成的影响
以 PBS缓冲溶液(0.1 mol/L,pH=7.4)为溶剂溶解赖氨酸和葡萄糖,准确配制不同原料比的赖氨酸-葡萄糖PBS缓冲液。保持葡萄糖的浓度为0.1 mol/L不变,改变赖氨酸的浓度分别为 0.2、0.4、0.6、0.8、1.0 mol/L。准确移取不同原料配比的反应液3 mL置于5 mL耐高温高压的密封玻璃管,拧紧密封,在80℃条件下加热40 min后,放于冰水浴冷却至室温待测。保持赖氨酸的浓度为0.1 mol/L不变,改变葡萄糖的浓度为0.1、0.2、0.4、0.8、1.6 mol/L,准确移取不同原料配比的反应液3 mL置于5 mL耐高温高压的密封玻璃管,拧紧密封,在80℃条件下加热40 min后,放于冰水浴冷却至室温待测。测定在不同原料配比条件下模拟体系中吡咯素生成量的变化。平行试验同1.3.1。
1.3.5 吡咯素含量的测定(HPLC法)
先将HLB萃取柱预活化(活化程序:依次通过3 mL甲醇、3 mL水),然后将经过不同条件处理所得的反应液(3 mL)加入活化的萃取柱中,吸附完成后,取3 mL去离子水洗涤,再加入3 mL甲醇洗涤,最后加入洗脱液(5%氨水)对目标物进行洗脱,并用10 mL离心管收集洗脱液。在35℃的恒温条件下,氮气吹扫干燥所收集的洗脱液,并复溶于流动相(去离子水)中,0.22 μm滤膜过滤后封装于液相小瓶,按照所建立的HPLC法测定吡咯素含量。所有样品均需做3次平行试验。
试验中高效液相色谱条件根据Portero-Otin[22]做了相应的调整。具体液相色谱条件如下:
色谱柱:Inertsil ODS-SP柱(4.6 mm×250 mm,5 μm);流动相 A:0.1%TFA 水溶液,流动相 B:乙腈-水(1 ∶1,体积比);梯度洗脱程序:在 10、30、35、40、45 min时流动相B的体积分别为0%、15%、20%、100%、0%;分析时间:45 min;流速:1.0 mL/min;进样量:5 μL;柱温:室温;紫外-可见光检测器检测波长:297 nm。
1.4 统计分析方法
采用SPSS Statistics 17.0软件进行各因素及其交互作用与模型的显著性统计分析,Design Expert软件进行响应面法优化模拟体系中吡咯素的生成条件,所有样品进行3次重复测定。
2 结果与分析
2.1 绘制吡咯素标准曲线
参照1.3.5的试验条件,选取ODS色谱柱为固定相,流动相A为0.1%TFA水溶液,流动相B为乙腈-水(体积比,1∶1),对吡咯素标准溶液进行液相分析见图1。

图1 吡咯素标样的色谱图和标准曲线图Fig.1 Chromatogram(a)and standard curve(b)of pyrraline
如图1a和图1b所示,吡咯素保留时间为21.690 min。在吡咯素浓度为 5×10-7mol/L~2×10-3mol/L的范围之内,摩尔浓度与峰面积间线性趋势良好,回归方程为:Y=4.55×109X-4 140.41,R2=0.999 9。
2.2 加热时间对Lys-Glu模拟体系中吡咯素形成的影响
通过单因素试验探究加热时间对吡咯素生成的影响见图2。

图2 加热时间对模拟体系中吡咯素生成的影响Fig.2 Effect of heating time on the formation of pyrraline in model system
如图2所示,当反应时间为40 min时模拟体系中吡咯素的生成量达到最大为1.24 μmol/L。从整个结果图展现的趋势来看,吡咯素生成量随着加热时间的延长,呈现出先升高后降低的趋势,即模拟体系中吡咯素生成拥有最适加热时间。加热时间短,吡咯素生成量低,可能是吡咯素生成模拟体系赖氨酸-葡萄糖反应不彻底所导致。加热时间长,吡咯素生成量依然不高,原因可能是加热时间太长导致已经生成的吡咯素变成其他物质。经过显著性试验分析后发现,加热时间为40、60 min时吡咯素生成量无显著性差异,根据节约试验成本的原则,试验选定40 min作为加热时间。在后续优化生成条件试验中也选取40 min作为加热时间。
2.3 加热温度对Lys-Glu模拟体系中吡咯素形成的影响
参照1.3.2的方法对不同加热温度下吡咯素的生成量进行检测,结果如图3所示。

图3 加热温度对Lys-Glu模拟体系中吡咯素生成的影响Fig.3 Effect of heating temperature on the formation of pyrraline in model system
由图3可知,在其他条件一定的情况下(加热时间设为40 min),在加热温度为80℃~90℃条件下反应后,Lys-Glu模拟体系中吡咯素生成量无明显变化;而当温度提高到100℃时,Lys-Glu体系中吡咯素生成量出现一个显著转折,吡咯素的生成量达到最大为1.52 μmol/L,赖氨酸和葡萄糖快速反应生成较多吡咯素;原因可能是当反应模拟体系温度在100℃以下时,相对于涉及吡咯素损失的反应,吡咯素的生成反应占主导地位,而当模拟体系加热温度超过100℃时,吡咯素损失的反应占据了主导地位。而在更高温度(110、120℃)条件下,生成产物颜色加深,吡咯素生成量增多,结合前人的研究分析发现高温会促进美拉德反应,使得吡咯素含量增加。因此试验选择100℃为最优的吡咯素生成温度。
2.4 缓冲液pH值对Lys-Glu模拟体系中吡咯素形成的影响
pH值对Lys-Glu模拟体系中吡咯素形成的影响见图4。

图4 PBS缓冲液pH值对模拟体系中吡咯素生成的影响Fig.4 Effect of the pH on the formation of pyrraline in model system
如图4所示,反应体系的pH值为7.4时,模拟体系中吡咯素的生成量达到最大为1.09 μmol/L。随着PBS缓冲液pH值从偏酸性(6~7)到中性的逐步增加,Lys-Glu模拟体系中吡咯素生成量呈现增加趋势,并且在pH=7.4时达到最大,而随着pH值的进一步增加吡咯素生成量呈现出减少的趋势。从Lys-Glu模拟体系中吡咯素生成量的变化规律可以看出,酸性与碱性会抑制吡咯素的生成,而偏中性的环境会加速吡咯素的生成。反应液的pH值除了影响反应速度,还会影响美拉德反应速率的关键性步骤,即Amadori重排和Heyns重排。有研究表明,pH值对赖氨酸的活性形式也有影响,pH值升高会使赖氨酸发生脱质子化反应,而脱质子化的赖氨酸具有更高的反应活性,在25℃条件下,pH=6.8时赖氨酸的脱质子化程度(0.018 6%)大约是pH=5.9时(0.002 3%)的8倍[24]。
2.5 不同底物浓度对Lys-Glu模拟体系中吡咯素形成的影响
保持Lys-Glu模拟体系中赖氨酸浓度(0.1 mol/L)不变,改变葡萄糖浓度时吡咯素生成量的变化规律如图5所示。

图5 葡萄糖浓度对模拟体系中吡咯素生成的影响Fig.5 Effect of concentration of glucose on the formation of pyrraline in model system
食品原料中Glu含量对美拉德反应中AGEs生成有着极为重要的影响。分析图5可知,随着模拟体系中葡萄糖浓度从0.1 mol/L增加到0.4 mol/L,吡咯素的生成量从0.5 μmol/L增加到3.8 μmol/L,达到最大值,而随着模拟体系中葡萄糖浓度的继续增加,吡咯素生成量开始降低,并有趋于平衡的趋势。呈现这一趋势的可能原因在于,当反应体系中赖氨酸的浓度一定时,随着Glu与Lys二者浓度比例的增加,会使体系中各成分碰撞的机会提高,从而促进反应的进程。
保持Lys-Glu模拟体系中葡萄糖浓度(0.1 mol/L)不变,改变赖氨酸浓度时吡咯素生成量的变化规律如图6所示。
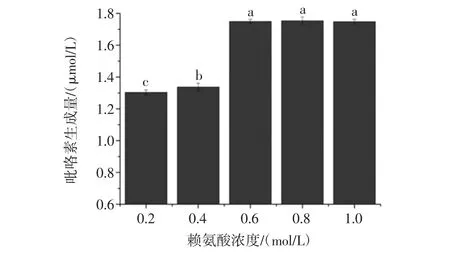
图6 赖氨酸浓度对模拟体系中吡咯素生成的影响Fig.6 Effect of the concentration of the lysine on the formation of pyrraline in model system
由图6可知,模拟体系中葡萄糖浓度保持不变时,随着模拟体系中赖氨酸浓度由0.1 mol/L增加到0.6 mol/L,吡咯素的生成量从1.24 mmol/L增加到1.75 mmol/L,并达到最大值,而当赖氨酸浓度继续增大时,吡咯素生成量有达到平衡的趋势。
2.6 响应面法优化吡咯素生成条件
综合考虑上诉单因素试验结果考虑,在赖氨酸浓度为0.6 mol/L,pH值为7.4的试验条件下,设计试验选择加热时间(X1)、加热温度(X2)和葡萄糖浓度(X3)为考察因素,以吡咯素生成量(Y)作为试验指标。通过Design Expert8.0.6.1.分析软件,同Box-Behnken设计法设计响应面试验优化吡咯素提取工艺。试验因素水平及编码见表1,其中1、0、-1分别代表着自变量的高、中、低水平。

表1 响应面试验因素与水平Table 1 Response surface experiment factors and levels
2.7 吡咯素生成条件优化回归模型建立及方差分析
响应值(Y)取作吡咯素生产量,X1、X2、X3分别代表三因素:加热时间、加热温度、原料中葡萄糖浓度,用Design Expert8.0.6.1分析软件中的Box-Behnken模型设计方案,分别对影响三因素作试验分析,试验结果如表2所示。

表2 响应面分析方案及结果Table 2 Response surface analysis scheme and results
将表2所得的试验数据采用Design Expert 8.0.6.1软件进行统计分析,统计分析结果如表3所示。对响应值和各因素的编码值进行回归拟合,得到回归方程:
Y=4.45-0.57X1+0.22X2-0.61X3+0.42X1X2+0.082X1X3+0.022X2X3-1.44X12-0.47X22-0.52X32

表3 回归模型方差分析Table 3 Regression model analysis of variance
式中:X1为加热时间;X2为加热温度;X3为葡萄糖浓度。回归模型方差分析见表3。通过表3可知,模型的显著水平P<0.000 1<0.01,表示回归方程模型具有极高显著性,同时模型F值为29.38,也说明模型具有显著性;X12对吡咯素生成影响极显著,X1、X2、X3、X1X2、X22、X32对吡咯素生成影响显著。通过比较时间、温度和葡萄糖浓度P值大小(依次为0.000 5、0.048 8、0.000 3),得到三因素对吡咯素生成影响程度由大到小为:葡萄糖浓度、加热时间、加热温度;失拟项P检验值为0.367 3>0.05,不显著;拟合模型的修正相关系数平方:R2=0.974 2,R2adj=0.941 1,说明该分析模型与实际操作的拟合程度高,无其他因素的显著影响,试验误差较小,可用其代替真实试验点进行分析和预测。
2.8 吡咯素生成优化工艺的响应面分析
响应面图能够比较直观地反映在食品加工过程各因素及各因素的相互作用对吡咯素生成量的影响。应用Design Expert 8.0.6.1软件中的Box-Behnken模型进行分析,将影响吡咯素生成量三因素的其中一个因素设定为零,可得到另外两个因素对吡咯素生成量的影响结果,其对应的响应面与等高线曲线如图7~图9所示。

图7 加热温度和加热时间对吡咯素生成量影响效果的响应面和等高线Fig.7 Response surface and contour of the effect of heating temperature and time on the content of pyrraline production
从图7a可知,加热时间对应的响应值的曲线陡峭,表明对吡咯素的生成量影响较大,而反应温度对应的响应值的曲线相对平缓,表明反应温度对吡咯素的生成量的影响不大。图7b中加热时间和温度的等高线形状扁平,表明加热温度和时间的交互作用对吡咯素的生成量的影响较大。

图8 葡萄糖浓度和加热时间对吡咯素生成量影响的响应面和等高线Fig.8 Response surface and contours of glucose concentration and heating time on the content of pyrraline production
从图8a可以看出,加热时间对应的响应值的曲线相对较陡,而葡萄糖浓度对应的响应值的曲线较平缓,表明加热时间对吡咯素的生成量影响较大。图8b中反应时间和葡萄糖浓度的等高线形状扁平,表明加热时间和葡萄糖浓度的交互作用对吡咯素的生成量的影响较大。
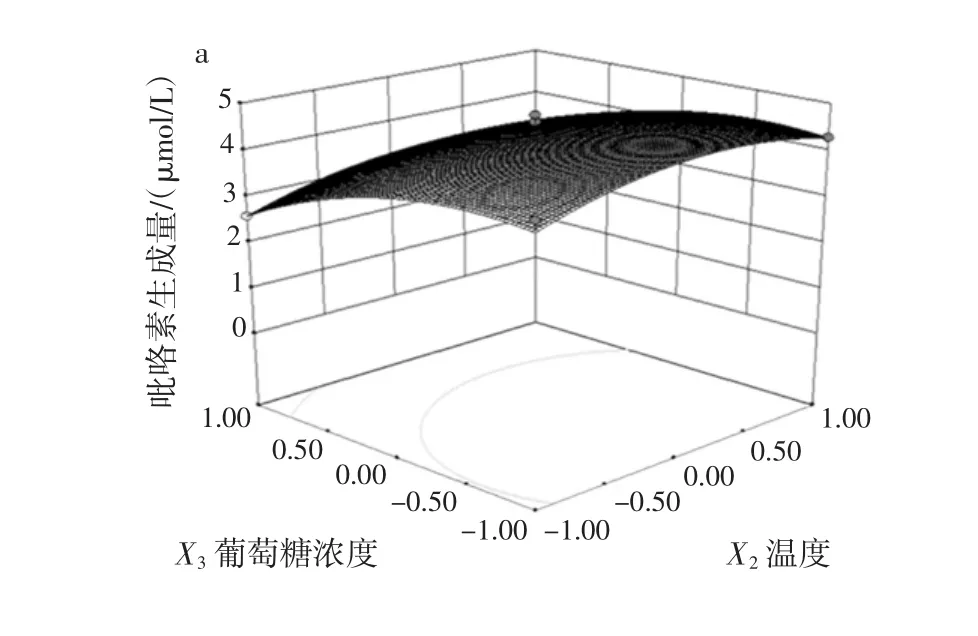

图9 葡萄糖浓度和加热温度对吡咯素生成量影响效果的响应面和等高线Fig.9 Response surface and contours of the effect of glucose concentration and heating temperature on the content of pyrraline production
从图9a可以看出,葡萄糖浓度对应的响应值的曲线陡峭,说明对吡咯素的生成量影响较大,而加热温度对应的响应值的曲线相对平缓,表明加热温度对吡咯素的生成量的影响不大。图9b中加热温度和葡萄糖浓度的等高线近似圆形,表明加热温度和时间的交互作用对吡咯素的生成量的影响较小。
2.9 对模拟体系中吡咯素生成最优条件的验证
为确定提取吡咯素的最佳工艺参数,通过Design Expert 8.0.6.1.软件中Numerical对拟合的回归方程进行分析,得出模拟体系中吡咯素的最佳生成条件是:加热时间49.2 min、加热温度110℃、葡萄糖浓度0.534 mol/L,在此最优生成条件下可得到最大吡咯素生成量4.71 μmol/L,考虑到食品加工实际操作过程的多种因素,取生成方案为加热时间50 min、加热温度110℃、葡萄糖浓度为0.5 mol/L进行验证,得到的吡咯素的生成量为4.69 μmol/L,相对误差较小,说明响应面分析具有良好的实际参考性。
3 结论
目前,如何降低食品加工过程中产生的伴生危害物已经越来越成为国内外食品行业关注的重点。在单因素试验基础上,采用高效液相色谱仪法测定食品加工模型Lys-Glu体系所产生的的吡咯素生成量,对其生成条件进行分析,利用Design Expert8.0.6.1.软件响应面分析法建立数学模型对吡咯素生成条件进行优化。结果表明,加热时间、反应温度以及葡萄糖浓度对模拟体系中吡咯素的生成均有显著的影响,影响大小为葡萄糖浓度>加热时间>加热温度。综合实际因素得到利于吡咯素生成的方案为:加热时间50 min、加热温度110℃、葡萄糖浓度为0.5 mol/L,为降低加工过程中吡咯素生成提供了理论支持。

