马齿苋多糖抑制HepG2细胞存活的作用机制
胡庆娟,牛庆川,宋皓,白书瑜,贺文杰,李玉萍
(江西科技师范大学生命科学学院,江西南昌330013)
马齿苋(Portulaca oleracea L.)为药食两用的一年 生草本植物,具有神经保护[1-2]、抗菌[3]、抗糖尿病[4-5]、抗氧化[6]、抗炎[7]、抗癌[8-10]等多种功效。研究表明马齿苋中含有生物碱、黄酮、多糖、多巴胺等多种生物活性成分[11-15]。其中,马齿苋多糖(polysaccharide of Portulaca oleracea L.,POP-A)是其主要活性成分之一,具有提高免疫力、抗病毒、降糖调脂、抗癌及抗衰老等生物活性[10,16-23]。
目前对POP抑制肿瘤细胞增殖,诱导细胞凋亡已有少量的初步研究。Zhao Rui等[10,18]研究结果表明POP可抑制宫颈癌细胞的增殖,通过参与调控TLR4/NF-kB信号通路,触发DNA损伤,诱导细胞凋亡;崔旻等[24]研究表明POP可以抑制SMMC7721肝癌细胞,增强细胞免疫;王晓波等[25]研究发现POP可以抑制BEL-7402肝癌细胞,提高细胞免疫,具有明显的抑制肿瘤的作用;丁虹等[26]研究结果表明POP能够抑制宫颈癌细胞生长,诱导癌细胞凋亡。但对于HepG2肝癌细胞的研究还鲜见报道。
为此,本研究在课题组前期分离提取马齿苋多糖的基础上,以HepG2肝癌细胞为研究对象,采用体外培养法和四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]法检测了POP-A对HepG2肝癌细胞的抑制作用,同时采用荧光定性定量法、免疫印迹法和反转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)法探讨了POP-A抑制HepG2肝癌细胞的作用机制,为POP-A抗肿瘤活性的进一步研究提供理论依据。
1 材料与方法
1.1 材料与试剂
马齿苋多糖POP-A按照江西科技师范大学生命科学学院实验室之前的优化条件获取[27]。
改良杜氏伊格尔培养基(dulbecco’s modified eagle’s medium,DMEM)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、焦碳酸二乙酯水(diethylpyrocarbonate,DEPC):美国Gibco公司;胎牛血清(fatal bovine serun,FBS):杭州四季青生物工程有限公司;青链霉素双抗(100×)、0.25%胰蛋白酶-乙二胺四乙酸(1×)、四甲基偶氮唑盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、JC-1 线粒体膜电位检测试剂盒、Fluo-3 AM钙离子荧光探针、Beyozol试剂、ECL发光试剂盒、Western及IP细胞裂解液、山羊抗兔lgG(H+L)、辣根过氧化物酶(horseradish peroxidase,HRP)、山羊抗小鼠 lgG(H+L)、抗体(p53、Bax):碧云天生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO):美国 Ameresco公司;4-羟乙基哌嗪乙磺酸、Tris-Hcl-tween缓冲液(Tris buffered saline tween,TBST):北京索莱宝生物科技公司;AII-in-One First-StrandcDNA试剂盒、Synthesis SuperMixfor qPCR:北京全式金生物技术有限公司;Protein Ladder:美国Ladder Thermo公司;蛋白变性5×SDS-PAGE上样缓冲液:康为世纪公司;所用化学试剂均为国产分析纯。
Hank’s 液:0.14 g CaCl2,0.4 g KCl,0.06 g KH2PO4,0.10 g MgSO4·7H2O,8.0 g NaCl,0.35 g NaHCO3,0.12 g Na2HPO4·12H2O,1.0 g D-葡萄糖,0.01 g Phenol red(酚红),10 mL FBS,溶于1 000 mL新鲜超纯水中,0.22 mm过滤,4℃保存。
细胞培养板:美国Corning公司;水机相微孔滤膜:美国Millipore公司。
1.2 仪器与设备
HV-85型高压灭菌锅:日本Hirayama公司;IX-71型倒置光学显微镜:日本Olympus公司;Thermo Forma Series-Ⅱ型CO2培养箱、Multiscan MK3型全自动酶标仪、Forma class-II/A2生物安全柜:美国Thermo公司;JJ500精密电子天平:美国双杰兄弟公司;Milli-Q超纯水系统:美国Millipore公司;PHS-29A数显酸度计:上海虹益仪器有限公司;5804R型离心机:德国Eppendorf公司;F-2700荧光分光光度计:日本Corporation公司;Vortex-Genie 2漩涡振荡器:美国Scientific公司;SZCL-4型数显智能控温磁力搅拌器:巩义市予华仪器有限公司;THZ-82A型水浴恒温振荡器:江苏金坛市荣华仪器制造公司。
1.3 方法
1.3.1 HepG2肝癌细胞的培养
HepG2细胞培养在DMEM培养液(10%FBS,37℃)中,当细胞生长到培养瓶底部的80%左右时进行传代培养或以下试验研究。
1.3.2 MTT法检测POP-A对HepG2肝癌细胞存活率的影响
将HepG2细胞以1×105个/mL的浓度种到96孔培养板中,37℃培养24 h后,分别加入不同浓度的POP-A处理细胞24 h或48 h,之后更换新鲜DMEM培养基,避光加入20 mL 5 mg/mL的MTT,37℃培养箱中孵育4 h后,除去全部孔的上清,将150 mL的DMSO依次加入每孔,用锡箔纸包裹培养板后,放于摇床上摇动10 min,在波长为492 nm处,使用酶标仪检测吸光度,计算并分析各组的细胞存活率,公式如下:

1.3.3 POP-A对HepG2肝癌细胞线粒体膜电位的影响
将HepG2细胞悬液以1×105个/mL的浓度种到6孔培养板中,37℃过夜培养后,分别加入1.25、2.5、5 mg/mL 3个浓度的 POP-A,再孵育24 h(37℃),吸弃上清,加PBS轻洗两次,并将残余的PBS吸净。随后加入含5 mg/mLJC-1工作液的培养基,37℃孵育60 min,吸弃上清,用PBS溶液洗涤细胞两次。每孔加入2 mL的DMEM培养液,37℃孵育30 min,在荧光显微镜下观察。
阳性对照组设置:取1 mL碳酰氰基-3-氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone ,CCCP)(10 mmol/L)加入到1 mL新鲜培养基中,使得终浓度为10 mmol/L。将含10 mmol/L CCCP的培养基加入到6孔培养板中,放于培养箱中孵育20 min。孵育完成,吸弃上清,用JC-1染色缓冲液洗涤细胞两次。每孔加入2 mL的DMEM培养液,37℃孵育30 min,在荧光显微镜下观察。
1.3.4 POP-A对HepG2肝癌细胞内钙离子的影响
将HepG2细胞悬液以1×105个/mL的浓度种到6孔板中,每孔2 mL。37℃培养过夜后,每孔分别加入1.25、2.5、5 mg/mL 3个浓度的 POP-A,再孵育 24 h(37℃)。吸弃上清,加PBS轻洗两次,并将残余的PBS吸净。加入含4 mmol/L的Fluo-3 AM的培养基(不含血清),37℃孵育20 min。之后每孔加5倍体积的Hank’s(含 1%FBS)再培养 40 min,装载完成之后,吸弃上清,4-羟乙基哌嗪乙磺酸缓冲液洗3次,在荧光显微镜下观察。之后用4-羟乙基哌嗪乙磺酸缓冲液重悬细胞,用激发波长为488 nm,发射波长为526 nm的荧光分光光度计,检测细胞内钙离子的浓度。
1.3.5 POP-A对HepG2肝癌细胞中p53和Bax蛋白表达的影响
将6孔板放置于冰上,加PBS轻洗2次。取出蛋白裂解液,将苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)与裂解液按 1∶100比例(体积比)混合,每孔加入1 mL裂解液,充分吹打至细胞完全脱落,之后移置离心管中,4℃离心(12 000 r/min,10 min),取上清,即为不同组别的细胞蛋白质样品,-20℃保存备用。制备10%分离胶和5%浓缩胶,取等量蛋白上样,电泳。电泳结束后,转膜,取出聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,封闭 2 h,一抗孵育(一抗的稀释根据具体的说明书),4℃过夜。用TBST缓冲液洗去膜上残余一抗。二抗孵育(二抗的稀释和种类根据具体的说明书),室温平摇1 h后,用TBST缓冲液洗去膜上残余二抗;ECL检测、曝光、显影、定影[28]。
1.3.6 POP-A对HepG2肝癌细胞中p53和Bax基因表达的影响
取出6孔培养板,吸弃上清,PBS洗涤3次,每孔加入1 mL Beyozol,晃动3~5下,之后加入裂解液,充分吹打至细胞完全脱落,移置1.5mL的离心管里,静置5 min,充分裂解样品。加0.2 mL氯仿,涡轮混合15 s,静置3 min,4℃离心(12 000 r/min,15 min),取上层,加0.5 mL异丙醇,晃动混匀,静置10 min,4℃离心(12 000 r/min,10 min),吸弃上清,即得到RNA白色沉淀。加1mL75%乙醇(DEPC水配制),剧烈涡旋至沉淀完全脱离管壁,充分洗涤沉淀。4℃离心(7 500 r/min,5 min)。弃上清,用小型离心机(转速<5 000 r/min)离心1 s,吸弃上清。待RNA略干后,加入RNA溶解液溶解,分装到200mL离心管中,-80℃保存备用。取2 mL RNA样品于微量分光光度计测定。以OD260/280表示RNA的纯度,测定值在1.8~2.0范围内,则可用于后续试验。
按顺序 5×TranscriptTM All-in-One SuperMix forq PCR(4 mL),RNase-free 水(15 mL),总 RNA/mRNA(1 mL)加入PCR管中,使总RNA充分接触混合液。轻轻混匀后,将PCR反应体系放于PCR仪内,按照42℃(10 min),42℃(5 s),4℃结束,进行逆转录反应,合成cDNA,将合成的cDNA存放于-80℃备用。
PCR所用引物序列见表1,反应体系见表2,反应条件见表3。

表1 实时荧光定量PCR的引物序列表Table 1 Table of the primer sequence in RT-PCR

表2 实时荧光定量PCR的反应体系Table 2 Reaction system of RT-PCR

续表2 实时荧光定量PCR的反应体系Continue table 2 Reaction system of RT-PCR
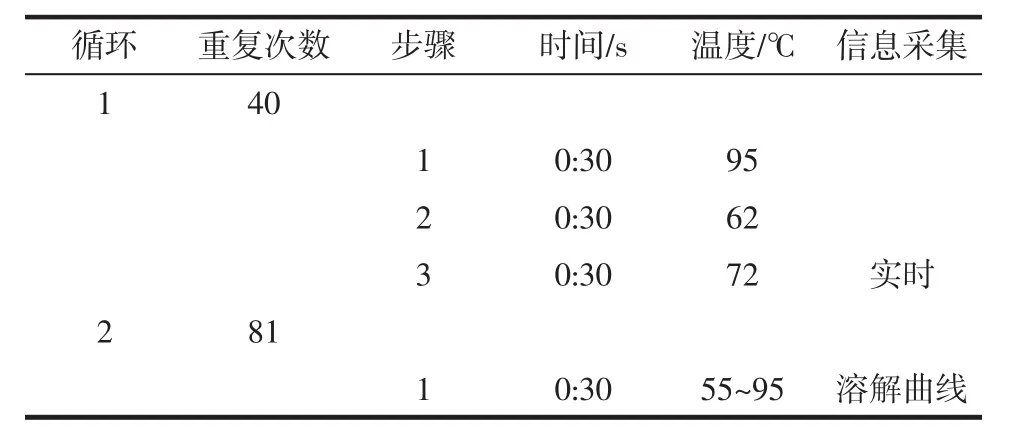
表3 实时荧光定量PCR的反应条件Table 3 Reaction condition of RT-PCR
1.3.7 数据统计与分析
试验结果以表示,计量资料用方差分析法分析,用t检验统计处理。P<0.05被认为两变量之间有统计学显著性差异。
2 结果与分析
2.1 POP-A对HepG2肝癌细胞存活的抑制作用
POP-A对HepG2肝癌细胞存活率的影响见图1。
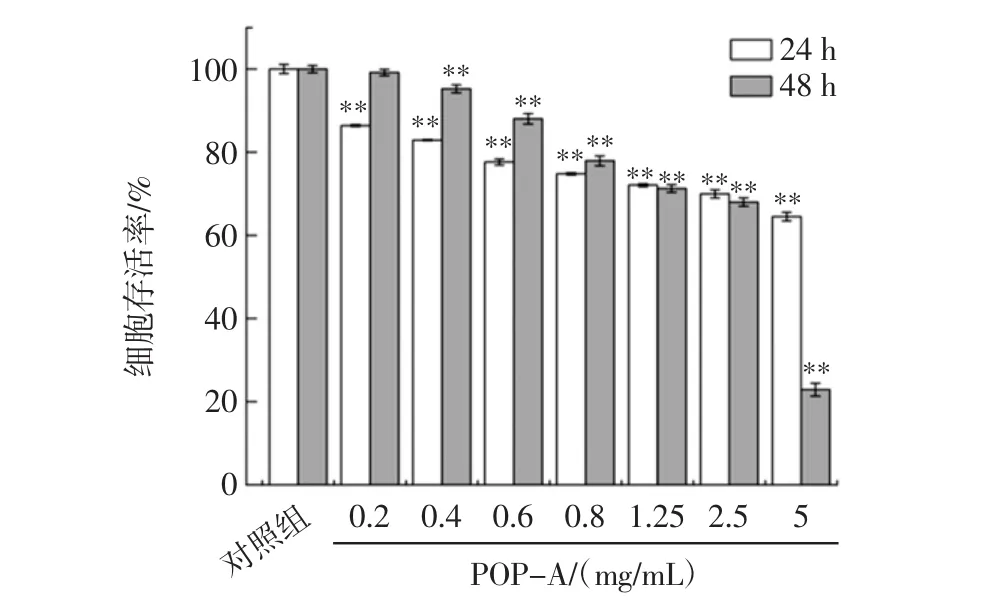
图1POP-A对HepG2肝癌细胞存活率的影响Fig.1 Effects of POP-A on the viability of HepG2 cells
由图1可知,与对照组相比,POP-A处理HepG2肝癌细胞24 h和48 h之后,显著的降低HepG2肝癌细胞的存活率,且随着POP-A浓度及处理时间(分别为24 h和48 h)的增加,HepG2肝癌细胞的存活率逐渐降低。当POP-A浓度为1.25、2.5、5 mg/mL时,可明显的降低细胞的存活率,因此,选用1.25、2.5、5 mg/mL的POP-A用于后续试验。
2.2 POP-A对HepG2肝癌细胞线粒体膜电位的影响
POP-A对HepG2肝癌细胞线粒体膜电位的影响见图2。

图2POP-A对HepG2肝癌细胞的线粒体膜电位的影响Fig.2 Effects of POP-A on mitochondrial membrane potential of HepG2 cells
线粒体膜电位的下降是细胞凋亡早期的一个特点[29]。JC-1线粒体荧光探针常被用于线粒体膜电位的检测,A(JC-1多聚体状态)代表线粒体膜电位升高,细胞处于正常状态;B(JC-1单体状态)代表线粒体膜电位下降,细胞处于凋亡早期。从图2可知,与对照组相比,用POP-A处理的HepG2肝癌细胞,红色荧光的细胞比例降低,绿色荧光的细胞比例增加,表明POP-A降低了细胞的线粒体膜电位,诱导了细胞的早期凋亡。
2.3 POP-A对HepG2肝癌细胞内钙离子的影响
POP-A对HepG2肝癌细胞内钙离子的影响见图3。
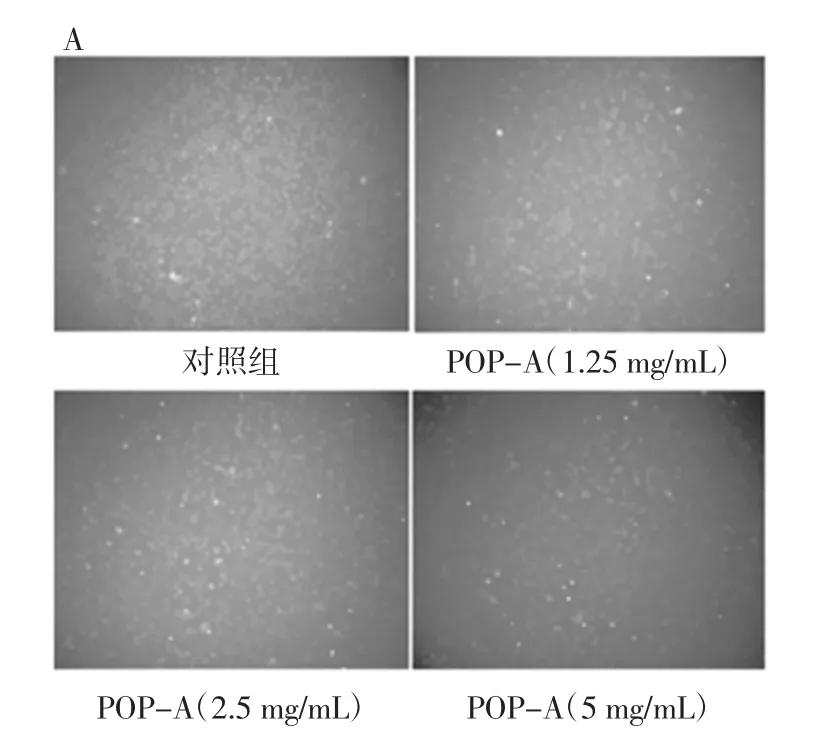
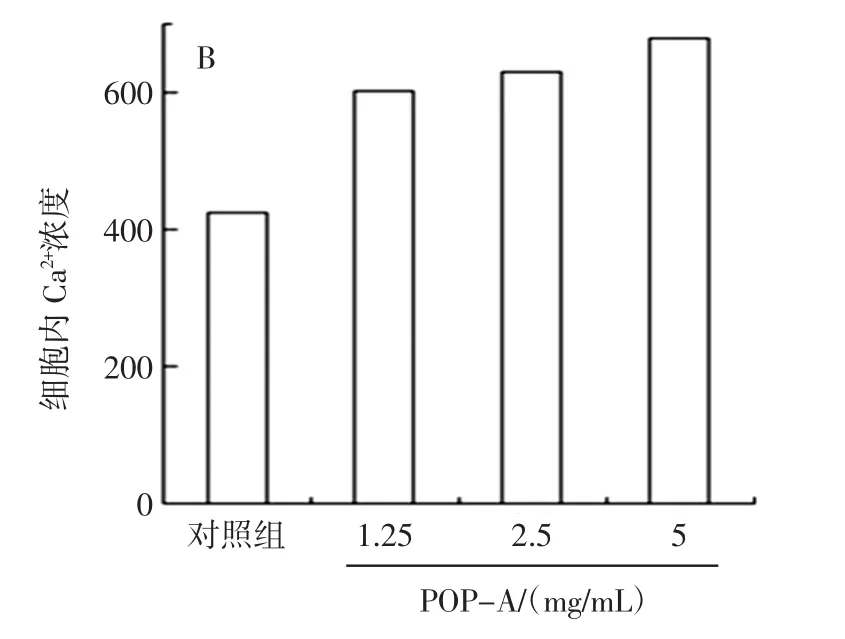
图3 POP-A对HepG2肝癌细胞内Ca2+浓度的影响Fig.3 Effects of POP-A on Ca2+concentration on HepG2 cells
由图3A可知,与对照组相比,POP-A组中的钙离子荧光强度增强。同时由图3B的统计结果可知,与对照组相比POP-A组中的钙离子浓度明显升高,表明POP可促进HepG2肝癌细胞内钙离子浓度的增加。
2.4 POP-A对HepG2肝癌细胞中p53和Bax蛋白表达的影响
POP-A对HepG2肝癌细胞中p53蛋白表达的影响见图4

图4POP-A对HepG2肝癌细胞p53蛋白水平表达的影响Fig.4 Effects of POP-A on the expression of p53 protein in HepG2 cells
由图4分析结果可知,与对照组相比,HepG2肝癌细胞经POP-A处理后,p53蛋白表达显著升高,且p53蛋白表达量随POP-A浓度的增大而逐渐升高。
POP-A对HepG2肝癌细胞中Bax蛋白表达的影响见图5。

图5 马齿苋多糖POP-A对HepG2肝癌细胞Bax蛋白水平表达的影响Fig.5 Effects of POP-A on expression of Bax protein in HepG2 cells
由图5结果可知,与对照组相比,HepG2肝癌细胞经POP-A处理后,Bax蛋白表达显著升高,且Bax蛋白表达量随POP-A浓度的增大而逐渐升高。
2.5 POP-A对HepG2肝癌细胞中p53和Bax基因表达的影响
POP-A对HepG2肝癌细胞中p53基因表达的影响见图6
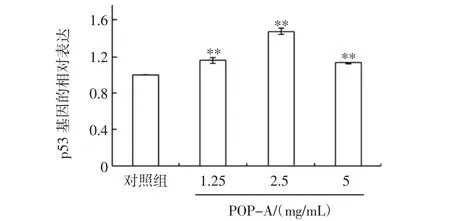
图6POP-A对HepG2肝癌细胞p53基因表达的影响Fig.6 Effects of POP-A on expression of p53 gene in HepG2 cells
由图6结果可知,与对照组相比,HepG2肝癌细胞经POP-A处理后,p53基因相对表达量显著增加,且呈一定的浓度依赖性。
POP-A对HepG2肝癌细胞中Bax基因表达的影响见图7。
由图7结果可知,与对照组相比,HepG2肝癌细胞经POP-A处理后,Bax基因相对表达量显著增加,且基因相对表达量随POP-A浓度的增大而逐渐增加。

图7POP-A对HepG2肝癌细胞Bax基因表达的影响Fig.7 Effects of POP-A on expression of Bax gene in HepG2 cells
3 结论
采用MTT法结果显示,与对照组相比,用POP-A分别处理HepG2肝癌细胞24 h和48 h后,均能显著降低HepG2肝癌细胞的存活率,且呈一定的浓度依赖性。从结果中可知在POP-A浓度为1.25、2.5、5 mg/mL时,作用效果最为显著。
细胞凋亡是细胞死亡的方式之一,是细胞受到外界刺激时,对刺激所作出反应的一种主动性的死亡方式。研究表明,肿瘤细胞的死亡多是通过凋亡引起的,凋亡对于抑制肿瘤的发生及发展具有重要的作用,很多抗肿瘤药物也是通过引起细胞的凋亡来达到抗肿瘤的目的的[30-31]。细胞早期凋亡的重要特征之一是线粒体膜电位降低。当线粒体膜电位降低时,线粒体功能丧失,引起细胞内钙离子浓度增加,细胞发生凋亡[29]。本试验采用荧光定性及定量的方法检测了POP-A对HepG2肝癌细胞线粒体膜电位及细胞内钙离子浓度的影响。结果显示,与对照组相比,POP-A降低了HepG2肝癌细胞线粒体膜电位,提高了细胞内钙离子浓度。表明POP-A可通过降低HepG2肝癌细胞线粒体膜电位,增加细胞内钙离子浓度,导致细胞内环境紊乱,对HepG2肝癌细胞起到抑制作用,初步推断POP-A抑制HepG2肝癌细胞的作用机制与促进HepG2细胞凋亡有关。
p53基因是研究较为广泛的一种抑癌基因,与细胞的增殖、死亡以及肿瘤的产生具有密切的关系。研究表明,p53基因上调,可进一步上调下游的促凋亡基因Bax的表达,促进肿瘤细胞的凋亡,进而导致细胞死亡,抑制肿瘤的产生[30]。本试验中蛋白印迹和RT-PCR结果显示,与对照组相比,POP-A显著提高了HepG2肝癌细胞中p53及Bax基因和蛋白的相对表达量,且呈一定的浓度依赖性,推测POP-A通过激活p53下游信号通路对HepG2肝癌细胞起到抑制作用,引起HepG2肝癌细胞的凋亡,导致细胞死亡。
综上可知,POP-A抑制HepG2肝癌细胞的作用机制与促进HepG2细胞凋亡有关,主要涉及降低线粒体膜电位,增加细胞内钙离子浓度,激活p53下游信号通路等。由于POP-A抑制HepG2肝癌细胞的作用机制复杂且多样,其具体作用机制仍需进一步的研究。

