超支化淀粉-抗坏血酸包合物的制备及其光热稳定性
顾子玄,金征宇,孙冰华,田耀旗
(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
淀粉可以作为天然壁材包埋缓释功能活性物质[1],且其具有良好的生物兼容性。淀粉基壁材制备常见的手段有化学、物理、酶法[2]或联合改性的方法[3]。目前淀粉化学改性已有报道如交联淀粉[4]和OSA淀粉[5],但其存在交联剂安全性、取代基分布不均匀等问题;物理改性方法局限于温湿度、压力等物理场的控制;而酶法改性以其种类多、来源广、多酶联合可以获得不同效果等具有显著优势[6]。
抗坏血酸(ascorbicacid,AA),作为抗氧化剂在食药、轻化领域有着广泛的应用,但其活跃的二烯醇结构使其在空气和溶液中极易被氧化[7]生成脱氢抗坏血酸以及2,3-二酮古乐糖酸而失去功能活性。目前国内外对保护其稳定性做了诸多研究。如化学改性抗坏血酸使其变成钠盐钙盐或酯化成盐[8-9],这些方法虽然保护了其稳定性但破坏了自身理化性质。近年兴起的微胶囊包埋技术[10-11]使抗坏血酸的光敏、热敏稳定性均得到极大的提高,并可以靶向传递抗坏血酸后进行释放,让机体充分利用抗坏血酸的生物活性。
超支化结构本身具有众多分支可以作为包埋功能物质的良好载体[12-13]。但目前超支化分子多来自化学单体通过缩聚反应制备获得,虽然其分支度可控,但化学合成的超支化分子由于安全性大多不适合作为食用壁材。本文采用酶法制备的超支化淀粉分子骨架,研究其作为一种新型的壁材包埋抗坏血酸,以期为功能活性物质包埋、保护提供新的思路。
1 材料与方法
1.1 试剂与仪器
高直链玉米淀粉,山东诸城兴贸玉米开发有限公司;超支化玉米淀粉(HBCS),实验室自制[14];试剂均来自国药集团化学试剂有限公司,分析纯。
冷冻离心机,真空冷冻干燥机,IS10傅立叶变化红外光谱仪,美国Nicolet公司;Aduance Ⅲ 400 MHz全数字化核磁共振波谱仪,德国Bruker公司。
1.2 实验方法
1.2.1 糖苷键比例测定
采用1H核磁共振测定样品的α-1,6糖苷键比例。参考李雯雯[15]的方法,用重水配制一定浓度的超支化淀粉乳,冷冻干燥后再重新分散于重水中。
1.2.2 超支化淀粉抗坏血酸包合物制备单因素实验设计
在对不同芯/壁比(质量比)(0.5∶1、1∶1、1.5∶1、2∶1、2.5∶1、3∶1)进行单因素实验时,准确称量一定量的超支化淀粉与一定体积的抗坏血酸溶液于磁力搅拌器上混均(表1),固定温度30 ℃,温育时间30 min;在对不同温度(10、20、30、40、50 ℃)进行单因素实验时,固定温芯/壁比(质量比)1∶1,温育时间30 min;在对不同时间(30、60、90、120、150 min)进行单因素实验时,固定温芯/壁比(质量比)1∶1,温度30 ℃。3 000×g离心5 min,取上清夜测定未被包合的抗坏血酸含量,抽滤、冷冻干燥得到超支化淀粉抗坏血酸包合物,计算相应的包合率。

表1 不同芯/壁比(质量比)配比Table 1 different proportions of core-to-wall ratio
注:CAA/(mg·mL-1)为抗坏血酸质量浓度。
参考HU等[16]的方法并稍作修改。将抗坏血酸溶解于稀醋酸水溶液中配制成不同浓度的溶液,以1%可溶性淀粉溶液作为指示剂用I2/KI溶液滴定待测液。线性回归方程为:
V(x)=2.012 5X+0.021 7 (R2=0.997 6)
(1)
式中:X为抗坏血酸含量,mg;V(x)为所消耗的VI2/VKI溶液体积,mL。
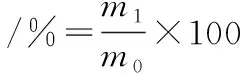
(2)
式中:m1为包埋的抗坏血酸含量;m0为包合物最大抗坏血酸含量。
1.2.3 超支化淀粉抗坏血酸包合物制备响应面实验设计
采用Design Expert 8.0.6软件进行响应面优化设计。在单因素基础上选取出各因素的最佳范围值,以包合率为响应值,根据Box-Benhnken中心组合原理设计3因素3水平的响应面实验(表2)。
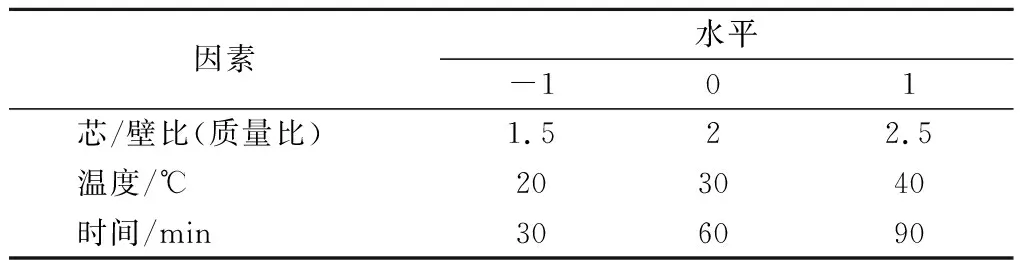
表2 Box-Benhnken试验因素水平和编码Table 2 Level and code of factors by Box-Benhnken experiment
1.3 傅立叶变换红外表征
分别取5 mg超支化淀粉、抗坏血酸、超支化淀粉与抗坏血酸物理混合物和超支化淀粉抗坏血酸包合物,按照1∶20的比例加入KBr细粉压片。以空气为背景,测定制备好的薄片。红外扫描波数为4 000~400 cm-1,扫描32次,分辨率为4 cm-1。
1.4 包合物稳定性
1.4.1 光敏稳定性测定
称取一定量的包合物于去离子水中在30 ℃下100 r/min磁力搅拌,分别在日光下照射30、60、90、120、150和180 min,测定释放的抗坏血酸含量。以未包合的纯抗坏血酸为对照。
1.4.2 热敏稳定性测定
称取一定量的包合物于去离子水中,分别在20、30、40、60、80和100 ℃下100 r/min磁力搅拌1 h,测定释放的抗坏血酸含量,全程注意避光操作。以未包合的纯抗坏血酸为对照。
1.5 统计分析
每组实验均重复3次,实验结果以平均值±标准偏差表示。采用SPSS 17.0对数据进行方差分析,Ducan法进行显著性分析(p<0.05),Origin Pro 2016对数据绘图。
2 结果与讨论
2.1 超支化淀粉抗坏血酸包合物制备
2.1.1 超支化淀粉分支度
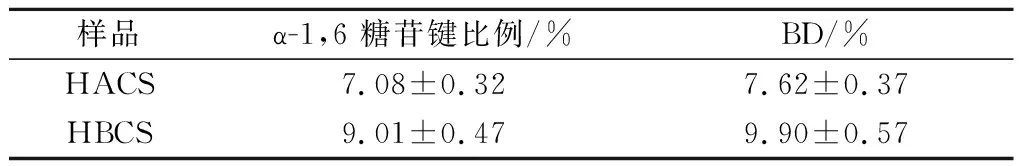
高直链玉米淀粉经过超支化改性后,α-1,6糖苷键化学位移在4.99 ppm,α-1,4糖苷键化学位移在5.39 ppm(图1)。超支化淀粉α-1,6糖苷键比例由7.08%增加到9.01%,提高了27.26%;其分支度从7.62%提高到9.90%,提高了29.92%(表3)。
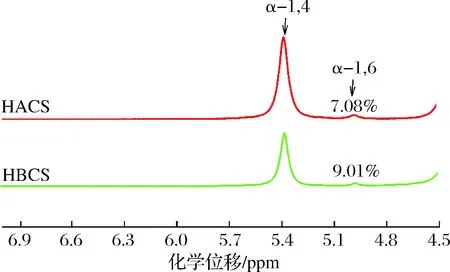
图1 高直链玉米淀粉和超支化玉米淀粉糖苷键化学位移Fig.1 Chemical shifts of glycosidic bonds of high amylose corn starch (HACS) and hyper-branched corn starch (HBCS)
表3 α-1,6糖苷键比例和分支度变化情况Table 3 Changes of ratio of α-1,6 glycosidic bonds and branching degree (BD)
样品α-1,6 糖苷键比例/%BD/%HACS7.08±0.327.62±0.37HBCS9.01±0.479.90±0.57
注:BD分支化度,即α-1,6 糖苷键比例与α-1,4 糖苷键比例的比值。
2.1.2 单因素实验结果
芯/壁比对包合物制备的影响在30 ℃下温育30 min后,芯/壁比对包合率的影响如图2-a所示。
由图2-a可知,随着芯材的不断增加,包合率不断提高并趋向平稳。一方面,在浓度差推动下,抗坏血酸的羟基通过氢键与超支化玉米淀粉的多分支枝杈附近葡萄糖糖环上的羟基结合;另一方面,超支化玉米淀粉在水溶液中呈现的球形构象松散程度导致枝杈的空腔大小对抗坏血酸包合产生了空间位阻。因此,在30 ℃温育30 min条件下,抗坏血酸浓度差推动力与超支化玉米淀粉空间位阻逐步达到平衡,随着抗坏血酸的含量逐渐增加,超支化淀粉的分支枝杈可供包合的空腔逐渐达到饱和,在芯/壁比(质量比)2.5∶1时达到最大包合率5.82%。由显著性分析可知,芯/壁比2∶1时包合率为5.57%与芯/壁比2.5∶1和3∶1时包合率没有显著差异,因此,本着经济节约的考虑,选择芯/壁比2∶1为最佳。
温度对包合物制备的影响在芯/壁比1∶1,温育30 min条件下,温度对包合率的影响如图2-b所示。
由图2-b可知,随着温度的逐渐提高,包合率逐步达到最大值后略微降低。温度升高,质热传递速率加快,温度达到40 ℃时,抗坏血酸在顺浓度梯度下和空间位阻作用平衡,与超支化淀粉结合达到饱和,包合率为4.85%。然而,随着温度的不断升高,一方面抗坏血酸自身会被氧化成脱氢抗坏血酸和2,3-二酮古乐糖酸,逐渐失去生物活性。另一方面,超支化淀粉、抗坏血酸、溶剂整体体系的熵增,球形构象的超支化淀粉之间的碰撞几率增加,分子间形成的枝杈空腔不稳定,不利于抗坏血酸的包合。由显著性分析可知,温度为30 ℃和40 ℃时,包合率没有显著差异,因此选择温度30 ℃为最佳。
时间对包合物制备的影响在芯/壁比(质量比)1∶1,30 ℃温育条件下,时间对包合率的影响如图2-c所示。
由图2-c可知,随着时间的延长,包合率呈现出先上升后下降的趋势。在包合60 min时达到最大包合率4.82%,随后包合率逐渐降低,这可能是由于抗坏血酸自身的不断氧化,或者是由于抗坏血酸在超支化玉米淀粉表面附近内外浓度差的推动下,部分吸附于超支化淀粉表面的抗坏血酸分子被解吸回溶液中。由显著性分析可知,最佳包合时间为60 min。
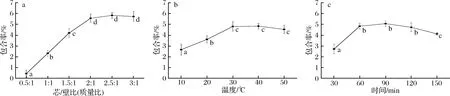
a-芯/壁比(质量比)对包合率的影响;b-温度对包合率的影响;c-时间对包合率的影响图2 工艺参数对包合率的影响Fig.2 Effect of time to the encapsulation rate
2.1.3 响应面实验结果
以芯/壁比、时间和温度为响应变量,包合率为响应值,建立包合工艺模型。实验结果如表4所示,模型方差分析如表5所示。

表4 Box-Benhnken实验方案和结果Table 4 Box-Benhnken design and results
续表4
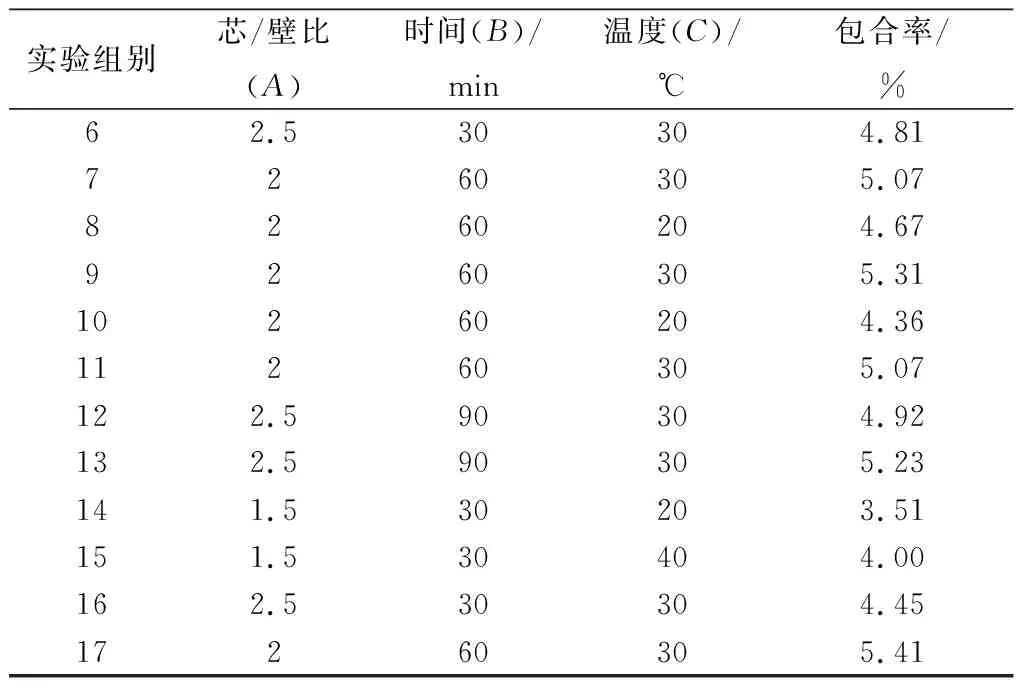
实验组别芯/壁比(A)时间(B)/min温度(C)/℃包合率/%62.530304.817260305.078260204.679260305.3110260204.3611260305.07122.590304.92132.590305.23141.530203.51151.530404.00162.530304.4517260305.41
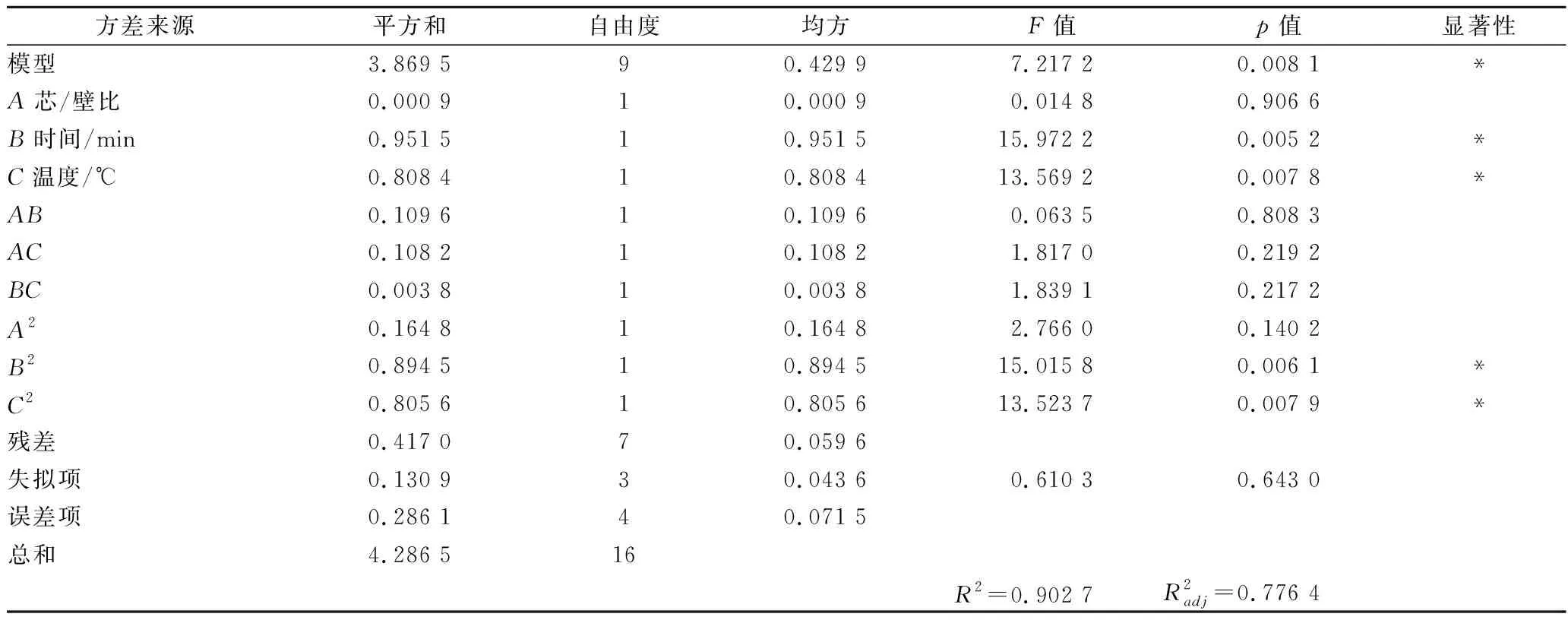
表5 模型方差分析Table 5 Analysis of variances for the model
注:*表示p<0.05,差异显著。

从图3可知,在芯/壁比(质量比)固定的情况下,考察时间和温度交互作用对包合率的影响。响应曲面越陡峭说明包合率对时间和温度的变化更敏感,同时等高线图也更加椭圆,反映出交互作用对包合率的明显变化。
由Box-Benhnken实验优化得到的工艺参数为芯/壁比1.52∶1(质量比)、时间76.38 min和温度33.21 ℃,此时包合率达到5.45%。考虑到实际操作的可行性,修正为芯/壁比1.5∶1(质量比)、时间75 min和温度33 ℃进行验证实验,包合率为5.19%,与模型预测包合率相符合。因此,该模型可以较好的评价超支化玉米淀粉与抗坏血酸的包合率。
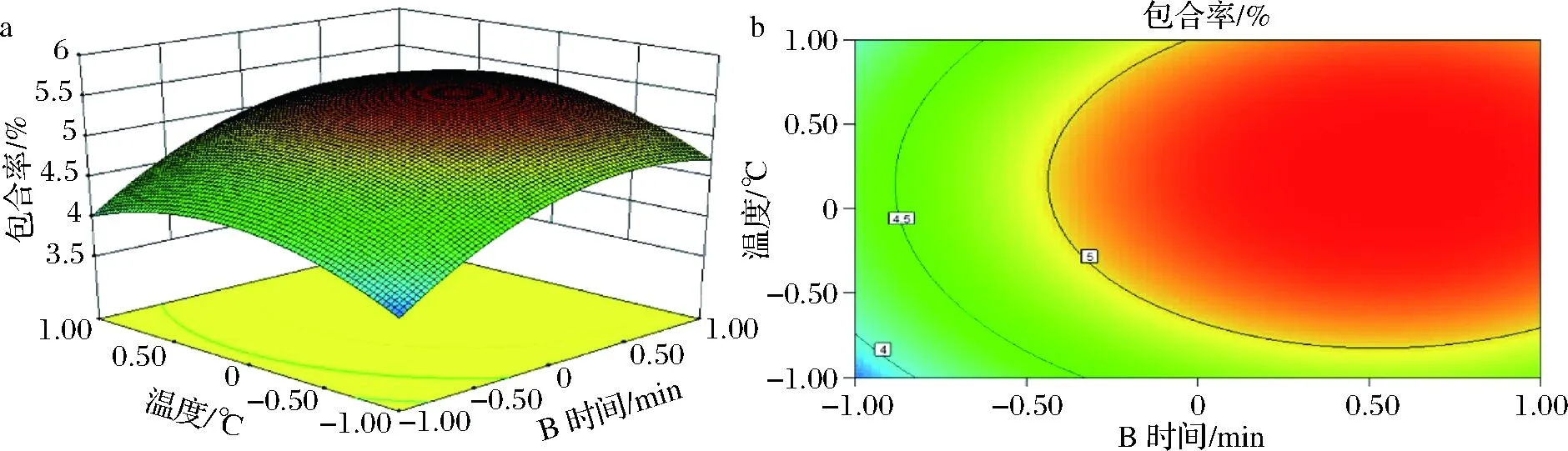
a-响应曲面;b-等高线图图3 时间温度交互作用对包合率的影响Fig.3 Effect of interaction of time and temperature to the encapsulation rate
2.2 傅立叶变换红外结构表征

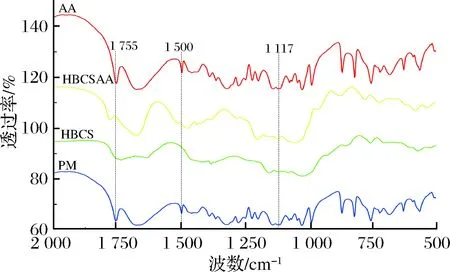
图4 抗坏血酸、超支化淀粉、超支化淀粉抗坏血酸物理 混合物和超支化淀粉抗坏血酸包合物的红外光谱Fig.4 The infrared spectra of ascorbic acid (AA), highly- branched corn starch (HBCS), highly-branched corn starch/ ascorbic acid physical mixture (PM) and highly-branched corn starch-ascorbic acid inclusion complex (HBCSAA)
2.3 包合物稳定性
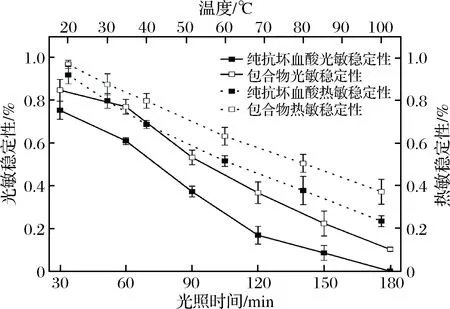
图5 包合物与纯抗坏血酸光热稳定性Fig.5 Photostability and themostability of highly-branched starch-ascorbic acid inclusion complex and pure ascorbic acid
由图5可知,随着温度的增加和光照时间的延长,包合物与未包合的抗坏血酸稳定性均呈现下降的趋势。但包合物的稳定性下降程度始终缓于未包合的抗坏血酸稳定性。在温度100 ℃时,包合物抗坏血
酸稳定性比未包合的高13.88%;当光照180 min后,未包合的抗坏血酸已经完全氧化而包合物还有10.23%的抗坏血酸残留。因此,超支化淀粉作为壁材可以有效的保护抗坏血酸并提高其稳定性。
3 结论与展望
本研究在最佳工艺条件芯/壁比(质量比)1.5∶1、时间75 min和温度33 ℃下,制备出超支化淀粉-抗坏血酸包合物,包合率为5.19%。超支化淀粉通过氢键与抗坏血酸形成包合物。经包合后,包合物在温度100 ℃时,抗坏血酸热敏稳定性提高13.88%,而光照180 min后,其光敏稳定性提高10.23%。后续工作考虑对该包合物进行模拟体外释放研究,以期考察其是否具有肠胃靶向释放功能。

