miR-509-3p在肝癌组织中的表达及对肝癌细胞迁移侵袭的影响
曹晶珠,郑 浩,陶元平,姚乃心,黄智平,汪珍光,黄 勤
1. 海军军医大学附属长海医院内分泌科,上海 200433;
2. 海军军医大学附属东方肝胆外科医院肝外三科,上海 200433;
3. 海军军医大学基础医学院,上海 200433;
4. 广州军区广州总医院肝胆外科,广东 广州510010
部分肝细胞肝癌(hepatocellular carcinoma,HCC)患者手术后的预后很差,导致这一结果的重要原因之一是肝癌转移。因此,寻找和揭示调控肝癌转移的重要基因和信号转导通路对于改善肝癌患者术后预后意义十分重大[1]。
MicroRNA(miRNA)是一类非编码RNA(长度为20~24 nt),通过影响靶基因mRNA的稳定性、转录后调控和翻译来发挥重要作用。许多miRNA可以直接作用于肿瘤转移相关基因的靶点,从而影响肿瘤迁移和侵袭能力[2]。越来越多的证据表明,miR-509-3p在多种肿瘤中异常表达,并且参与肿瘤细胞发生、发展、侵袭、转移和凋亡[3-5]。目前尚不清楚miR-509-3p具体对肝癌细胞的生物学效应和分子生物学机制。本研究采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测46例肝癌患者组织样本和肝癌细胞系中miR-509-3p的表达。体外细胞学实验检测miR-509-3p对肝癌细胞迁移的影响。蛋白质印迹法(Western blot)检测miR-509-3p与上皮-间质转化(epithelial-mesenchymal transition,EMT)相关分子基质金属蛋白酶(matrix metalloproteinase,MMP)-2和MMP-9蛋白表达之间的关系。我们的研究旨在阐明 miR-509-3p在肝癌转移中的作用和机制。
1 材料和方法
1.1 材料与试剂
46例HCC组织和配对的相邻癌旁组织来自于2013年6月—2014年10月在海军军医大学附属东方肝胆外科医院进行根治性手术的肝细胞癌患者。癌旁组织距离癌灶边缘超过5 cm。标本和相应的邻近组织来自同一肝癌患者。由海军军医大学附属东方肝胆外科医院拥有5年以上工作经验的病理科医师检查每例组织样本,确认组织类型。术后肿瘤组织立即冻存于-80 ℃液氮中以备后用。患者在手术前没有接受任何治疗。本研究经海军军医大学附属东方肝胆外科医院伦理委员会批准且所有患者均签署知情同意书。
永生化人正常肝细胞系LO2、人肝癌细胞系SMMC-7721、高转移性肝癌细胞株HCCLM3及MHCC97H购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
胎牛血清、DMEM高糖培养基、青霉素、链霉素、PBS均购自美国HyClone公司,miScript反转录试剂盒、MicroRNA RTFQ-PCR检测试剂盒均购自德国QIAGEN公司,TRIzol试剂盒、Lipofectamine™ 2000购自美国Invitrogen公司,Matrigel基质胶购自美国BD公司,RIPA裂解液、BCA蛋白检测试剂盒购自上海碧云天生物技术有限公司,MMP-9、MMP-2、GAPDH均购自美国Santa Cruz公司,miR-509-3p抑制剂(inhibitor)购自广州市锐博生物科技有限公司。
1.2 方法
1.2.1 RTFQ-PCR检测
组织和细胞的总RNA的提取过程参照文 献报道[6],参照miScript反转录试剂盒操作进行逆转录,得到cDNA,进行下一步反应。按照Real-Time Thermocycler 7500仪器说明书,每一样本和基因同时做3个复孔,输出数据为复孔Ct值的平均值,统计分析时采用2-ΔΔCt计算miR-509-3p的相对表达量。
miR-509-3p-上游引物序列为 5’-TCTTGCTGTTCCTGCTCCTG-3’,下游为 5’-AACACAGGCGCCTCTTCTAC-3’;U6-上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游为5’-ACGCTTCACGAATTTGCGT-3’。
1.2.2 细胞转染
细胞转染按照文献报道的方法[6]进行。将MHCC97H和HCCLM3细胞在37 ℃、CO2体积分数为5%的恒温培养箱中培养,培养基为含体积分数为10%胎牛血清的DMEM培养基。当细胞密度接近70%时,将miR-509-3p抑制剂应用LipofectamineTM2000相应的对照物进行转染。后续根据产品说明书进行所有的实验操作。根据转染物不同将细胞分为:
Ⅰ:空白对照组(MHCC97H-NC)、miR-509-3p抑制剂组(MHCC97H抑制剂);Ⅱ:空白对照组(HCCLM3-NC)、miR-509-3p抑制剂组(HCCLM3抑制剂)。通过RTFQ-PCR检测转染后miR-509-3p表达水平,验证转染效率。
1.2.3 细胞迁移和侵袭实验
细胞迁移和侵袭实验按照文献[6]报道的方法进行。实验选择稳定低表达miR-509-3p的MHCC97H、HCCLM3两种肝癌细胞系:MHCC97H抑制剂 vs MHCC97H-NC(阴性对照);HCCLM3抑制剂 vs HCCLM3-NC(阴性对照)进行细胞迁移和侵袭实验。将1.5×105个细胞重悬于不含FBS的300 μL DMEM培养基中且加入上室。将含10%FBS的500 μL DMEM培养基加入下室。在37 ℃、CO2体积分数为5%、湿润的条件下温育48 h后细胞进行固定和染色,选择5个随机视野进行镜下细胞计数。实验重复3次。
1.2.4 蛋白质印迹法(Western blot)检测
裂解细胞,提取总蛋白,采用BCA测定蛋白浓度试剂盒对蛋白进行定量后,进行SDSPAGE凝胶电泳,以MMP-9、MMP-2和GAPDH为一抗(1∶500稀释),二抗为相应的辣根过氧化物酶标记的IgG,电泳分离、转膜、显影及照相参见文献[6]方法操作。图片结果应用WO-9413B型凝胶成像系统自带软件Gelpro32分析目的条带平均灰度及背景灰度,前者减去后者作为统计分析数值。最后统计取值为其灰度值与相应内参灰度值比值。实验重复3次。
1.3 统计学处理
本研究采用SPSS 18.0统计软件对数据进行处理。各组间比较采用t检验进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-509-3p在HCC组织和细胞系中的表达情况
收集46例HCC组织和对应的癌旁组织,提取总RNA,反转录得到第一链cDNA,并进行RTFQ-PCR反应,得到Ct值,采用2-ΔΔCt表征两组之间miR-509-3p表达的倍数关系。其中U6为内参基因,miR-509-3p在癌组织中的表达水平是癌旁组织的1.50倍(P<0.001)。本研究提取MHCC97H、HCCLM3、SMMC-7721和LO2细胞的总RNA,反转录得到第一链cDNA,并进行RTFQ-PCR反应,得到Ct值,采用2-ΔΔCt表征各组之间miR-509-3p表达的倍数关系,其中U6为内参基因,LO2为对照组。结果显示,miR-509-3p在MHCC97H中的表达水平是LO2组的7.19倍(P<0.001),在HCCLM3中是LO2组的6.88倍(P<0.001),在SMMC-7721中是LO2组的3.86倍(P<0.001)。上述结果表明,miR-509-3p在MHCC97H、HCCLM3、SMMC-7721及LO2中的表达水平逐渐下降。结果证实miR-509-3p在肝癌中可能发挥促癌基因的作用,并且其异常高表达可能与肝癌细胞转移相关(图1)。
2.2 RTFQ-PCR验证转染抑制剂后miR-509-3p在MHCC97H和HCCLM3细胞中的表达情况
将构建好的miR-509-3p抑制剂转染至MHCC97H和HCCLM3两株HCC细胞中,48 h后收集细胞,提取总RNA,反转录得到第一链cDNA,并进行RTFQ-PCR反应,得到Ct值,采用2-ΔΔCt表征各组之间miR-509-3p表达的倍数关系,其中U6为内参基因,MHCC97H-NC组和HCCLM3-NC为对照组。结果显示,miR-509-3p在MHCC97H-NC组中的表达水平是MHCC97H抑制剂组的3.18倍(P<0.05);HCCLM3-NC是HCCLM3抑制剂组的3.16倍(P<0.05);NC组中miR-509-3p的表达水平高于抑制剂组,差异有统计学意义。这表明miR-509-3p抑制剂转染成功 (图2)。
2.3 降低miR-509-3p表达抑制MHCC97H和HCCLM3细胞迁移的侵袭能力
通过transwell实验(不含有基质胶)检测miR-509-3p对HCC细胞迁移能力的影响。结果显示,MHCC97H-NC组与MHCC97H抑制剂组穿过小室细胞数量比值为2.848,HCCLM3NC组与HCCLM3抑制剂组穿过小室细胞数量比值为2.870;与MHCC97H和HCCLM3的NC组相比,在MHCC97H和HCCLM3的抑制剂组穿过小室细胞数量显著下降,差异有统计学意义(P<0.001)。上述实验结果表明,抑制miR-509-3p的表达可以降低肝癌细胞的迁移能力(图3、4)。
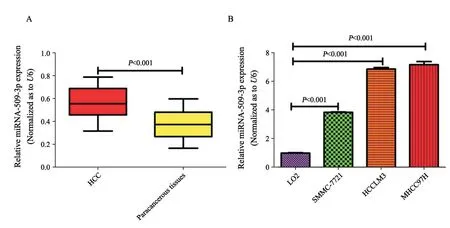
图 1 RTFQ-PCR检测miR-509-3p的表达情况 Fig. 1 Expression of miR-509-3p detected by RTFQ-PCR
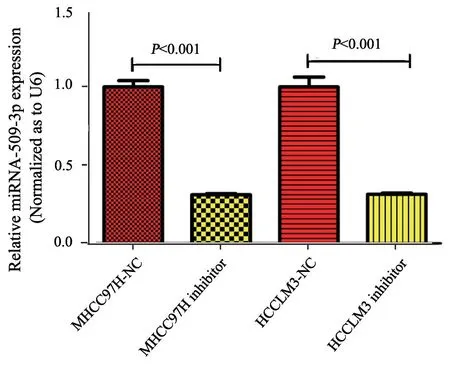
图 2 RTFQ-PCR检测转染miR-509-3p抑制剂后各细胞株中miR-509-3p的表达水平Fig. 2 Expression of miR-509-3p in highly metastatic HCC cell lines after transfection of miR-509-3p inhibitor detected by RTFQPCR
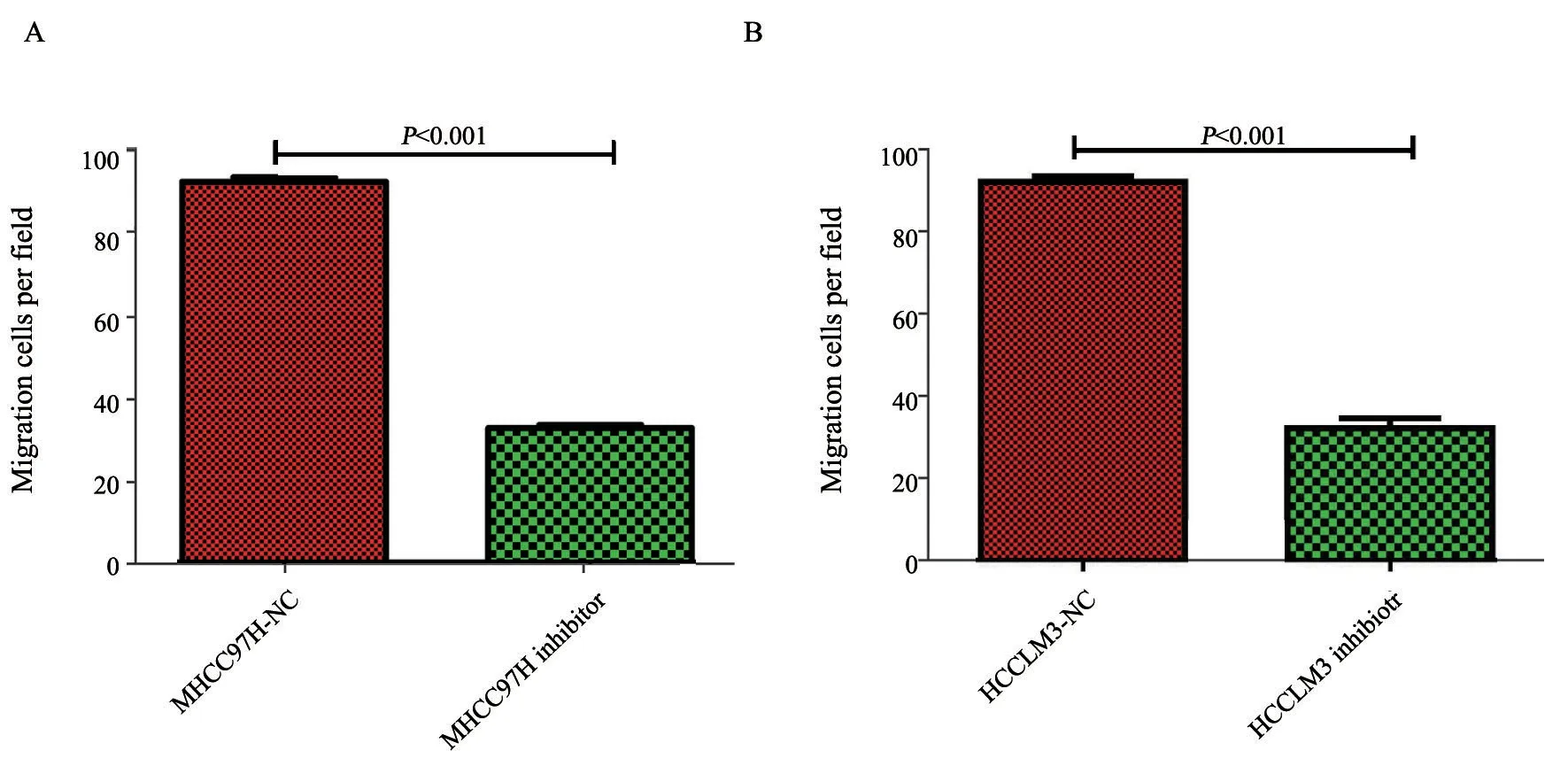
图 4 细胞转染miR-509-3p抑制剂后transwell迁移实验的细胞数Fig. 4 Cell count of transwell migration assay after transfection of miR-509-3p inhibitor
Transwell实验(含有基质胶)结果显示,MHCC97H-NC组与MHCC97H抑制剂组穿过小室细胞数量比值为2.375,HCCLM3-NC组与HCCLM3抑制剂组穿过小室细胞数量比值为2.529。与MHCC97H和HCCLM3的NC组相比,在MHCC97H和HCCLM3的抑制剂组穿过小室细胞数量显著下降,差异有统计学意义(P<0.001)。上述实验提示,抑制miR-509-3p的表达可以降低肝癌细胞的侵袭能力(图5、6)。
2.4 降低miR-509-3p表达对MHCC97H和HCCLM3细胞中MMP-9、MMP-2的蛋白表达的影响
将构建好的miR-509-3p抑制剂转染至MHCC97H和HCCLM3两株HCC细胞中,48 h后收集细胞,提取蛋白进行Western blot检测。本研究以GAPDH为内参基因,MHCC97H-NC和HCCLM3-NC组为对照组。Western blot检测结果显示,MHCC97H-NC组、MHCC97H抑制剂组、HCCLM3-NC和HCCLM3抑制剂组MMP-2/GAPDH的灰度值比值分别为1.832 7、0.352 7、1.921 3和0.340 3,MHCC97H-NC组、MHCC97H抑制剂组、HCCLM3-NC和HCCLM3抑制剂组MMP-9/GAPDH的灰度值比值分别为1.930 0、0.309 7、1.639 3和0.340 0。结果显示,与MHCC97H和HCCLM3的NC组相比,在MHCC97H和HCCLM3的抑制剂组中MMP-9和MMP-2的蛋白表达显著下调,差异有统计学意义(P<0.001)。上述结果提示,miR-509-3p可能通过正向调控MMP-9和MMP-2蛋白的表达来发挥促进肝癌细胞转移的作用(图7)。
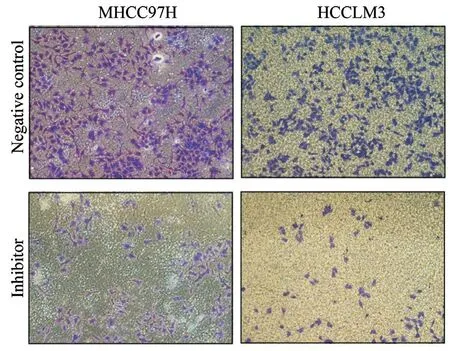
图 5 MHCC97H和HCCLM3细胞转染miR-509-3p抑制剂后的transwell侵袭实验 (×200)Fig. 5 Transwell invasion assay of MHCC97H and HCCLM 3 after transfection of miR-509-3p inhibitor (×200)
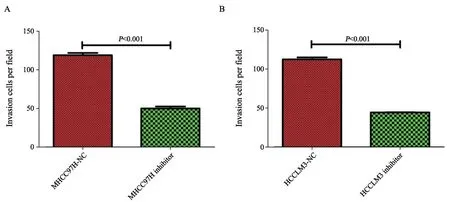
图 6 细胞转染miR-509-3p抑制剂后transwell侵袭实验的细胞数Fig. 6 Cell count of transwell migration assay after transfection of miR-509-3p inhibitor
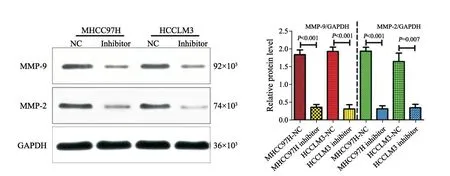
图 7 细胞转染miR-509-3p抑制剂后的Western blot实验Fig. 7 Expressions of MMP-2 and MMP-9 after transfection of miR-509-3p inhibitor detected by Western blot
3 讨 论
文献报道,miRNA在肿瘤的发生、发展过程中发挥着重要作用[2,7],miRNA的异常表达可能与肿瘤细胞的异常增殖、血管生成、侵袭和转移密切相关[8]。因此,深入研究miRNA网络调控机制有助于研究者深入了解肿瘤的进展过程以及建立预测和评估患者预后的风险模型。以往的文献报道证实miR-509-3p与肿瘤的发生密切相 关[4,9],然而对于miR-509-3p在肝癌中的研究鲜见报道。本研究首先检测了miR-509-3p在肝癌患者术后组织样本和肝癌细胞系中的表达情况,结果显示,miR-509-3p在HCC组织和高转移性肝癌细胞系中异常升高。通过构建MHCC97H抑制剂和HCCLM3抑制剂细胞系,探索miR-509-3p在HCC细胞中的生物学作用,结果发现,抑制miR-509-3p表达可降低肝癌细胞的迁移和侵袭能力。我们的研究结果提示miR-509-3p与肝癌转移 相关。
研究证实,EMT在肿瘤转移早期发挥着重要的作用[10-11]。EMT有一些比较明显的特征:E-钙黏蛋白(E-cadherin)、α-连环蛋白(α-catenin)、β-连环蛋白(β-catenin)等表达降低;N-钙黏蛋白(N-cadherin)和EMT相关的MMP表达升高,如MMP-2、MMP-3和MMP-9 等[12]。以往的研究和相关报道证明,miRNA确实能够通过影响EMT过程中的靶蛋白来对肿瘤细胞的迁移和侵袭产生影响[13-15]。本研究的临床数据和生物功能学实验提示,miR-509-3p与肝癌细胞的迁移和侵袭密切相关,结合EMT在肿瘤转移过程中发挥的重要作用,我们推测miR-509-3p有可能通过EMT途径促进肝癌细胞的迁移和侵袭。本研究通过Western blot检测证实在高转移性HCC细胞系中抑制miR-509-3p表达后,MMP-2和MMP-9的表达也显着降低,表明miR-509-3p通过某些重要信号通路促进HCC细胞的EMT过程。
综上所述,本研究证实miR-509-3p在HCC组织中高表达,同时高转移性的HCC细胞系中亦上调。功能学实验证实降低miR-509-3p可抑制肝癌细胞的迁移和侵袭能力,EMT相关分子MMP-2、MMP-9的表达亦显著降低。基于以上研究结果,我们推测miR-509-3p可通过调控MMP-2和MMP-9蛋白的表达来促进HCC细胞EMT的过程,从而增强HCC细胞的迁移和侵袭能力。miR-509-3p的具体靶基因还有待进一步研究。

