青海高原耐旱蚕豆品种青海13号响应干旱胁迫蛋白质组学分析
李 萍 侯万伟 刘玉皎,*
青海高原耐旱蚕豆品种青海13号响应干旱胁迫蛋白质组学分析
李 萍1,2侯万伟1,2刘玉皎1,2,*
1青海大学农林科学院, 青海西宁 810000;2青海大学省部共建三江源生态与高原农牧业国家重点实验室, 青海西宁 810000
蛋白质组学研究在功能基因组时代发挥着越来越重要的作用, 利用双向电泳技术和质谱鉴定技术, 可大量研究作物逆境胁迫后蛋白质组的变化, 增加作物响应干旱胁迫机制的认识和理解。为探讨一种抗旱性蚕豆青海13号品种的耐旱机制, 本研究对其幼苗期进行干旱胁迫处理, 应用上述技术进行差异蛋白质组分析, 经检验发现32个差异表达蛋白点, 部分呈现上调表达, 部分呈现下调表达, 还有7个消失蛋白点和1个新增蛋白点。采用MALDI-TOF/TOF鉴定和生物信息学分析发现, 成功鉴定的21个蛋白点按其所参与的代谢途径和生化功能可分为七大类, 参与信号转导的2个, 参与自由基清除的1个, 参与防卫反应的1个, 参与代谢的8个, 参与蛋白加工的1个, 参与光合的5个, 未知功能蛋白3个。22 kD干旱诱导蛋白、应激诱导蛋白、17.5 kD一级热激蛋白、超氧化物歧化酶是与抗旱性有直接关联的蛋白点, 其相对表达量的上调可能是青海13号蚕豆具有较强抗旱性的重要原因。
蚕豆; 干旱胁迫; 蛋白质组; 差异表达; 功能分类
干旱是胁迫因素中对植物的生长发育影响最大的因子之一, 而对农作物造成的损更是严重[1], 在众多非生物胁迫中占首位。有学者在关于植物的抗性研究中指出在水分胁迫下植物能够产生一系列包括形态、生理生化及分子生物学等多方面的变化而表现出抗旱能力, 这些适应性调节反应是植物自身的保护性选择[2-3]。蛋白质组学是研究生物体在特定时间或空间内所表达的全部蛋白质的特征, 是揭示植物与胁迫之间相互作用分子机制的一种新手段。随着蛋白质组学的发展和植物蛋白质组学研究的日趋深入, 以通过研究植物在非生物逆境胁迫过程中抗逆相关蛋白质的表达而进一步了解逆境胁迫的伤害机制及植物的逆境适应机制的逆境蛋白质组学研究成为热点[4–6]。双向凝胶电泳是蛋白质组学研究的一个重要支撑技术, 结合质谱技术,仍是目前最常用和可靠的蛋白质分离鉴定技术平台, 涉及豆科作物逆境胁迫后蛋白质组的变化, 屡有对获得的差异蛋白进行功能研究的报道。Mohammadi等[7]对干旱胁迫和PEG渗透胁迫处理的大豆幼苗研究发现, 胁迫处理下叶片中代谢相关蛋白表达上调, 能量和蛋白质合成相关蛋白下调表达, 叶片、根、下胚轴这3个器官中蛋氨酸合成酶的mRNA与蛋白水平均下调, 蛋氨酸合成酶是一种干旱反应蛋白, 其下调表达抑制了大豆幼苗的正常生长。蛋白质组学在菜豆干旱胁迫[8]、冷胁迫[9]和紫花苜蓿[10]盐胁迫、箭舌豌豆[11]化学胁迫等方面得以广泛应用, 为深入开展豆科作物抗逆蛋白质组学研究提供了参考和借鉴。本课题组前期对水分胁迫下蚕豆叶片蛋白质组变化初探发现, 胁迫后的叶片差异蛋白中下调表达的占大多数且主要与胁迫防御、代谢和能量、细胞骨架以及氧化平衡有关, 上调表达的相对较少, 主要参与蛋白折叠与聚集以及光合系统[12]。
蚕豆(L.)属蝶形花科野豌豆属, 是世界上重要的豆科作物, 也是青海高原重要的粮食、蔬菜、副食、饲料和养地兼有作物, 在该省农业经济生产和生态保护中占有重要的地位。本研究采用人工控水模拟干旱胁迫, 研究叶片蛋白质水平的响应, 发掘与蚕豆抵御干旱胁迫相关蛋白, 为后续的抗旱基因克隆和抗逆分子育种工作提供有力技术支持和理论基础。
1 材料与方法
1.1 试验材料及处理
青海13号是农业生产中表现强抗旱性的蚕豆品种, 由青海省农林科学院提供。挑选色泽正常无病斑的种子, 经10%次氯酸溶液消毒及蒸馏水漂洗, 置玻璃培养皿中25℃恒温光照培养催芽, 24 h后挑选发芽一致的蚕豆种子种植在抗旱棚中, 播种4周后待蚕豆幼苗长至二叶一心时进行不同梯度人工控水模拟干旱胁迫处理。第1天, 对第10排蚕豆(DS9)停止供水, 由其蒸腾作用开始进行自然干旱; 第2天, 对第9排蚕豆(DS8)停止供水开始自然干旱; 以此类推, 直到第2排蚕豆(DS1)开始干旱胁迫, 以正常供水为对照(CK)。
1.2 IEF/SDS-PAGE双向电泳技术及质谱分析
参照改良后的TCA/丙酮法[13], 略有改进, 提取叶片总蛋白。第一向IEF采用17 cm, pH 3~10 (NL)固相胶条, 上样量900 µg; 第二向采用12%的聚丙烯酰胺分离胶进行SDS-PAGE电泳。电泳结束后以考马斯亮蓝染色经UMAX Power look 2100 XL型光密度扫描仪扫描, 以300 dpi分辨率采集图像。采用PD Quest 8.0.1软件比较处理组和对照组的叶片总蛋白2-DE图谱, 通过差异蛋白点检测, 凝胶图谱标准化处理, 蛋白质点匹配和生物统计, 确定差异表达的蛋白质点, 实验重复3次数据进行-test检验, 倍数变化>2或<0.5为差异蛋白。挖取差异表达蛋白质点送上海鹿明生物有限公司进行MALDI- TOF/TOF串联质谱分析, 采用ABI5800串联飞行时间质谱仪进行质谱点靶鉴定, 获得的PMF的质谱扫描范围为800~3500 Da, 对选择强度最大的10个峰进行二级质谱, 将一级和二级质谱数据整合并使用GPS 3.6 (Applied Biosystems)和Mascot2.3(Matrix Science)对质谱数据进行分析和蛋白鉴定。进行NCBInr-Other green plants数据库检索, 消化多肽的酶为胰蛋白酶, 允许最大漏切位点为1, 固定修饰为Carbamidomethyl (C), 可变修饰为Acetyl (Protein N-term)、Deamidated (NQ)、Dioxidation (W)和Oxidation (M), MS tolerance为0.0001 Da, MS/MS tolerance为0.3 Da, Protein score C.I.%大于95%为鉴定成功。
2 结果与分析
2.1 干旱胁迫最适时期确定
土壤含水量(SWC)是表征干旱胁迫程度的一个重要的正相关指标。通过图1可以看出, SWC呈显著下降趋势, 从42.67% (SWCCK)下降到6.7% (SWCDS9),与对照相比各处理间差异极显著, 说明本实验采用的不同干旱胁迫梯度设置成功, 从DS1到DS9干旱胁迫程度逐渐加强。其中, DS3的SWC下降迅速, 出现一个“折点”, 胁迫继续增加, DS4和DS5与DS6至DS9胁迫间差异不显著。由此可见, 可在后续蚕豆抗旱性研究中直接选择DS3作为干旱胁迫的最适处理期。植物叶片相对含水量(RWC)是衡量植物持水能力强弱的重要指标, 在一定程度上体现植物抗旱能力。由图1可以看出, 随着胁迫时间的延长, 蚕豆叶片RWC呈下降趋势, 但与正常供水对照相比, 直到干旱胁迫DS4时其RWC含量才与CK差异显著。值得注意的是, 在干旱胁迫处理下, SWC在DS3处理期极显著减小(<0.01)的情况下蚕豆叶片的RWC与对照相比在0.05水平上无显著差异, 这也是实验材料青海13号具有抗旱性的一个生理表现, 选择此材料非常具有代表性。
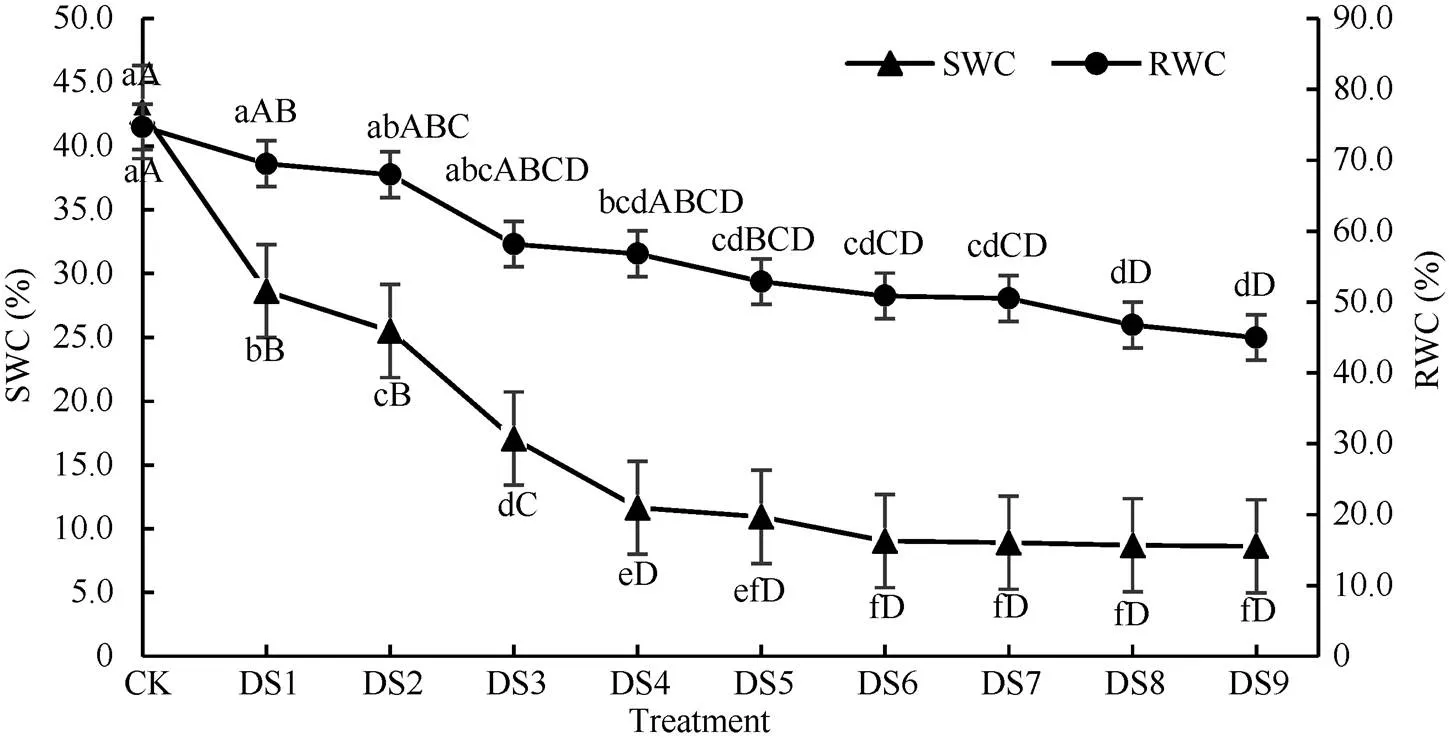
图1 不同梯度干旱胁迫下土壤含水量(SWC)和蚕豆叶片的相对含水量(RWC)变化
大写字母表示不同胁迫处理间0.01水平上显著性差异, 小写字母表示0.05水平上差异显著。DS1~DS9为不同梯度干旱胁迫处理, 从DS1到DS9干旱胁迫程度逐渐加强。
The letter denotes differences between stress degree: the same letters indicate significant difference at the 0.05 probability level; Capital letters indicate significant difference at the 0.01 probability level. DS1–DS9 are drought stress treatments and the drought stress degrees gradually strengthened from DS1 to DS9.
2.2 双向电泳图谱构建和质谱分析
DS3胁迫处理是适宜的胁迫条件, 故取此处理时期的蚕豆叶片进行下一步分析。利用本课题组前期建立的改良后的TCA/丙酮法分别提取对照组和处理组叶片总蛋白进行双向电泳, 经考马斯亮蓝染色后获得最终电泳图谱(图2)。
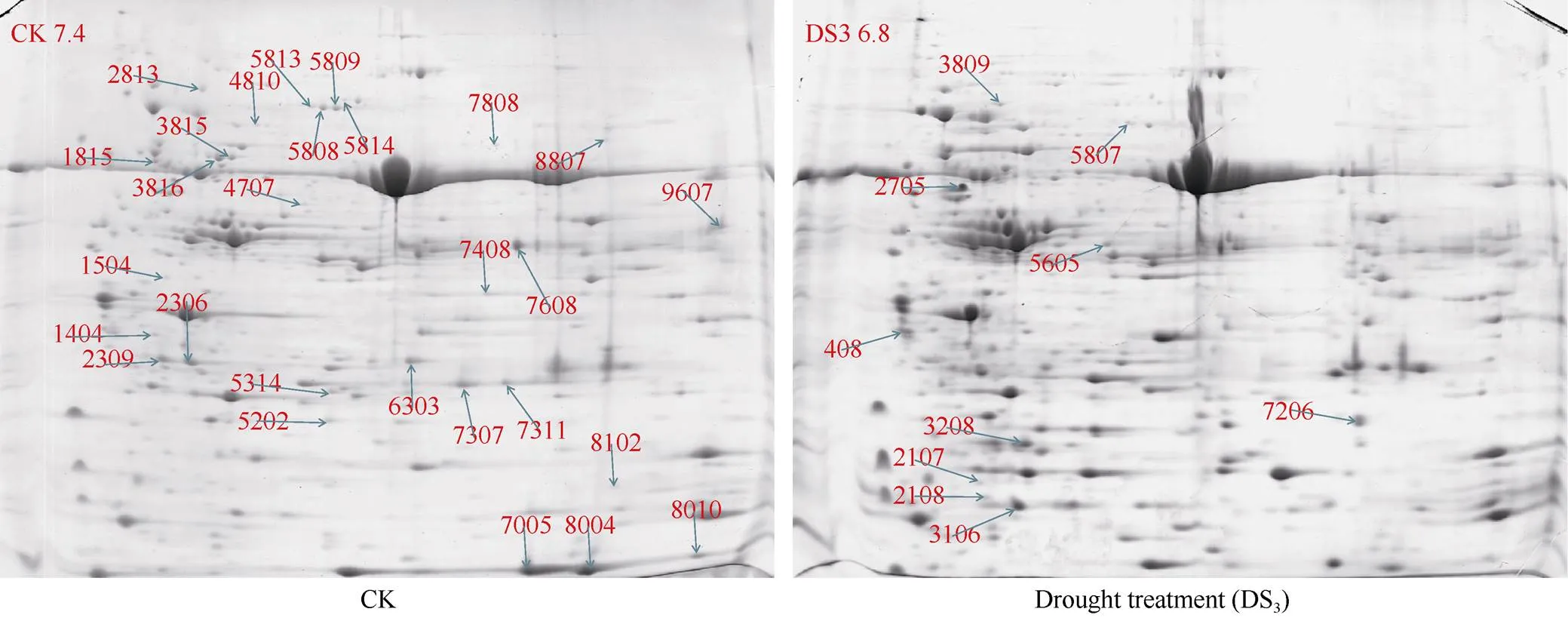
图2 干旱胁迫下蚕豆叶片蛋白质组双向电泳图谱
应用PD Quest8.0.1软件对凝胶图谱进行分析, 结合人工筛选,-检测, 共有38个蛋白点的表达发生显著变化(Fold>2.0或<0.5,<0.05)。处理组相对于正常对照组有10 个差异蛋白点的相对表达量上调,占总差异蛋白点的26.3%, 其中特异表达的差异蛋白1个(3809)。而28个差异蛋白点的相对表达量下调, 占总差异蛋白点的73.7%, 其中消失的蛋白点7个。挖取蚕豆叶片2-DE凝胶对差异蛋白点进行MALDI-TOF-TOF质谱分析, 通过MASCOT数据库对获得的数据信息进行搜索比对, Mowse Score大于65分的蛋白即为鉴定的蛋白。通过分析成功鉴定了38个差异蛋白点中的27个, 鉴定率为71.1%, 这些成功鉴定的蛋白点的具体信息列于表1。鉴定结果表明,有多个蛋白点被鉴定为一个相同蛋白, 如叶绿素/结合蛋白AB80 (gi|115788: 蛋白点2036和2309), ATP合酶CF1 (gi|528749836: 蛋白点3815和3816), 质体转酮醇酶(gi|357445031: 蛋白点5808和5809), 碳酸酐酶叶绿体X1 (gi|502090577: 蛋白点6303、7307和7311), 核酮糖-二磷酸羧化小链3C (gi|132097: 蛋白点7005和8004), 最后27个成功鉴定的蛋白代表了21个非冗余的蛋白质。
2.3 差异蛋白的功能及生物信息学分析
根据鉴定出来的21个差异蛋白所参与的代谢途径和生化功能将其分为7类(图3)。(1)参与信号转导的2个蛋白, 占所有蛋白的10%, 分别为22 kD干旱诱导蛋白(drought inducible 22 kD protein, spot 2705)和应激诱导蛋白(stress-inducible protein, spot 5807)。(2)参与自由基清除的1个蛋白, 超氧化物歧化酶(superoxide dismutase, spot 3106)。(3)参与防卫反应的1个蛋白, 17.5 kD一级热激蛋白(17.5 kD classⅠHSPza, partial, spot 3208)。(4)参与代谢的8个蛋白占到所有蛋白的38%, 属于最大一类, 分别为莽草酸酯脱氢酶(Shikimate dehydrogenase substrate binding, N-terminal, partial (ISS), spot 3809)、乙酰丝氨酸裂解酶(0-acetylserin(thiol)lyase, spot 5605)、胰蛋白酶抑制剂(Kunitz-type trypsin inhibitor-like 2 protein, spot 7206)、1,4-前体D-麦芽糖水解酶(1,4-alpha- D-glucan maltohydrolase, spot 1815)、ATP合酶CF1 (ATP synthase CF1 alpha subunit, spot 3815)、S-腺苷甲硫氨酸合酶(S-adenosylmethionine synthase 2, spot 4707)、质体转酮醇酶(plastid transketolase, spot 5808)和脱卤素酶水解酶(haloacid dehalogenase-like hydrolase domain-containing protein At3g48420, spot 1404)。(5)参与蛋白加工的1个蛋白, nascent肽-关联复合体亚基蛋白I (nascent polypeptide-associated complex subunit alpha-like protein 1, spot 408)。(6)参与光合的5个蛋白, 分别是叶绿体/结合蛋白AB80 (chlorophyll/binding protein AB80, spot 2306)、叶绿体/结合蛋白8 (chlorophyll a/b binding protein 8, chloroplastic-like, spot 5314)、RuBisCO小亚基3C (Ribulose bisphosphate carboxylase small chain 3C, spot 7005)、碳酸酐酶、叶绿体同型X1 (carbonic anhydrase, chloroplastic isoform X1, spot 7307)和光合系统II修补蛋白PSB27-H1 (photosystem II repair protein PSB27-H1, spot 8010)。(7)未知功能蛋白3个, 假定蛋白TSUD-183880 (hypothetical protein TSUD_183880, spot 2813)、未知蛋白(gi|217071344, spot 5202)和未命名的蛋白(unnamed protein product, spot 7608)。
基于主流的数据库David 6.7和QuickGO (http://www.ebi.ac.uk/QuickGO/)将21个差异表达蛋白点进行质谱搜库检索得到ID, 同源映射到模式植物拟南芥上进行GO (gene ontology)富集差异表达蛋白生物信息学分析(图4)。从图中可以看出, 这21个差异蛋白在生物过程富集分析中参与了20个生物学过程, 主要参与光合系统、有机化合物代谢、有机物生物合成、响应非生物刺激等生物过程; 在细胞定位富集中可以定位到类囊体、细胞质、细胞器部分、胞内细胞器、核糖核蛋白复合物、外部包装结构、蛋白酶体核心复合物7个细胞中, 其中在细胞质、细胞器部分及胞内细胞器富集蛋白百分比均超过50%; 在分子功能富集分析中, 21个差异蛋白在未折叠蛋白、前蛋白、核苷磷酸、核苷酸、核苷、核糖核苷酸、同类蛋白、几丁质、热休克蛋白等的结合及转移酶活性、阴离子配位和异构酶活性中发挥功能, 其中参与核苷磷酸结合和核苷酸结合的蛋白富集百分比均为38.2%, 参与核苷结合和核糖核苷酸结合的蛋白富集百分比均为31.1%, 而参与阴离子配位的蛋白富集百分比为34.6%。

3 讨论
植物在遭受干旱等逆境胁迫后基因表达发生改变,表现出原来一些蛋白的合成受到抑制, 也会新合成一些蛋白[14-15], 它们是植物抗旱一系列生理生化反应的基础, 因此分析胁迫前后蛋白组的变化对从蛋白质水平了解植物的抗逆机制是很有帮助的[16-18]。比起蛋白的增加或新蛋白的出现, 干旱更容易引起蛋白含量的减少或丢失[19], 本研究中双向电泳分析结果也得出了相同的结论, 在分离到的38个差异蛋白点中, 下调表达蛋白数量高于上调表达蛋白, 其中消失的蛋白有7个(spot 1504、spot 5202、spot 5314、spot 5814、spot 7311、spot 7808、spot 8102),说明干旱胁迫抑制了蚕豆植物体某些蛋白的合成来提高对干旱环境的适应性, 亦或提高一些蛋白的表达量(8个上调表达蛋白), 同时又诱导产生一些新的蛋白如莽草酸之脱氢酶(Shikimate dehydrogenase substrate binding, N-terminal, partial (ISS), spot 3809), 从而提高蚕豆植株对干旱的耐受能力。利用MALDI-TOF/TOF串联质谱分析技术成功鉴定了21个非冗余的干旱响应相关差异蛋白, 涉及信号转导、防卫反应、光合作用、能量代谢、自由基清除、蛋白加工等过程, 还有部分获得的蛋白为未知功能蛋白。
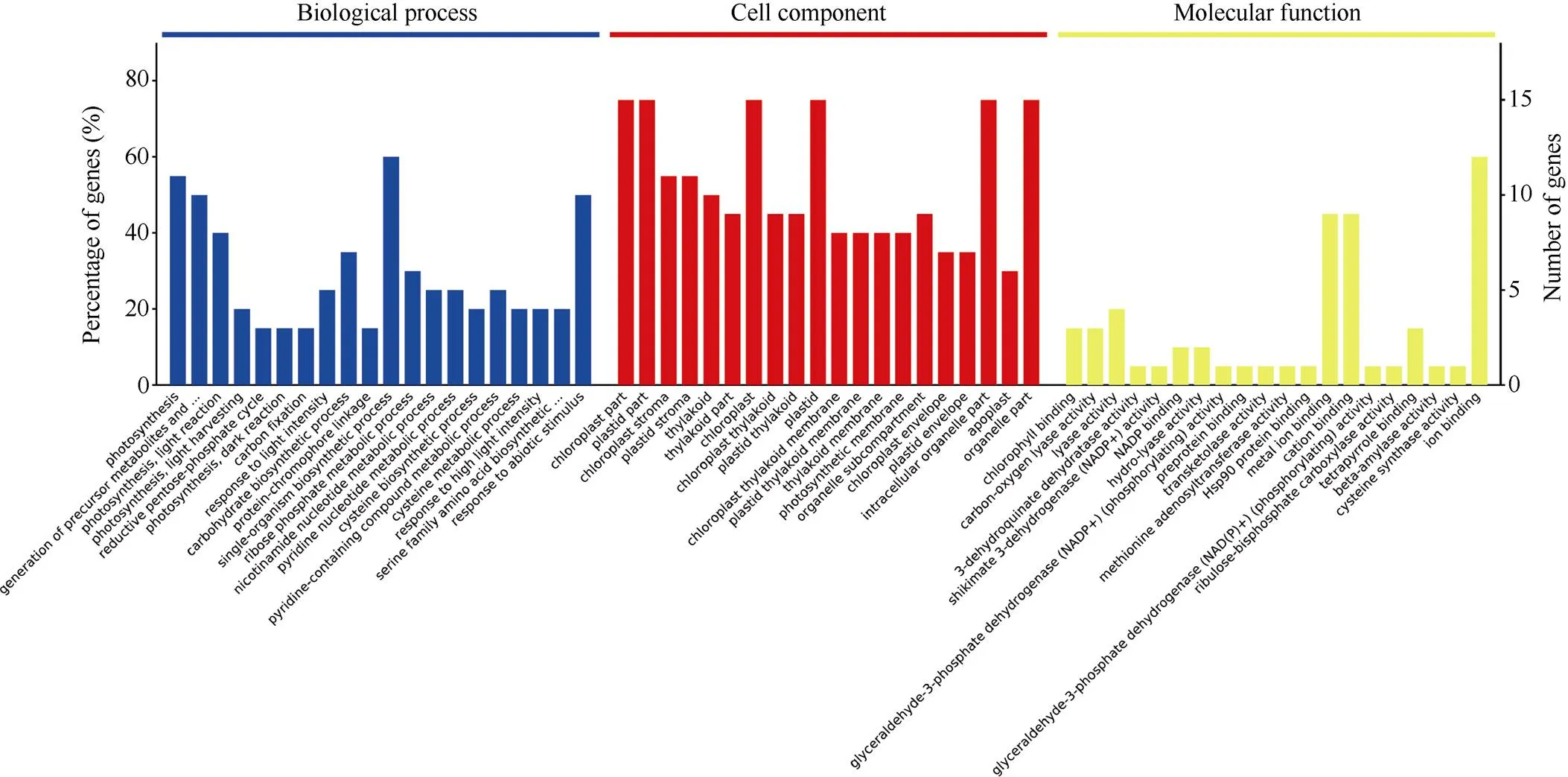
图4 差异蛋白GO功能分类
本研究中参与信号转导的Drought inducible 22 kD protein (spot 2705)和stress-inducible protein (spot 5807)等蛋白表达丰度均上调, 推测蛋白酶体的增加有利于清除在干旱胁迫条件下产生的非正常蛋白。Desclos等[20]发现油菜干旱诱导的22 kD蛋白同时具有水溶性叶绿素结合蛋白活性和胰蛋白酶抑制剂活性, 它能通过保持蛋白的完整性和正常的光合作用保护油菜幼嫩组织不受逆境的影响。这说明Drought inducible 22 kD protein和Stress-inducible protein表达量的上升对青海13号蚕豆的抗旱性发挥了重要的作用。在植物应对非生物胁迫中活性氧(ROS)伤害植物的膜系统和体内大分子, 是新陈代谢的有毒副产物, 而超氧化物歧化酶(SOD)是可解除胁迫条件下植物体内产生的多余活性氧分子的一类重要的活性氧清除酶, 此类表达量的增加使植物减少或免除胁迫对植物的伤害, 提高其抗逆性[21-22]。我们发现, 干旱胁迫下超氧化物歧化酶(superoxide dismutase, spot 3106)被诱导表达, 这与豌豆[23]、水稻[24]等作物中的研究结果一致, 是青海13号蚕豆品种对干旱胁迫的一种应激性生理响应, 推测这也是青海13号具有强抗旱性的原因所在。热激蛋白(heat shock protein, HSP)是干旱胁迫物质形成的必需因子, 表达量的升高是植物适应胁迫的一种机制,有利于维持胁迫调节下蛋白的稳定性和维持植物生存与生长, 可以提高植株的抗逆能力, 在胁迫中的作用己经被广泛地研究[25-26]。研究者Sato和Yokoya[27]发现超表达sHSP17.7基因可提高干旱处理的水稻植株抗旱性,在水稻叶片蛋白质组分析中也发现干旱胁迫调节多个热激蛋白上调表达[28-29]。本研究中发现干旱胁迫使17.5 kD一级热激蛋白(spot 3208)表达上调, 这说明青海13号蚕豆在干旱胁迫下通过诱导热激蛋白的增加来对逆境适应起保护作用这也是该品种具有抗旱性的原因所在。氧乙酰丝氨酸裂解酶(0-acetylserin(thiol)lyase)是半胱氨酸合成最后一步的关键酶, 在半胱氨酸的合成调节中占据核心地位, 植物体内的一些含硫化合物(如谷胱甘肽)可通过一些生化反应途径淬灭这些游离基团, 从而提高植物体的抗逆性, 我们在干旱胁迫处理下发现了差异上调表达蛋白中包括此蛋白(spot 5605)。干旱诱导蛋白是指植物在受到干旱胁迫时新合成或合成增多的一类蛋白, 干旱诱导蛋白的形成是植物抵御干旱胁迫的主动保护机制[30]。本研究发现在分离鉴定的众多差异蛋白中, 莽草酸酯脱氢酶(shikimate dehydrogenase substrate binding, N-terminal, partial (ISS), spot 3809)是新产生的一类干旱诱导蛋白。莽草酸途径是存在于植物中的一条重要的代谢途径, 与植物应对环境刺激相关联, 而莽草酸酯脱氢酶是一类促进莽草酸途径的关键性酶之一[31–32], 我们推测此干旱诱导蛋白对青海13号蚕豆的抗旱性有贡献。植物抵抗环境胁迫的一个重要机制是调节基因的表达, 严顺平[24]在水稻抗逆性研究中推测新生肽结合蛋白复合物的α亚基(α-NAC)可能参与了水稻抗逆的基因表达的调节。也有证据表明新生肽结合复合物的α亚基可以作为转录的激活子[33], 在我们的研究中α-NAC (spot 408)在干旱胁迫下表达量上调, 这可能影响了整个NAC的功能, 维持胁迫下基因转录、蛋白质翻译和定位的正常进行, 保持了蚕豆正常的生理功能, 表现出了抗旱性。
光合作用是绿色植物产生糖类等各种有机物的起始反应,是蚕豆产量构成的唯一来源, 对于干旱、盐渍等很多非生物胁迫来说都是一个非常敏感的生物学过程[34-35], 所以在本研究中发现干旱胁迫处理引起许多参与光合作用的蛋白表达发生变化并不奇怪。我们通过蛋白质组学的分析发现,很多参与光合作用的蛋白在干旱胁迫下被降解或者差异表达, 这也表明了光合作用对干旱胁迫信号也是非常敏感的。Chlorophyll/binding protein AB80 (spot 2306)、chlorophyll/binding protein 8 (spot 5314)和photosystem II repair protein PSB27-H1 (spot 8010)都是与光合系统密切相关的蛋白, 蛋白表达的下降也验证了在干旱胁迫下, 植物叶片的光合作用受到抑制。ATP合酶CFI亚基(spot 3815)是与能量代谢相关的酶, 这些ATP合酶亚基在干旱胁迫下被降解将不可避免地影响光合磷酸化产生ATP进一步影响光合作用的卡尔文循环。在干旱胁迫条件下, 植物通过改变体内的初级代谢如碳的能量代谢使其达到新的平衡状态[36], 本研究发现参与糖代谢途径的磷酸戊糖途径的关键酶, 转酮醇酶(transketolase, TK, spot 5808)在干旱胁迫下表达量下调, 说明干旱胁迫下磷酸戊糖途径受到抑制。S-腺苷甲硫氨酸合酶2 (SAMS2)是植物合成木质素的关键酶, 其下降表达表明木质素以及其他相关的次生代谢产物的合成下降, 以利于减少不必要的能量和物质的消耗。本研究中干旱胁迫下SAMS2 (spot 4707)蛋白表达下调, 前人在研究水稻响应盐胁迫和干旱胁迫的蛋白质组变化时也发现SAMS2的蛋白水平被下调[37], 推测此蛋白也与青海13号蚕豆抗旱性有关联。
4 结论
在干旱胁迫下, 青海 13 号蚕豆叶片与信号转导、自由基清除、防卫反应、能量代谢及蛋白加工等相关的蛋白主要表现为上调表达中发现了一个新的干旱胁迫响应蛋白莽草酸酯脱氢酶(shikimate dehydrogenase substrate binding, N-terminal, partial (ISS), spot 3809), 推测是青海13号蚕豆具有抗旱性机制所在。这些为我们深入了解蚕豆对干旱胁迫的响应提供了新的线索, 也是利用遗传等手段进一步研究这些基因功能的开始。
[1] Pandey A, Chakraborty S, Datta A, Chakraborty N. Proteomics approach to identify dehydration responsive nuclear proteins from chickpea (L.)., 2008, 7: 88–107.
[2] Marie P R, Vartavian N, Sallantin M. Characterization of a novel protein induced by progressive or rapid drought and salinity inleaves., 1992, 100: 1486–1493.
[3] Ingram J, Bartels D. The molecular basis of dehydration tolerance in plant., 1996, 47: 377–403.
[4] Levenfors J P, Wikstr M M, Persson L, Gerhardson B. Pathogenicity of aphanomyces spp from different leguminous crops in Sweden., 2003, 10: 535–543.
[5] Agrawal G K, Pedreschi R, Barkla B J, Bindschedler L V, Cramer R, Sarkar A, Renaut J, Job D, Rakwal R. Translational plant proteomics: A perspective., 2012, 75: 4588–4601.
[6] DO Thanh-Trung, 李健, 张风娟, 杨丽涛, 李杨瑞, 邢永秀. 甘蔗与抗旱性相关差异蛋白质组分析. 作物学报, 2017, 43: 1337–1346. DO T T, Li J, Zhang F J, Yang L T, Li Y R, Xing Y X. Analysis of differential proteome in relation to drought resistance in Sugarcane., 2017, 43: 1337–1346 (in Chinese with English abstract).
[7] Mohammadi P P, Moieni A, Hiraga S, Komatsu S. Organ-specific proteomic analysis of drought-stressed soybean seedlings., 2012, 75: 1906–1923.
[8] Zadražnik T, Hollung K, Egge-Jacobsen W. Differential proteomic analysis of drought stress response in leaves of common bean (L.)., 2013, 78: 254–272.
[9] Badowiec A, Weidner S. Proteomic changes in the roots of germinatingseeds in response to chilling stress and post-stress recovery., 2014, 2: 389–398.
[10] 熊军波, 杨青川, 蔡化, 田宏, 张贺山, 刘洋. 紫花苜蓿根响应盐胁迫的比较蛋白质组学分析. 湖北农业科学, 2015, 54: 5422–5428. Xiong J B, Yang Q H, Cai H, Tian H, Zhang H S, Li Y. Comparative proteomic analysis of salt-stress response of alfalfa proteins in Root., 2015, 54: 5422–5428 (in Chinese with English abstract).
[11] 芮海云, 庄凯, 沈振国, 张芬琴. 两个箭舌豌豆品种根响应镉胁迫的蛋白质组学分析. 植物生理学报, 2016, 52: 1089–1098. Rui H Y, Zhuang K, Sheng Z G, Zhang F Q. Proteomics analysis of cadmium stress responses in the roots of twovarieties differing in Cd tolerance., 2016, 52: 1089–1098 (in Chinese with English abstract).
[12] 李萍, 张雁霞, 刘玉皎. 干旱胁迫对抗旱性蚕豆幼苗生长特性影响及叶片差异蛋白质组学研究. 基因组学与应用生物学, 2017, 36: 340–351. Li P, Zhang Y X, Liu Y J. Effects of drought stress on seeding growth characteristics of drought resistance faba bean (L.) and study on differential proteomics of leaves., 2017, 36: 340–351 (in Chinese with English abstract).
[13] 张小静. 马铃薯块茎蛋白质双向电泳技术体系建立及发育相关蛋白质的分析. 甘肃农业大学硕士学位论文, 甘肃兰州, 2008.Zhang X J. Establishment of Two-dimensional Electrophoresis System for Analysis of Proteins during Potato (L.) Tuber Development. MS Thesis of Gansu Agricultural University, Lanzhou, Gansu, China, 2008 (in Chinese with English abstract).
[14] Demirevska K, Zasheva D, Dimitrov R, Simova-Stoilova L, Stamenova M, Feller U. Drought stress effects on rubisco in wheat: changes in the rubisco large subunit., 2009, 31: 1129–1138.
[15] Salekdeh G H, Siopongco J, Wade L J, Ghareyazie B, Benett J. Proteomic analysis of rice leaves during drought stress and recovery., 2002, 2: 1131–1145.
[16] Mohammadi P P, Moieni A, Hiraga S. Organ-specific proleomic analysis of drought-stressed soybean seedling., 2012, 75: 1960–1923.
[17] Mustafa G, Komatsu S. Quantitative proteomics reveals the effect of protein glycosylation in soybean root under flooding stress., 2014, 5: 627.
[18] Ma H Y, Song L R, Huang Z G. Comparative proteomic analysis reveals molecular mechanism of seedling roots of different salt tolerant soybean genotypes in responses to salinity stress., 2014, 4: 40–57.
[19] Celis J E, Gromov P. 2D Protein electrophoresis: can it be perfected?, 1999, 10: 16–21.
[20] Desclos M, Dubousset L, Etienne P, Le Caherec F, Satoh H, Bonnefoy J, Ourry A, Avice J C. A proteomic profiling approach to reveal a novel role ofdrought 22 kD/water- soluble chlorophyll-binding protein in young leaves during nitrogen remobilization induced by stressful conditons., 2008, 147: 1830–1844.
[21] Balestrasse K B, Gardey L, Gallego S M. Response of antioxidant defence systerm in soybean nodules and roots subjected to cadmium stress., 2001, 28: 497–453.
[22] Malgorzata G, Waldemar B. Effects of a short-term hypoxic treatment followed by re-aeration on free radicals level and anti-oxidative enzymes in lupine roots., 2004, 42: 233–240.
[23] Hernandez J A, Jimenez A, Mullineaux P, Sevilla F. Tolerance of pea (L.) to long-term salt stress is associated with induction of antioxidant defences., 2000, 23: 853–862.
[24] 严顺平. 水稻响应盐胁迫和低温胁迫的蛋白质组研究. 中国科学院博士学位论文, 上海, 2006. Yan S P. Proteomic Analysis of Salt Stress Responsive and Chilling Stress Response in Rice. PhD Dissertation of Graduate University of the Chinese Academy of Sciences, Shanghai, China, 2006 (in Chinese with English abstract).
[25] Hajheidari M, Abdollahian-Noghabi M, Askari H, Heidari M, Sadeghian S Y, Ober E S, Salekdeh G H. Proteome analysis of sugar beet leaves under drought stress., 2005, 5: 950–960.
[26] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response., 2004, 9: 244–252.
[27] Sato Y, Yokoya S. Enhanced to tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein, sHSP17.7., 2008, 27: 329–334.
[28] 丁伟. 水稻干旱胁迫蛋白质组相关数据和生物信息分析研究. 华中农业大学硕士学位论文, 湖北武汉, 2009. Ding W. Analysis of Bioinformation and Data Related to Proteome of Rice under Drought Stress. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2009 (in Chinese with English abstract).
[29] 舒烈波. 水稻叶片响应干旱和渗透胁迫的蛋白质组学研究. 华中农业大学博士学位论文, 湖北武汉, 2010. Shu L B. Proteomic Analysis of Rice Leaves in Response to Drought and Osmotic Stress. PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2010 (in Chinese with English abstract).
[30] 李丽芳, 罗晓芳, 王华芳. 植物抗旱基因工程研究进展. 西北林学院学报, 2004, 19: 53–57. Li L F, Luo X F, Wang H F. Advances in the studies of gene engineering on plant drought-resistance., 2004, 19: 53–57 (in Chinese with English abstract).
[31] Weaver L M, Herrmann K M. Dynamics of the shikimate pathway in plants., 1997, 2: 346–351.
[32] Diaz J, Bernal A, Pomar F, Merino F. Induction of shikimate dehydrogenase and peroxidase in pepper (L.) seedlings in response to copper stress and its relation to lignification., 2001, 161: 179–188.
[33] Rospert S, Dubaquie Y, Gautschi M. Nascentpolypeptide- associated complex., 2002, 59: 1632–1639.
[34] Chaves M M, Flexas J, Pinheiro C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell., 2009, 103: 551–560.
[35] Reddy A R, Chaitanya K V, Vivekanandan M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants., 2004, 161: 1189–1202.
[36] Thomashow M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms., 1999, 50: 571–599.
[37] Li X J, Yang M F, Chen H, Qu L Q, Chen F, Shen S H. Abscisic acid pretreatment enhances salt tolerance of rice seedlings: proteomic evidence., 2010, 1804: 929–940.
Proteomic analysis of drought stress response on drought resistance forL. variety ‘Qinghai 13’ in Qinghai Plateau of China
LI Ping1,2, HOU Wan-Wei1,2, and LIU Yu-Jiao1,2,*
1Academy of Agriculture and Forestry Science of Qinghai University, Xining 810016, Qinghai, China;2State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, Qinghai, China
Proteomics is playing an increasingly important role in the functional genomics era. Two-dimensional electrophoresis and mass spectrometry can be used to study the changes of proteome of crop under stress and increase the recognization and comprehension of crop response to drought stress. In order to explore the mechanism of drought resistance ofL. variety ‘Qinghai 13’, we treated the seedlings with three days for water stress and analyzed by two-dimensional gel electrophoresis combined with mass spectrometry analysis. Bytest, 32 differentially expressed proteins spots were detected between normal and drought-stress treatments, respectively, including up- and down-regulated proteins, seven disappear protein spots and a new protein spot. Twenty-one differentially expressed proteins in seven function categories were identified and confirmed by MALDI-TOF/TOF. Among them, two participated in information transfer, one in oxygen radical scavenging, one in protective response, eight in energy metabolism, one in protein processing, five in photosynthesis, and three unknown in function. These results indicate that drought-inducible 22 kD protein, stress-inducible protein, superoxide dismutase and 17.5 kD class HSP are directly related with drought resistance, which may be the important reasons for strong drought resistance of ‘Qinghai 13’.
faba bean; drought stress; proteomic; differential expression; functional classification
): 2018-05-29;
2018-10-08;
2018-11-03.
10.3724/SP.J.1006.2019.84075
刘玉皎, E-mail: 13997058356@163.com
E-mail: lping2008@ sohu.com
本研究由国家自然科学基金项目(31460377)和国家现代农业产业技术体系建设专项(CARS-09)资助。
This study was supported by the National Natural Science Foundation of China (31460377) and the China Agriculture Research System (CARS-09).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20181031.1457.004.html

