东北酸菜发酵液中耐低温乳酸菌的分离及抑菌性研究
徐伟,陈翠婷,马婷婷,柴丽娜
(哈尔滨商业大学 食品工程学院,哈尔滨 150076)
来源于低温环境的微生物,其可在0~5 ℃生长繁殖,最高生长温度在20 ℃ 以上,被称为耐冷微生物[1]。目前对中温型乳酸菌的研究较多,而对低温乳酸菌的研究尚少。其能适应低温环境的主要原因是,在长期的生物进化过程中,形成了细胞膜的生物功能、能量产生及传递系统、蛋白质的生物合成、酶类和营养物质的转运系统等一系列复杂的冷适应机制[2]。乳酸菌可以抑制环境中的其他微生物,主要是通过竞争营养物质、竞争附着点使其他微生物不能定值[3]。乳酸菌产生的抗菌物质包括乳酸、乙酸等酸性物质,过氧化氢、乳酸菌素等可以抑制其他微生物的生长[4]。
目前,罐藏食品会由于某些化学或物理原因引起腐败变质,而引起腐败变质的主要原因是由微生物而导致的腐败变质,其中酵母菌可引起水果、果酱等的败坏,从中分离出的酵母主要有球拟酵母(Torulopsis)、假丝酵母(Candida)和啤酒酵母(S.cerevisiae)等[5]。因此,能够筛选出产生抑菌物质并应用于食品保鲜的耐低温的微生物菌株,为天然抑菌物质的应用开辟更广阔的前景,为生物抑菌剂提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酸菜发酵液:从哈尔滨周边地区采集冬季低温贮藏的酸菜发酵液样品20份。
1.1.2 菌种
大肠杆菌(Escherichiacoli)、黑曲霉(Aspergillusniger)、枯草芽孢杆菌(Bacillussubtilis)、啤酒酵母(S.cereviisae)、植物乳杆菌(Lactobacillusplantarum):均由哈尔滨商业大学微生物发酵实验室提供。
1.1.3 试剂
牛肉膏、酵母浸粉、蛋白胨、琼脂等:均为生物试剂;葡萄糖、磷酸氢二钾、硫酸镁等:均为分析纯;苯乳酸、乙酸、乳酸、丙酸:Sigma公司;MRS培养基、液体分离培养基:按文献[6]进行配制。
1.2 仪器与设备
SW-CJ-1D型单人单面净化工作台 浙江苏州净化设备有限公司;LRH-70F型生化培养箱 上海一恒科技有限公司;LDZX-50XB型立式压力蒸汽灭菌锅 上海中安医疗器械厂;YS2-H型显微镜 Nikon China;BS 224S型电子天平 赛多利斯科学仪器(北京)有限公司;723N型可见分光光度计 上海精密科学仪器有限公司;PHS-3C型pH计 上海仪电科学仪器有限公司;Thermo Scientific Sorvall Legend Micro 21R台式高速低温离心机 Thermo公司[7]。
1.3 实验方法
1.3.1 乳酸菌的分离、纯化
称取适量样品用无菌生理盐水进行10倍稀释,10-1~10-7浓度梯度,分别吸取200 μL稀释液涂布于MRS分离培养基上10 ℃培养24~48 h。挑取菌落颜色由黄到淡黑色的单菌落,进一步分离纯化。所得纯菌株经革兰氏染色和接触酶实验,选取革兰氏阳性菌和接触酶阴性菌,将所得纯菌株标号并保藏。
1.3.2 菌株的鉴定
1.3.2.1 形态学观察
观察菌落形态,革兰氏染色后于显微镜下观察菌体形态[8]。
1.3.2.2 生理生化鉴定
主要采用接触酶实验、淀粉水解实验、V-P实验、葡萄糖产酸产气实验、明胶液化实验、精氨酸产氨实验及糖发酵实验等对菌株进行生理生化鉴定,具体方法参照《伯杰细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》[9]。
1.3.2.3 16S rDNA基因的分子生物学鉴定
吸取10 ℃条件下培养12 h的CCT-1菌株发酵液1 mL,9000 r/min离心2 min,沉淀用于DNA提取,具体的操作方法严格按照试剂盒说明进行。PCR选用细菌16S rRNA通用引物(由生工生物工程(上海)股份有限公司合成):上游引物:5'-AGTTTGATCCTGGCTCAG-3'和下游引物:5'-GGTTACCTTGTTACGACTT-3'。PCR反应体系包括:10×Buffer,2.5 μL,2.5 μmol/L dNTP,1 μL引物各0.5 L,DNA模板1 μL,ddH2O,25 μL。PCR反应程序:预变性,94 ℃,4 min;变性,94 ℃,45 s;退火,55 ℃,45 s;延伸,72 ℃,1 min,共30个循环。PCR纯化产物送样测序:生工生物工程(上海)股份有限公司。
用BLAST将所测定菌株的16S rRNA序列与GenBank数据库中已知细菌的16S rRNA序列进行比对,寻找与目的基因序列同源性最高的已知分类地位的菌种,分析相似性[10]。然后用MEGA 6.0中的Clustal对最近类群的序列进行多重比较分析,并通过该软件的邻近法(neighbor joining)构建系统发育树,分支聚类的稳定性用Bootstrap方法进行1000次随机重复取样评价[11]。
1.3.3 CCT-1和YY菌株的生长曲线
将CCT-1和YY菌株以3%的接种量接入已灭菌的MRS液体培养基中,于10 ℃恒温培养箱中培养108 h;每隔12 h取2菌株的发酵液,在波长600 nm下测定2个样品的吸光度值(OD值)、培养液的pH值,以培养时间为横坐标,吸光度值、pH值为纵坐标,绘制生长曲线和产酸曲线。
1.3.4 CCT-1菌株对4种指示菌的抑菌性研究
采用双层平板法,底层为MRS固体培养基(10 mL/皿),待下层平板凝固,在平板中央平行画2条直线,于10 ℃培养24 h。高温灭菌4种指示菌的半固体培养基(LB、查氏、牛肉膏蛋白胨和YPD),待温度冷却至50 ℃左右时,按2%的接种量加入敏感指示菌(大肠杆菌、枯草芽孢杆菌、黑曲霉、啤酒酵母)菌液,混合均匀后立即倒入上层平板铺平,于指示菌最适生长温度培养24 h,观察现象。
1.3.5 CCT-1菌悬液浓度对指示菌的抑菌效果研究
将CCT-1菌株于10 ℃培养24 h,待菌悬液细胞浓度为106cfu/mL时,将菌悬液稀释1,2,3倍浓度。先将指示菌(大肠杆菌、枯草芽孢杆菌、黑曲霉、啤酒酵母)菌液在相应固体平板上进行涂布,然后采用牛津杯法,按未经稀释、稀释1倍、稀释2倍、稀释3倍的浓度梯度,加CCT-1菌株发酵液2.5 μL,于各指示菌生长的最适温度恒温培养24 h,测定抑菌圈直径[12],测定菌悬液细胞浓度。
2 结果与分析
2.1 耐低温乳酸菌的分离筛选
从哈尔滨周边采集的冬季低温贮藏的酸菜发酵液中,共得到25株革兰氏阳性、过氧化氢阴性的乳酸菌菌株。经过限定培养温度10 ℃,筛选得到7株耐低温的乳酸菌菌株,其中菌株CCT-1的生长状况最好,因此选取菌株CCT-1为实验菌株。
2.2 菌株鉴定
2.2.1 形态学观察结果
将菌株CCT-1在固体MRS培养基上培养48 h后,观察菌株在平板上的单菌落形态呈圆形,隆起,表面光滑,湿润,不透明,边缘整齐,颜色为乳白色(见图1中a)。细菌革兰氏染色呈阳性,杆状(见图1中b)。

图1 CCT-1菌株菌落图和CCT-1革兰氏染色图
2.2.2 菌株生理生化鉴定结果
CCT-1菌株生理生化鉴定结果见表1。

表1 CCT-1菌株生理生化鉴定结果

续 表
注:“+”表示阳性;“-”表示阴性。
由表1可知,革兰氏染色、葡萄糖产酸产气实验呈阳性,精氨酸产氨、接触酶实验、淀粉水解、明胶液化、V-P实验呈阴性。结合菌落特征和生理生化特征,初步鉴定CCT-1为植物乳杆菌。
2.2.3 分子生物学鉴定结果
将PCR产物进行测序,测序结果登录NCBI网站,用BLAST进行序列同源性比对,并利用MEGA 6.06构建系统发育树,结果见图2。发现CCT-1与植物乳杆菌的16S rDNA同源性达99%以上,这与形态及生理生化鉴定结果一致,由此可以进一步将CCT-1菌株归属于植物乳杆菌(L.plantarum)。
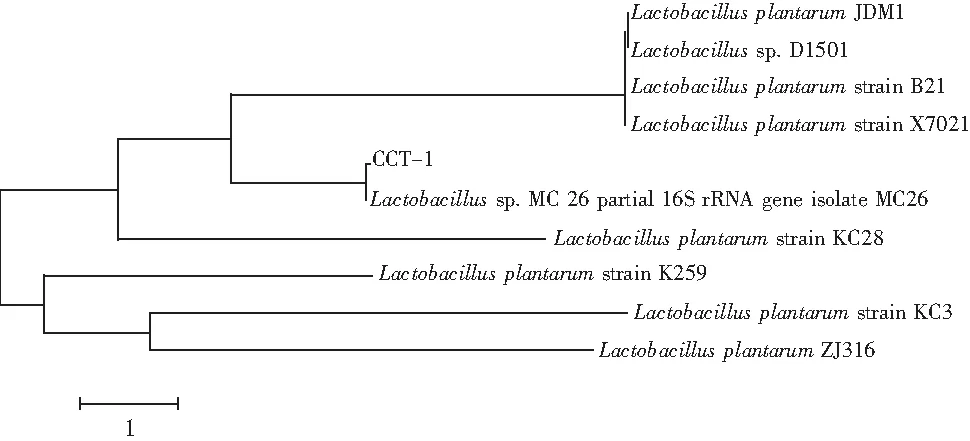
图2 菌株CCT-1的系统发育树关系图
2.3 CCT-1和植物乳杆菌的生长性能
将植物乳杆菌与菌株CCT-1按3%的接种量,分别接种于MRS液体培养基中,于10 ℃恒温培养108 h,每隔12 h,分别测得植物乳杆菌和CCT-1 2菌株在波长600 nm下的吸光度值(OD值)及培养液的pH值,绘制生长曲线及产酸曲线,结果见图3。
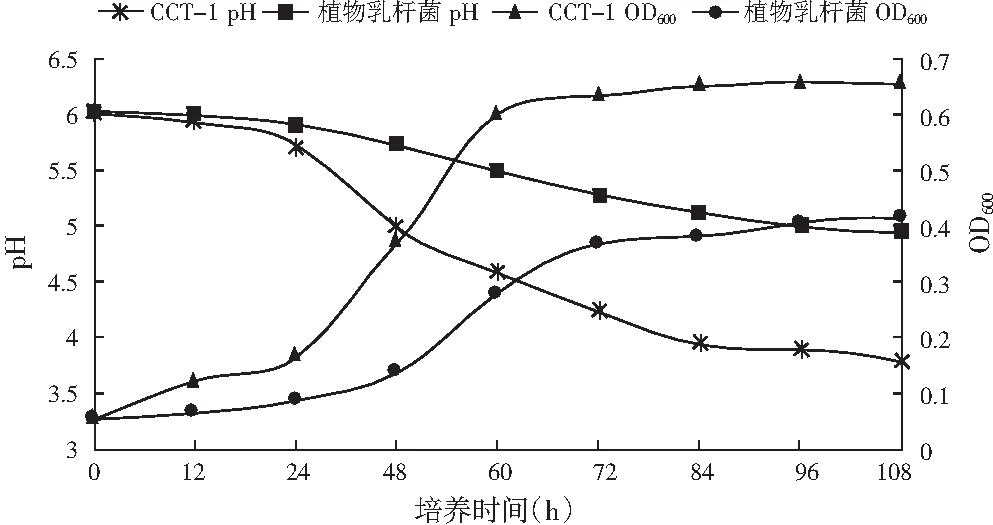
图3 CCT-1和植物乳杆菌在10 ℃培养条件下的生长曲线
由图3可知,菌株CCT-1和植物乳杆菌在10 ℃条件下培养108 h后,CCT-1菌株在24 h后菌体量开始快速增加(P<0.05),同时发酵液的pH值显著降低(P<0.05),菌株在培养60 h后菌体量和发酵液pH值都趋于稳定(P>0.05),OD600为0.632,从整个生长过程可知菌株CCT-1在10 ℃条件下生长良好,产酸能力强,pH降到3.7左右[13];植物乳杆菌在48 h后菌体量开始增加,同时发酵液的pH值降低,菌株在培养72 h后菌体量和pH都趋于稳定,OD600为0.365。出现这种现象的原因是植物乳杆菌难以适应低温的环境,延滞期过长;低温条件下,植物乳杆菌的生长速度缓慢,导致菌体量过低。
2.4 CCT-1菌株对4种指示菌的抑菌性研究结果
乳酸菌在环境中可以抑制其他微生物的生长,主要通过与其他微生物之间竞争营养物质,还可以同有害菌竞争附着点,使其他微生物不能定值而被流失。
分别用MRS与LB、查氏、牛肉膏蛋白胨和YPD半固体培养基的双层平板对峙法,研究CCT-1对4种指示菌(大肠杆菌、枯草芽孢杆菌、黑曲霉、啤酒酵母)的抑菌性,抑菌效果见图4。
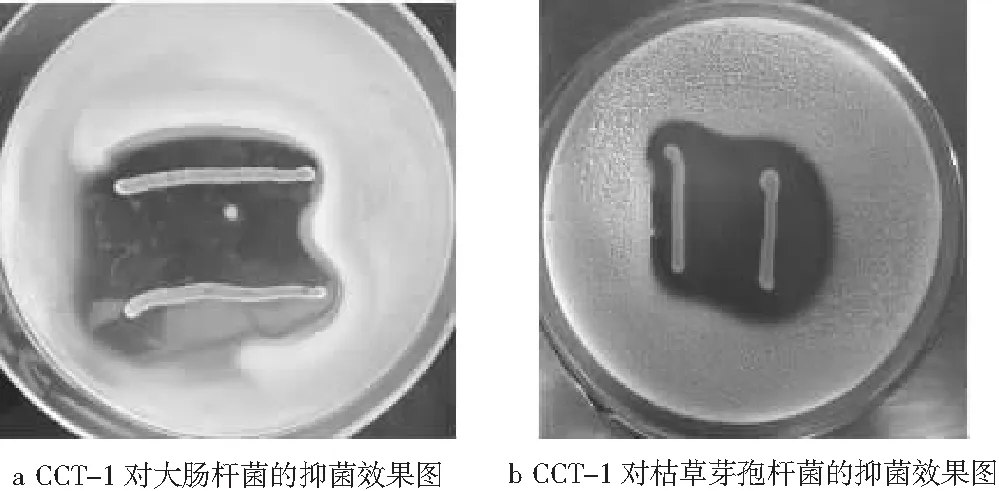
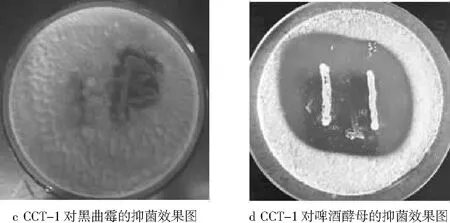
图4 CCT-1对大肠杆菌、枯草芽孢杆菌、黑曲霉、啤酒酵母的抑菌效果图
由图4可知,CCT-1对4种指示菌均有明显的抑制作用,对啤酒酵母、大肠杆菌、枯草芽孢杆菌的抑菌圈明显,抑菌效果最好;对黑曲霉的抑菌圈不明显,抑菌效果弱。产生这种明显抑菌效果的原因可能是,CCT-1菌株与啤酒酵母、大肠杆菌、枯草芽孢杆菌在生长过程中进行营养竞争,消耗了3种指示菌所需的营养物质而促进自身的生长,或者是菌株CCT-1产生的代谢产物有机酸等抑菌物质抑制了3种指示菌的生长繁殖。CCT-1与黑曲霉的生长过程中,营养竞争能力不及黑曲霉,导致抑菌圈效果不明显。
2.5 CCT-1菌株菌悬液稀释液对4种指示菌的抑菌性研究结果
采用牛津杯法,将CCT-1菌株发酵液,加液量为2.5 μL,以稀释1倍、稀释2倍、稀释3倍、未经稀释发酵液做对照,研究CCT-1菌株发酵液稀释液对4种指示菌的抑菌性,测定抑菌圈直径,结果见图5。
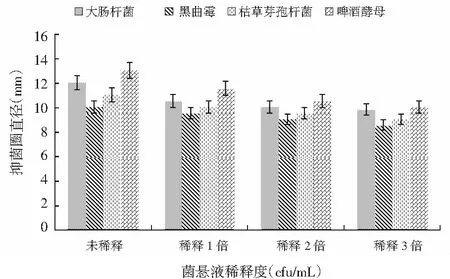
图5 CCT-1菌悬液稀释液对4种指示菌抑菌圈直径变化图
注:牛津杯内径为6 mm,外径为8 mm。
由图5可知,CCT-1菌株发酵液随着稀释倍数的增大,对4种指示菌的抑菌圈直径变小(P<0.05),抑菌性减弱。当菌悬液稀释倍数为3倍时,啤酒酵母的抑菌圈直径与未稀释的抑菌圈直径相比减少了3 mm,此时的抑菌圈直径为10 mm;大肠杆菌的抑菌圈直径与未稀释的抑菌圈直径相比减少了2.2 mm,此时的抑菌圈直径为9.8 mm;枯草芽孢杆菌的抑菌圈直径与未稀释的抑菌圈直径相比减少了1.5 mm,此时的抑菌圈直径为9 mm;黑曲霉的抑菌圈直径与未稀释的抑菌圈直径相比减少了1.5 mm,此时的抑菌圈直径为8.5 mm。此时的菌悬液仍有抑菌活性,细胞浓度3.4×106cfu/mL即CCT-1菌株的最低抑菌浓度。造成这种现象的原因是,随着发酵液稀释倍数的增大,菌悬液细胞浓度或发酵液中产生的抑菌物质减少,所以抑菌效果减弱。
3 结论
本研究从东北冬季贮藏的酸菜发酵液中分离到的耐低温乳酸菌经形态学、生理生化及分子生物学的鉴定,确定其为植物乳杆菌(Lactobacillusplantarum)。利用双层平板法研究CCT-1菌株对4种指示菌的抑菌性,通过效果图可以看出,对酵母菌、大肠杆菌、枯草芽孢杆菌的抑菌效果非常显著,产生抑菌作用的原因是CCT-1与4种指示菌在生长过程中通过竞争营养物质,造成指示菌缺少营养物质从而抑制了指示菌的生长。通过牛津杯法研究CCT-1菌株发酵液未经稀释、稀释1倍、稀释2倍、稀释3倍,测定4种指示菌的抑菌圈直径。结果显示:当CCT-1菌悬液细胞浓度为3.4×106cfu/mL时,酵母菌的抑菌圈直径为10mm,大肠杆菌、枯草芽孢杆菌和黑曲霉的抑菌圈直径分别为9.8,9,8.5mm。随着稀释倍数的增大,对于指示菌的抑菌作用减小,造成这种现象的原因是随着稀释倍数的增大,菌悬液中的菌体量及产生的代谢物都减少,因此抑菌作用减小。

