脑卒中合并昼间嗜睡对卒中后血压变异性的影响
王文熠,万福铭,李 澎
昼间嗜睡(excessive daytime sleepiness,EDS)是一种普遍存在的睡眠障碍,主要表现为白天在安静或单调环境下,不分场合和时机地出现不同程度、不可抗拒的睡眠。研究证实EDS会增加冠状动脉粥样硬化的严重程度,并且是中老年人群脑卒中发病的独立危险因素之一[1-2]。在脑卒中急性期约有72%的患者会出现EDS,并有约34%的患者会遗留EDS超过6个月[3-4]。有学者认为,EDS通过与其他危险因素(如代谢因素、睡眠因素)相结合来提升脑卒中和冠心病的发病风险[5]。高血压作为脑卒中发病的重要独立危险因素,其影响心脑血管疾病发病与预后的相关生理病理机制已得到充分阐释,但探讨EDS与高血压之间关系的研究却鲜见报道。本研究旨在通过对脑卒中后合并EDS患者的动态血压及昼夜血压节律的变化进行观察,以期进一步探讨脑卒中后EDS与动态血压之间的关系。
1 对象与方法
1.1 研究对象 选取2014年9月—2016年8月在天津中医药大学第一附属医院特需针灸病房及门诊就诊的脑卒中患者为研究对象。脑卒中诊断标准按照中华医学会神经病学分会制订的《中国急性缺血性脑卒中诊治指南2010》[6]及原卫生部2010年发布的《成人自发性脑出血诊断标准》[7]。EDS诊断标准参照:(1)昼间睡眠过多,持续7 d以上。(2)不存在下述情况:睡眠时间不足;从唤醒到完全清醒的时间延长,或睡眠呼吸暂停;发作性睡病的附加症状(如猝倒症、睡眠瘫痪、入睡前幻觉、醒前幻觉等);以睡眠障碍为症状之一的其他精神障碍。(3)Epworth嗜睡量表(ESS)评分≥10分[8]。
1.2 研究方法
1.2.1 分组 根据是否合并EDS将所有患者分为EDS组和非EDS组。EDS组纳入标准:(1)符合脑卒中诊断;(2)符合EDS诊断;(3)脑卒中发病前无睡眠障碍,无智能、语言理解和表达障碍,能基本独立完成各种量表的测评;(4)匹兹堡睡眠质量指数量表(PSQI)[9]评定总分≥7分。非EDS组:符合上述(1)、(3)标准。排除标准:(1)过敏体质者;(2)伴有严重肺部感染,心、肝、肾功能衰竭,肿瘤,造血系统或内分泌系统等严重原发性疾病者;(3)严重意识障碍或精神疾病患者;(4)已应用其他抗抑郁药、安眠药治疗者。
1.2.2 资料收集 (1)基本资料的收集:通过病历查阅法收集患者一般资料,包括年龄、性别、卒中病程、卒中类型、合并高血压情况、高血压病程、近3个月服用降压药情况等。(2)实验室检查:入院后于患者空腹12 h时行血液生化检查,采用日立7600全自动生化分析仪测定血清总胆固醇〔TC,总胆固醇测定试剂(CHOD-PAP)法〕、三酰甘油〔TG,胆固醇氧化酶(HMMPS)法〕、低密度脂蛋白胆固醇(LDL-C,过氧化氢酶清除法)、高密度脂蛋白胆固醇(HDL-C,直接测定法)。(3)动态血压监测:所有患者于入组后进行24 h动态血压监测。于8:00~10:00在患者非优势手臂佩戴德国生产的MOBIL-O-GRAPH型全自动无创性便携式动态血压监测仪,仪器时间统一设定。昼间(7:01~22:00)每小时自动测量血压3次;夜间(22:01~次日7:00)每小时自动测量1次,同时嘱受试者陪护记录血压监测日志,监测期间患者可从事正常日常活动。如有效监测数超过70%,且每小时至少有一次有效监测,则认为监测结果有效。评价指标包括:昼间收缩压均值、昼间舒张压均值、夜间收缩压均值、夜间舒张压均值、24 h收缩压均值、24 h舒张压均值、脉压下降率,血压昼夜节律〔(昼间血压均值-夜间血压均值)/昼间血压均值×100%,当此值≥10%且<20%时,为正常昼夜节律的杓形血压,否则为非正常昼夜节律的非杓形血压〕。
1.3 统计学方法 采用SPSS 18.0统计软件进行统计分析。呈正态分布的计量资料以s)表示,两组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)〔M(QR)〕表示,采用Mann-Whitney U检验;计数资料以相对数表示,采用χ2检验;相关分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较 共纳入符合纳入标准的患者244例,其中EDS组120例,非EDS组124例。其中男156例,女88例;年龄33~92岁;卒中病程1~72 d;缺血性脑卒中209例,出血性脑卒中35例;合并高血压者218例;高血压病程5个月~50年;近3个月服用降压药者156例。EDS组和非EDS组年龄、卒中病程比较,差异有统计学意义(P<0.05);两组患者性别、卒中类型、合并高血压比例、高血压病程、近3个月服用降压药比例比较,差异无统计学意义(P>0.05,见表1)。
2.2 两组患者血脂水平比较 两组患者血清TG水平比较,差异有统计学意义(P<0.05);两组患者TC、LDL-C、HDL-C比较,差异无统计学意义(P>0.05,见表2)。
2.3 两组患者动态血压特点比较 两组患者夜间收缩压均值、夜间舒张压均值、收缩压节律、舒张压节律比较,差异有统计学意义(P<0.05);两组患者昼间收缩压均值、昼间舒张压均值、24 h收缩压均值、24 h舒张压均值、脉压下降率比较,差异无统计学意义(P>0.05,见表3)。
表2 两组患者血脂水平比较s,mmol/L)Table2 Comparison of blood lipid levels between the two groups

表2 两组患者血脂水平比较s,mmol/L)Table2 Comparison of blood lipid levels between the two groups
注:TC=总胆固醇,TG=三酰甘油,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇
?
表3 两组患者动态血压监测结果比较Table3 Comparison of ambulatory blood pressure monitoring results between the two groups

表3 两组患者动态血压监测结果比较Table3 Comparison of ambulatory blood pressure monitoring results between the two groups
注:1 mm Hg=0.133 kPa
?
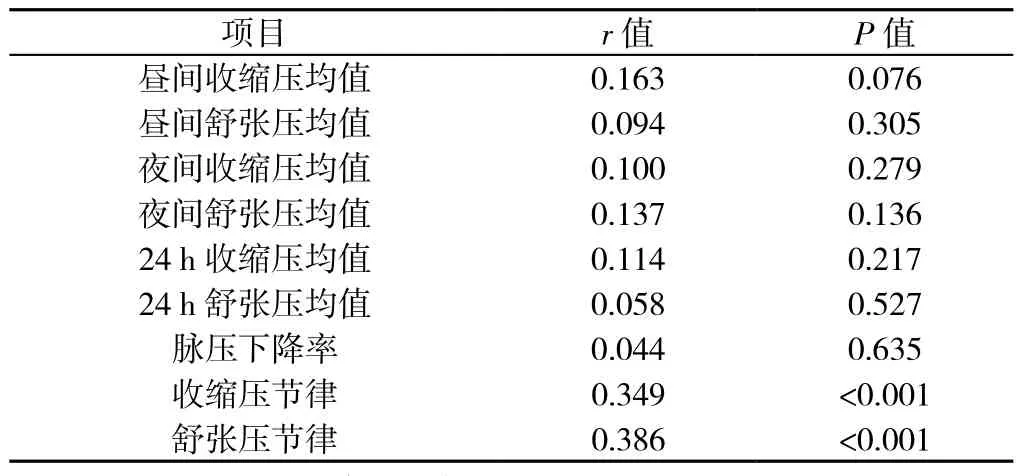
表4 EDS组患者ESS评分与动态血压监测指标的相关性分析Table4 Correlation analysis of the ESS score with ambulatory blood pressure monitoring parameters in stroke patients with excessive daytime sleepiness
2.4 EDS组患者ESS评分与动态血压监测指标的相关性分析 EDS组120例患者ESS评分平均为(14.73±3.32)分,Pearson相关分析结果显示,ESS评分与收缩压节律、舒张压节律呈线性正相关(P<0.05);ESS评分与昼间收缩压均值、昼间舒张压均值、夜间收缩压均值、夜间舒张压均值、24 h收缩压均值、24 h舒张压均值、脉压下降率无相关性(P>0.05,见表4)。
3 讨论
近年来的研究已经证明了睡眠障碍与脑血管疾病之间的联系,对这两者之间相互作用的研究已经成为血管神经病学的一个重要研究方向。以往的研究已经证实睡眠呼吸障碍(sleep disordered breathing,SDB),特别是睡眠呼吸暂停,在脑血管病急性期最为常见,并对患者的神经功能恢复产生不良影响[10]。除了SDB、EDS是卒中患者,特别是大脑半球、丘脑、中脑梗死患者中最常见的睡眠障碍类型,脑卒中也会直接或间接地导致其他类型的睡眠障碍[11]。无论是SDB还是EDS,在中老年人群中的发病风险都高于年轻人群,既往研究显示以上二者都是脑卒中发病的独立危险因素[12-13],故合并睡眠障碍的脑卒中患者年龄普遍偏高。本研究结果显示,脑卒中合并EDS的患者年龄明显高于单纯脑卒中患者,也证实了以上观点。
近年来肥胖、体质指数(BMI)明显升高等脂代谢异常作为阻塞性呼吸睡眠暂停(OSA)的临床危险因素已经形成共识,而对EDS与人体脂肪代谢之间的关系的研究亦可见报道。内脂素(visfatin)是一种由人体脂肪组织分泌的蛋白质细胞因子,具有类胰岛素样作用,可作用于胰岛素受体调整胰岛素敏感性,加强脂肪细胞对葡萄糖的摄取并抑制肝糖输出,从而促进脂肪蓄积[14]。其表达水平在肥胖、糖尿病等代谢性疾病和心血管疾病的患者中均有不同程度的增加。耿秀娟等[15]应用酶联免疫法检测OSA合并高血压患者的血清内脂素水平,应用ESS评估其嗜睡程度,并与单纯OSA患者和正常对照组比较,结果显示OSA合并高血压组患者的嗜睡程度与血清内脂素水平明显高于另外两组患者,且血清内脂素水平与ESS评分呈线性正相关。这一方面证实了EDS与高血压之间的关系是独立于OSA之外的,另一方面也说明EDS的严重程度会对人体的脂代谢产生影响。本研究结果显示,脑卒中合并EDS患者明显高于单纯脑卒中患者的血清TG水平,说明脑卒中合并EDS可导致患者脂肪代谢异常加重,进而可能对脑卒中的康复和远期预后造成影响。
相关研究已经证实,无论是缺血性脑卒中还是出血性脑卒中,高血压都是导致其发病、复发及不良预后的重要独立危险因素[16-17]。而近年来,有关EDS与高血压之间的相互关系和作用机制的研究也在增加。WILLIAMS等[18]的研究发现合并EDS的OSA患者较未合并者有更高的高血压发病率。被纳入观察的1 058例高血压患者中27%存在EDS,
这些高血压合并EDS的人群中,仅有44%对降压药物有较好的依从性。多元线性回归分析结果显示,在调整年龄、BMI、性别、受教育程度、吸烟及饮酒史等自变量后,合并EDS者对降压药物依从强度仅为不合并者的1/2左右,EDS患者的血压异常可能也与此有关。睡眠剥夺试验已经报道了以上因素对正常血压节律的干扰,无论是否存在睡眠呼吸暂停,夜间/昼间血压比的上升都会导致睡眠破碎和浅睡眠[19]。这说明,相比SDB,EDS与高血压的关系更加密切。但本研究结果显示,脑卒中合并EDS患者的高血压病史及发病前的降压药物依从性与单纯脑卒中患者相比无明显差异,说明血压的异常可能不会增加EDS的发病风险,EDS与血压异常之间的作用有可能并非是双向的。
目前临床上对EDS的评价方法主要分为主观评价和客观评价两大类。ESS是由JOHNS于1990年设计,1991年用于临床的主观性评价量表。该量表使用简便,信度及效度较高,是目前临床上应用最为广泛的对EDS症状进行评估的工具[20]。而目前常用的评价EDS的客观方法则以多次睡眠潜伏期试验(multiple sleep latency test,MSLT)为代表。因为主观评估方法只能对患者自身能够察觉到的嗜睡倾向进行评价,而且很容易受到其他因素的影响(如评价者偏倚、情绪因素、患者因脑损伤认知障碍导致的配合度降低等)[21]。脑电图能够更加精确地评估患者嗜睡程度,因此对生理病理觉醒参数的客观测量方法,在评价嗜睡程度上是更加精确的。但由于MSLT对设备及技术的要求较高,且操作过程繁琐,受试者依从性较差,以ESS为代表的主观评价方法仍有其不可替代性,本研究也基于以上因素的考虑,选择了ESS作为评价患者EDS症状严重程度的主要指标。
与诊室血压相比,动态血压能够更真实地反映患者的血压控制程度并更好地预测心脑血管疾病的风险。已有研究证实了24 h动态血压监测在评估高血压患者的脑卒中风险上的预测性价值[22],还有一些研究评估了血压节律非杓形模式与脑血管事件风险的关系。昼夜血压的杓形变化最早是由O'BRIEN等[23]在1988年报道的。约有25%的高血压患者血压呈非杓形,并且与心脑血管疾病的发病率呈正相关。无论是有症状的还是无症状的缺血性脑病,在血压非杓形患者中的发生率都更高[22]。对于脑卒中后血压节律的变化特点也有研究进行了观察和总结:即正常的夜间血压下降,昼夜血压节律的杓形模式会被改变。脑卒中患者的血压杓形节律的发生率低于正常人群,且这种血压节律的变化与患者2年内的死亡率有关联[24]。但与昼间发作的卒中相比,夜间发作的卒中更易导致非杓形血压[25]。以上研究均说明,夜间血压升高及血压的非杓形模式是独立于24 h平均血压以外的心脑血管疾病的重要危险因素。因此,只关注昼间血压的降低而忽视夜间血压水平,会增加脑卒中和心血管疾病的发病和复发风险,是应当被纠正的。
本研究结果显示,脑卒中合并EDS患者的夜间收缩压均值、夜间舒张压均值、收缩压节律和舒张压节律的非杓形程度明显高于单纯脑卒中患者,且脑卒中合并EDS患者的ESS评分与其收缩压节律和舒张压节律的非杓形程度呈线性正相关。这说明脑卒中后合并EDS会降低卒中患者夜间血压的下降幅度,甚至使夜间血压不降反升,导致昼夜血压节律呈非杓形和反杓形模式,进而导致不良预后及脑卒中复发的风险上升。另一项应用动态血压监测、针对难治性高血压人群的研究显示,难治性高血压合并OSA患者的ESS评分与24 h舒张压均值呈线性相关,并独立于其他OSA的要素(通气指数和血氧饱和度)存在[26]。本研究结果与之比较有所不同,说明在有脑卒中作为原发病的基础上,EDS患者的动态血压变化有着新特点,在对脑卒中合并EDS患者的血压管理上,应据此做出相应的调整。
本研究的局限性为:由于本研究纳入病例皆为脑卒中患者,多数人存在偏瘫、肌力下降、生活不能自理,并有部分患者处于脑卒中急性期,需长期卧床,无法测量体质量、身高、颈围并计算BMI,故本研究未对两组患者上述指标进行比较;且两组患者年龄、卒中病程存在明显差异,卒中急性期的血压波动也可能对患者的动态血压造成一定影响,期待今后进一步开展更加严格临床试验。
作者贡献:王文熠负责文章的构思与设计,数据整理及统计学处理,结果的分析与解释,撰写论文及论文修订,负责文章的质量控制、审校与监督管理,对文章整体负责;李澎负责可行性分析,参与撰写论文及论文修订;万福铭参与研究的实施与数据收集。
本文无利益冲突。

