急性小肠坏死术后死亡风险因素分析
吕勇志 李云龙 余彦平 张 舜 郭 源 张 龙 王士祺 吴 颖 李纪鹏
1 西安医学院,陕西省西安市 710068; 2 空军军医大学第一附属医院
急性小肠坏死根据肠系膜血管有无梗阻往往将小肠坏死的病因分为闭塞性及非闭塞性,其前者又可细分为肠系膜动脉梗阻(动脉血栓及栓塞)、肠系膜静脉血栓形成及绞窄性梗阻(内疝、扭转、套叠及嵌压等);后者主要包括非闭塞性肠系膜缺血(NOMI)。急性小肠坏死是临床上常见的危急重症疾病,其病情发展迅速,短时间内可进展为多器官功能障碍(MODS),严重者可危及患者生命,综合文献报道其死亡率为38.7%~100%[1-2]。非阻塞性肠系膜缺血(non-occlusive mesenteric ischemia,NOMI),指病理和动脉造影无血管闭塞,多系因心脏低排血量或血容量过低或肠系膜血管痉挛者[3]。本研究旨在探讨急性小肠坏死术后死亡的高危风险因素。
1 资料和方法
1.1 一般资料 回顾性分析西京医院消化外科2008年6月—2017年10月术前或者术中确诊为急性小肠坏死,并接受手术治疗的298例患者的临床资料,排除无法手术和肿瘤患者。298例患者均行急诊手术,术中均证实有不同程度的小肠坏死。其中男189例(63.4%),女109例(36.6%);年龄15~88岁,平均年龄52.6岁;发病时间1~144h,平均发病时间11.2h。急性小肠坏死病因分类:肠系膜动脉闭塞42例(14.1%),肠系膜静脉血栓形成65例(21.8%),绞窄性肠梗阻所致小肠坏死183例(61.4%),非闭塞性肠系膜缺血所致小肠坏死12例(4.0%);其中有2例患者既有肠系膜动脉闭塞,又有绞窄性小肠坏死。急诊手术行一期肠切除肠吻合141例(47.3%),肠造瘘术157例(52.7%)。
1.2 方法 纳入研究的资料全部采用统一的赋值(无=0,有=1),本研究基于研究对象各项观察因素数值的中位数来界定cutoff值水平。所有资料输入到SPSS19.0统计软件,对输入的数据进行χ2检验,取P<0.05为差异有统计学意义。取有统计学意义的变量行多因素Logistic回归分析(变量引入水准设置为0.05),计算各变量的相对危险度OR=Exp(B)和95%可信区间(Confidence Interval,CI),评价急性小肠坏死术后死亡的风险因素。
2 结果
2.1 急性小肠坏死单因素分析 35例(11.7%)患者死亡,死因为多器官功能衰竭(MODS)21例(7.0%)、感染性休克14例(4.7%)。患者年龄>53岁病死率显著高于年龄≤53岁者(P=0.001)。患者术前休克指数>0.8病死率显著高于休克指数≤0.8者(P=0.011)。影像学检查发现有腹内及肠积气的病死率显著高于无积气的患者(P=0.010)。发病时腹腔有血性或脓性腹水的病死率显著高于腹水正常的患者(P=0.036)。术前合并电解质紊乱(P=0.015)、冠心病(P=0.001)、心房纤颤(P=0.045)的患者病死率显著高于无此合并症的患者。患者白蛋白≤34.9g/L病死率显著高于白蛋白>34.9g/L(P=0.026)。患者肌酐>95μmol/L病死率显著高于肌酐≤95μmol/L(P=0.004)。D-二聚体>851.5mg/L病死率显著高于D-二聚体≤851.5mg/L的患者(P=0.046)。术中发现有小肠穿孔的患者病死率显著高于无小肠穿孔的患者(P=0.005)。性别、症状(恶心呕吐、黑便或血便)、体征(腹膜炎)、实验室检查(白细胞计数、血红蛋白)、影线学检查(血栓)、术前合并症(SIRS、糖尿病、脑梗、肺部感染、腹腔感染)、术中发现(手术持续时间、坏死肠管长度、术中出血)及手术方式之间差异与患者生存率无显著相关性(P>0.05)。见表1。

表1 急性腹膜炎伴小肠坏死死亡风险因素分析〔n(%)〕
注:带#号表示P<0.05,1mmHg=0.133kPa。
2.2 急性小肠坏死多因素Logistic回归分析 取单因素分析结果中有统计学意义(P<0.05)的12种因素:年龄、休克指数、平均动脉压、白蛋白、肌酐、D-二聚体、腹内及肠积气、电解质紊乱、冠心病、心房纤颤、腹水性质异常、肠穿孔行多因素Logistic回归分析,结果显示患者年龄>53岁、休克指数>0.8、合并冠心病、有腹内及肠积气、肠穿孔为小肠坏死术后死亡的早期独立预测因素。见表2。
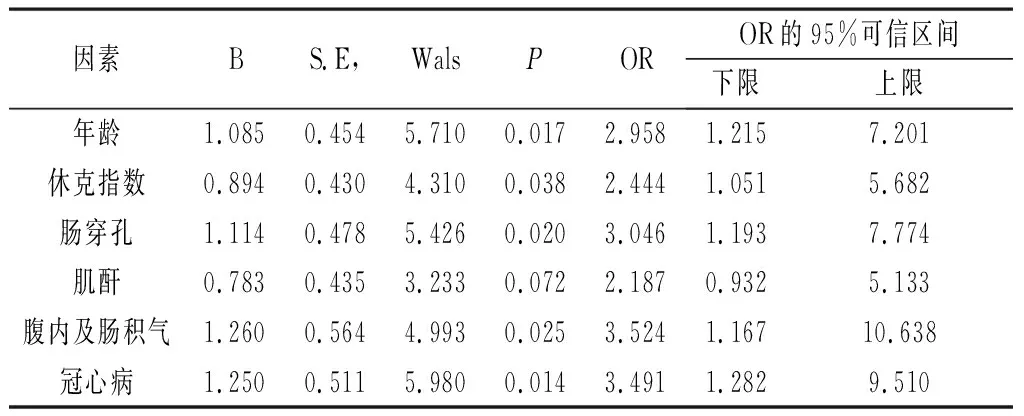
表2 急性腹膜炎伴小肠坏死死亡多因素Logistic回归分析
3 讨论
急性小肠坏死病情凶险,进展迅速,可以在短时间内发展为MODS导致患者死亡[1];而且急性小肠坏死近年来发病率呈上升趋势[4],本研究298例小肠坏死中死亡率为11.7%。目前小肠坏死的病因主要包括肠系膜动脉血栓及栓塞、肠系膜静脉血栓形成、绞窄性梗阻(腹内疝、扭转、套叠及嵌压等)、非闭塞性肠系膜缺血[2,5]。本研究中绞窄性梗阻所致小肠坏死所占比例较大为61.1%,因此临床上一旦发现有绞窄性肠梗阻的需要立刻处理,避免发展为小肠坏死,这与高发病率和死亡率有关[6]。
本研究多因素Logistic回归分析中,年龄>53岁的患者,其死亡的风险会增加2倍以上(P=0.017),是其死亡的独立危险因素。既往研究显示术前有糖尿病、使用地高辛和抗血小板药物、症状持续存在直到术前、休克、低pH和碳酸氢盐、非计划再次手术是急性肠系膜缺血围手术期死亡的风险因素[7],何倩等研究发现休克指数比单纯的心率或血压更能反映急诊危重患者病情的危重程度,有利于检出潜在重症患者[8]。而本研究发现术前休克是急性小肠坏死死亡的独立危险因素,尤其是当休克指数>0.8时,应该十分警惕术后死亡的发生。吕亚萍等对16例小肠坏死的CT平扫图像研究发现急性小肠坏死在CT上多表现为肠腔不同程度的扩张,积液、积气[4]。Koami H等对33例CT发现门静脉积气患者研究发现,存在肠壁积气是小肠坏死的独立危险因素[9]。李畅等研究白细胞>20×109/L,并且超声/CT提示肠壁增厚及腹腔积液,提示已经发生肠坏死[10]。而有研究显示肠缺血的特征性表现是门静脉积气(Hepatic portal venous gas,HPVG)合并肠壁积气(Pneumatosis intestinalis,PI)[11]。基于本研究结果,患者术前X线片或者CT发现有腹腔内、肠壁以及肠壁间积气是其死亡的风险因素,因此对于X线或者CT有类似发现积气的应立即处理。本研究发现93%的患者术前存在各种合并症,如糖尿病、冠心病、心房纤颤、脑梗、肺部感染、腹腔感染等。Ichiba T等研究显示对于急性肠系膜缺血患者其合并冠心病是肠坏死的重要预测指标[12]。Bergan JJ最早提出用于诊断肠系膜上动脉闭塞的Bergan三联征:突发剧烈腹痛、胃肠道异常排空、合并房颤的心脏病[13]。因此对于小肠坏死患者,基础疾病如冠心病可能是小肠坏死的重要危险因素,同样也是死亡的独立危险因素。对于急性小肠坏死患者来说,尽早手术明确小肠情况是非常重要的[14-16]。本研究显示,术中发现有小肠穿孔的患者,术后死亡率为27%,且多因素Logistic回归分析其为小肠坏死死亡的独立危险因素。
综上所述,对于急性小肠坏死的患者,发现年龄>53岁、休克指数>0.8、合并冠心病并且影像学检查发现腹内及肠管积气,而剖腹探查或者腹腔镜探查术中发现有小肠穿孔的应高度警惕死亡的风险。

