小鼠肾小球分离方法比较及原代足细胞鉴定
方 际,吴鹤瑾,王 浩
足细胞在蛋白尿的发生发展中起重要作用[1],但因其为高度分化的终末期细胞,其体外培养一直较为困难。国外已有实验室成功建立人、鼠条件永生化足细胞株[2,3],但细胞株在生长、遗传特征及细胞结构等方面与原代细胞相差较大,不能很好地模拟相关的肾脏病理生理学状况,这使基于永生化足细胞株的实验结果的可信度大大降低。以前的文献主要集中在大鼠的原代足细胞培养,有关小鼠足细胞原代培养技术少见报道。本研究通过比较差异过筛法和免疫磁珠法,旨在明确小鼠肾脏足细胞原代培养的最佳模式。
1 材料与方法
1.1 实验材料 C57/BL6J小鼠,30 g,由上海斯莱克实验动物有限公司提供。激光共聚焦显微镜购自Leica SP8公司,相差显微镜购自OLYMPUS公司,免疫磁珠购自Dynal公司,PCR 仪购自ABI公司。RPMI 1640培养液购自Cornning公司,Ⅳ型胶原酶、链酶蛋白酶E、脱氧核糖核酸酶Ⅰ均购自Sigma公司,胎牛血清购自Gibco公司,Podocin抗体购自Abcam公司,荧光二抗购自Cell Signaling Technology公司,逆转录试剂盒及Trizol购自Invitrogen公司,曲拉通 X-100及80、150、300目不锈钢筛网购自上海生工技术有限公司。
1.2 C57/BL6J小鼠肾小球分离
1.2.1 差异过筛法 小鼠腹腔注射2.5% 戊巴比妥(0.1 ml/30 g),麻醉后,用75% 乙醇消毒皮肤,先后暴露腹腔、胸腔,行心脏灌注后迅速取出双侧肾脏,置于4 ℃ D-Hank’s 溶液中。去除包膜,分离肾皮质,用眼科剪将皮质剪成碎泥状。用注射器针芯轻轻研磨肾皮质,并不断用D-Hank’s 溶液冲洗。该冲洗液先过80 目不锈钢筛网,滤过的溶液再过150 目的不锈钢筛网,最后过300 目筛网。滞留在300 目筛网上即为肾小球初分离物,反复冲洗筛网后,收集分离物制成悬液,静置10 min 后,1000 r/min离心5 min,弃除上清,收集纯化的肾小球沉淀,加入含10%胎牛血清的RPMI 1640培养液制成肾小球悬液。
1.2.2 免疫磁珠法 常规动物麻醉、消毒皮肤,采用Liu等[4]方法从胸主动脉灌注,在肾脏建立局部循环。从胸主动脉先用37 ℃预热的PBS灌注10 ml(5 ml/min),然后灌注37 ℃预热的总体积4 ml,包含有(胶原酶10 mg/ml+链酶蛋白酶E 10 mg/ml+脱氧核糖核酸Ⅰ 100 U/μl+免疫磁珠 200 μl)液体,灌注结束后迅速取出动物双侧肾脏,置于4 ℃ D-Hank’s 溶液中。去除包膜,分离肾皮质,用眼科剪将皮质剪成碎泥状。移入2 ml离心管,再加入上述消化酶1 ml,震荡孵育37 ℃,300 r/min,5 min。用移液枪轻柔吹打数次,过150目金属筛1次,借助磁力架洗涤、重悬,转入离心管中1000 r/min 离心5 min,弃上清,加入含10%胎牛血清的RPMI 1640培养液制成肾小球悬液。
1.3 肾小球形态学观察和计数 用10%胎牛血清的RPMI 1640培养液悬浮肾小球,倒置相差显微镜下观察其形态。经血球计数板计数不同分离方法得到的每只C57/BL6J小鼠的肾小球数目,同时计算无鲍曼囊肾小球占总肾小球的百分比,即为肾小球纯度。以2×104/孔的密度接种于六孔板中,置于37 ℃、5% CO2培养箱内继续培养。
1.4 免疫荧光鉴定 传代培养7 d,待细胞分化铺满瓶底后再行免疫荧光染色。步骤:足细胞以适当密度种植于24孔板上,37 ℃培养至细胞密度为60%~75%。4%多聚甲醛固定15 min,0.5%曲拉通 X-100穿孔15 min,1%牛血清白蛋白封闭30 min,分别加一抗Podocin(1∶1000)4 ℃过夜,然后加1∶500稀释的二抗室温反应1 h,然后加DAPI(1∶1000)3 min,上述每步操作后均用PBS漂洗。荧光显微镜下观察。
1.5 PCR法鉴定足细胞的标志蛋白 以永生化小鼠足细胞为阳性对照,小鼠肝细胞系为阴性对照。用Trizol 试剂提取足细胞总RNA,按照反转录试剂盒的操作步骤反转录合成cDNA,将产物进行PCR检测,反应体系参照试剂盒说明书,反应条件:95 ℃ 3 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环,每样品做3个复管。
引物和内参序列如下:Podocin-F,5′-CACTCTTCAGTCGCTGTCCA-3′;Podocin-R, 5′-AGTTGATGCTCCCTTGTGCT-3′。GAPDH-F 5′-TGGCCTTCCGTGTTCCTAC-3′;GAPDH-R, 5′-GAGTTGCTGTTGAAGTCGCA-3′。
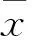
2 结 果
2.1 肾小球的分离结果 差异过筛法获得肾小球纯度达(90.2±1.6)%,1只C57/BL6J小鼠可以得到(10 421±2421)个肾小球;视野中肾小球结构完整,可见肾小管碎片。免疫磁珠法获得的肾小球纯度达(96.7±1.2)%,1只C57/BL6J小鼠可以得到(16 112±2651)个肾小球;视野中肾小球结构完整,基本无肾小管。免疫磁珠法获得肾小球纯度和数目均高于差异过筛法,差异均有统计学意义(P<0.05)。
2.2 肾小球的培养及足细胞形态学特征 肾小球接种第3天可见80%以上肾小球贴壁,少量肾小球周围有多边形细胞爬出(图1A),第7~10天所有贴壁肾小球周围都有大量细胞爬出(图1B)。消化传代后的足细胞继续生长,为多边形,无突起伸出,细胞迅速生长至融合状态,呈铺路石样外观(图1C)。第14天可呈完全分化状态,细胞体和细胞核较增殖状态显著增大,自细胞体伸出明显的树枝样突起,常见双核,相邻细胞间形成连接(图1D)。
图1 肾小球培养的原代足细胞
A.培养第3天(×200);B.培养第7天(×200);C.培养第14天(×100);D.培养第14天(×400)
2.3 肾小球足细胞鉴定
2.3.1 免疫荧光染色鉴定 原代培养的足细胞均有Podocin蛋白染色,荧光闪亮,呈明显的亮绿色,在细胞浆内以丝状或线性沿细胞骨架分布,分布均匀,荧光染色细胞比例均为100%,证实了培养的细胞确为足细胞(图2)。

图2 原代足细胞Podocin蛋白免疫荧光染色(×200)
A.原代足细胞核DAPI染色;B.原代足细胞浆Podocin染色;C.原代足细胞merge图片
2.3.2 PCR法鉴定 原代足细胞和永生化小鼠足细胞均有Podocin基因表达,而阴性对照组未检测到该基因表达(图3)。
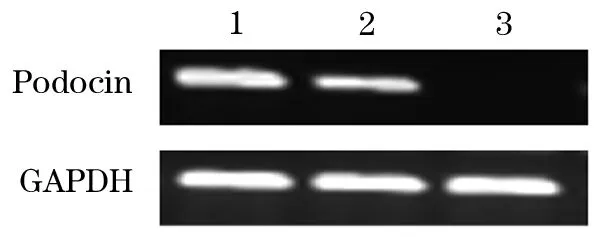
图3 PCR法检测小鼠肾脏足细胞中Podocin表达电泳图
1.原代培养小鼠足细胞;2.永生化小鼠足细胞系;3.肝细胞系
3 讨 论
近年来,慢性肾脏病已经成为全球性的公共卫生问题,而终末期肾脏病的发病率逐年增高[5]。在导致肾脏损害的病因中,足细胞作为肾小球滤过屏障的最后一道闸门,其损伤会导致蛋白尿的发生[6],进而加重肾脏损害[7]。差异过筛法是最传统的分离肾小球的方法,Krakower等[8]最先报道了分离肾小球的方法,后来在大鼠[9]和兔[10]上也成功地分离了肾小球,在此基础上,Burlington等[11]改进了该方法,减少了金属筛对肾小球的损伤。但总体而言,差异过筛法的缺点是分离得到的肾小球纯度较低,往往混有肾小管碎片。
为了提高肾小球的纯度和数量,Takemoto等[12]首次采用免疫磁珠法分离小鼠肾小球,该方法缺点是费用昂贵。在此基础上,Zhao等[13]改进了实验方法,利用四氯化三铁代替免疫磁珠行体循环灌注,极大降低了实验成本,但是获得的肾小球有限。有别于常规的心脏灌注,Liu等[4]采用胸主动脉灌注,在肾脏建立局部循环,较心脏灌注的方法明显提高了免疫磁珠的使用效率。
本研究借鉴并比较了不同的肾小球分离技术,总结了做好小鼠原代足细胞的培养的一些经验:(1)分离肾小球建议使用免疫磁珠法,采用胸主动脉灌注,提高免疫磁珠的使用效率;(2)在消化肾脏皮质的时候,建议使用胶原酶,因为胶原酶比较温和,好掌握消化时间;(3)尽可能地提高肾小球的贴壁率,包括选择合适的筛网,动作轻柔,全程低温操作,在最短的时间内完成肾小球分离,使用胶原铺板的培养皿来种植肾小球,为减少对贴壁的干扰在前3 d避免换液;(4)利用内皮细胞和系膜细胞从肾小球内爬出时间和生长特性不同[14],在培养10~12 d开始传代。本研究结果提示,免疫磁珠法较差异过筛法能更高效地分离出高纯度的小鼠肾小球。

