酸解氧化魔芋葡甘聚糖对齐口裂腹鱼肠道微生物的影响
杨 敏, 陈明睿, 邬应龙*, 严秋萍, 曾丽萍
(四川农业大学 食品学院,四川 雅安 625014)
肠道微生物的结构在动物生长发育过程中有非常重要的作用,其平衡状态与宿主的健康息息相关。正常的肠道菌群可以帮助宿主更好地消化吸收营养物质,同时还能调节宿主的免疫功能,维持机体健康[1]。某些益生菌如乳酸杆菌、双歧杆菌等,能参与糖类和蛋白质的代谢并合成宿主生长发育所必需的营养素,还能促进铁、镁、锌等矿质元素的吸收。这些营养物质的缺少或者肠道菌群结构失衡,就会引起机体多种疾病爆发[2]。肠道是病原微生物入侵鱼类机体的主要部位之一,也是保障鱼类健康的一道重要屏障[3]。
近年来,水产养殖中抗生素滥用所引出的问题,如抗药性、药物残留和环境污染等,引起广泛关注,因此,寻找抗生素的替代物成了动物营养和饲料研究的热点。益生元又被称作膳食纤维(Dietary Fiber,DF),是一种安全无毒且不被动物体消化吸收而被肠道微生物发酵利用的物质。由于它能选择性地促进有益菌增殖,抑制有害菌生长,还能增强动物机体的免疫功能而被广泛应用于养殖业。大量研究证实益生元物质在调节动物肠道菌群稳态、增强机体先天免疫、提高抗病能力、促进生长方面具有显著作用[4]。 魔芋葡甘露聚糖 (Konjac Glucomannan,KGM)是魔芋块茎中含有的多糖,由β-D-葡聚糖和β-D-甘露糖通过β-1,4糖苷键结合而成,是一种优异的膳食纤维,已有研究证实KGM能够通过肠道厌氧菌发酵产生短链脂肪酸从而调节肠道菌群结构,促进机体免疫,维持健康。氧化魔芋葡甘露聚糖(Oxidized Konjac Glucomannan,OKGM)是由魔芋葡甘露聚糖经双氧水氧化而得到的,其黏度比KGM低,是一种可溶性的膳食纤维,已被证实对动物免疫等有一定的影响[5]。酸解氧化魔芋葡甘露聚糖降低了OKGM的分子量,促进其溶解性,使得OKGM更易发挥其生物功能。本试验旨在探讨酸解氧化魔芋葡甘露聚糖对齐口裂腹鱼肠道菌群多样性等的影响,为进一步扩大魔芋的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
氧化魔芋葡甘露聚糖(由四川农业大学食品学院功能性食品实验室提供),OKGM经由盐酸酸解得到酸解氧化魔芋葡甘露聚糖,即低分子量的氧化魔芋葡甘露聚糖 (Low-Molecular Weight Oxidized KonjacGlucomannan,LOKGM,黏均分子量为9.2kDa)。
试剂:E.Z.N.A®Stool DNA Kit美国Omega公司;Tris美国Sigma公司;甲叉双丙烯酰胺、丙烯酰胺、去离子甲酰胺、尿素(分析纯)美国Amresco公司 ;2×Taq PCR Master Mix、SYBR Green、2×SYBR Premix Ex TapTM大连TaKaRa公司。
嗜水气单胞菌与芽孢杆菌标准品是由齐口裂腹鱼肠道中分离、纯化、鉴定得到。
1.2 仪器与设备
普通PCR扩增仪(美国Bio-Rad公司)、水平电泳槽(北京六一仪器厂)、DYCP-31CN电泳仪(上海恒勤仪器设备有限公司)、Biosence凝胶成像系统(上海圣科仪器设备有限公司)、微量移液器(德国Eppendorf公司)、JY-TD331变性梯度凝胶电泳仪(济南非凡科学器材有限公司)、CFX96荧光定量PCR仪(美国 Bio-Rad公司)、玻璃鱼缸(规格:70 cm×50 cm×70 cm)。
1.3 实验动物
齐口裂腹鱼购自四川雅安天全养鱼场,平均体质量81±2.64 g,购回后先驯养15 d。
1.4 试验设计与饲养管理
齐口裂腹鱼240尾,随机分为4组(每组3个重复,每个重复30尾),分别为对照组(基础饲料)、LOKGM-0.8%(在基础饲料中添加0.8%的LOKGM)、LOKGM-1.6%(在基础饲料中添加1.6%的LOKGM)和LOKGM-3.2%(在基础饲料中添加3.2%的LOKGM)。基础饲料组成及营养水平见表1。饲养期间,每天按每缸体质量总重1.5%投喂饲料;每天换水,换水量占总体积的1/3,并清除缸内不容物。饲养期60 d,每天记录水温,24 h不间断充氧气。饲养期间保持微流水。
1.5 样品的采集
饲养结束后,鱼体饥饿24 h,解剖取样。将健康的齐口裂腹鱼用生理盐水洗净后,再用75%的酒精对体表面进行消毒,低温无菌条件下剪开腹腔,取出肠道,剔除肠部脂肪,将肠道分为前中后肠,分别用无菌镊子挤出肠道内容物于无菌无酶2 mL EP管中,-20℃保存,以备肠道内容物DNA的提取。
1.6 样品DNA提取及PCR扩增
肠道内容物总DNA的提取参照E.Z.N.A®Stool DNA Kit试剂盒说明书进行。总DNA用1.5%琼脂糖凝胶电泳检测,-20℃保存备用。
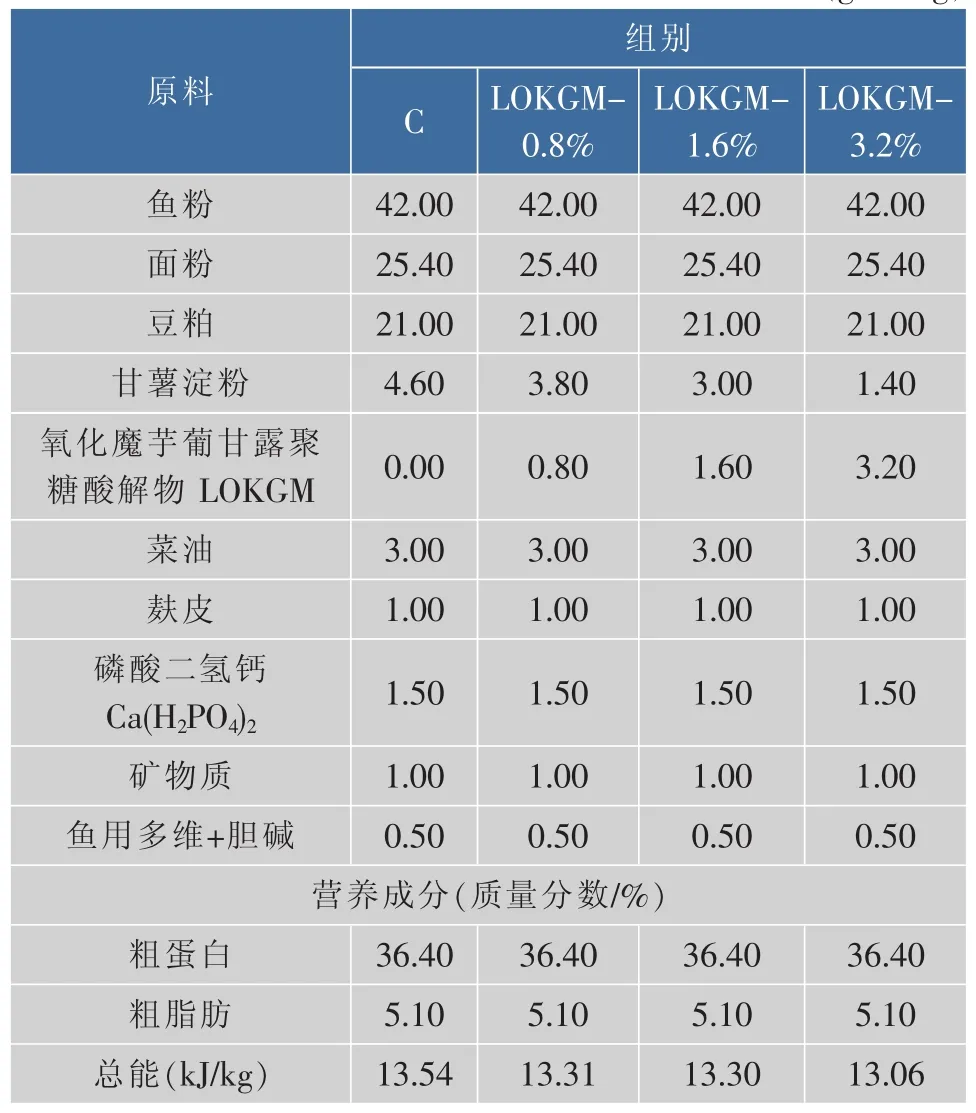
表1 饲料组成及营养水平Table 1 Composition and nutrient levels of experimental diets 质量浓度/(g/100 g)
PCR扩增:参考 Hovda等[6]的引物 BA338f、UN518r(见表2),以肠道内容物总DNA为模板,特异性扩增细菌的16S rDNA基因序列的V3可变区,扩增片段长度大约 200 bp。PCR 反应体系(25 μL):上、 下游引物各 1.25 μL、DNA 模板 2.5 μL、ddH2O 7.5 μL、2×PCR Master Mix 12.5 μL 。 扩增程序:92℃预变性2 min,92℃变性1 min、55℃退火30 s、72℃延伸1 min,30个循环,最后72℃延伸6 min。扩增产物用1.5%琼脂糖凝胶电泳检测,-20℃保存备用。
1.7DGGE及图谱分析
采用JY-TD331变性梯度凝胶电泳仪 (济南非凡科学器材有限公司)对PCR产物进行DGGE分析。 DGGE 的参数为:电泳液:0.5×TAE Buffer;胶质量分数:8%;变性胶 (变性剂为去离子甲酰胺和尿素)梯度为30%~55%;电泳条件:60℃,200 V预电泳10 min,然后100 V,16 h。电泳结束后,用硝酸银进行染色,显色定影后用凝胶成像系统进行拍照。DGGE指纹图谱通过Quantity One 4.6.2软件进行相似性及多样性分析。
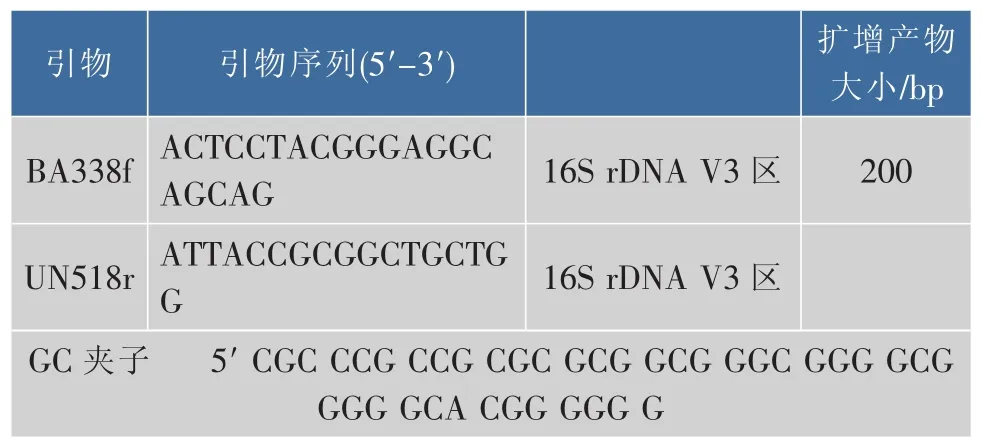
表2DGGE引物及序列Table 2 PCR primers used for DGGE analysis and sequencing
1.8 实时荧光定量PCR分析
参考 Wang 等[7]和相振田[8]的引物(见表 3),以肠道内容物总DNA为模板进行定量分析。

表3 实时定量PCR引物序列Table 3 Real-time quantitative PCR primer sequence
1.8.1 引物鉴定 反应体系(10 μL):上、下游引物各 0.2 μL,2×Taq Master Mix 5 μL, 模板 0.4 μL,去离子水 4.2 μL。
嗜水气单胞菌扩增条件为:预变性95℃5 min,95℃变性 30 s,59℃退火 30 s,72℃ 延伸 30 s,25个循环,最后72℃ 延伸7 min。芽孢杆菌扩增条件为:预变性95℃3 min,变性94℃30 s,退火60℃30 s,延伸72℃ 20 s,30个循环,最后72℃ 延伸10 min。PCR扩增产物由1.5%琼脂糖凝胶电泳鉴定,并割胶回收测序。
1.8.2 标准曲线的制作及样品测定 参考Balcázar等[9]方法稍作修改。采用SYBR Green I荧光染料法,10 μL 反应体系, 含 5 μL SYBR®Premix Ex TaqTM(2×)、 标准品 1 μL、 上下游引物各 0.25 μL、DEPC水 3.5 μL。 反应条件:95 ℃ 3 min;95 ℃ 10 s,62.6 ℃30 s,39个循环后,进行95℃处理10 s;扩增完毕后,迅速降温到65℃进行溶解曲线分析,然后以0.5℃/s的速率从65℃递增到95℃,连续测定样品荧光强度以获取溶解曲线。用荧光定量PCR技术对不同浓度标品进行定量,最后以菌落数为横坐标,Ct值为纵坐标,绘制标准曲线。
样品测定与标准曲线测定使用的反应体系和扩增条件一致。
1.9 数据处理
DGGE指纹图谱通过Quantity One 4.6.2软件,采用UPGMA进行相似性聚类分析,多样性指数用Shannon-Weiner指数(H′)表示,按照公式计算:H′=-ΣPi×lnPi,其中 Pi=ni/H(ni为某一条带的峰高,H 为泳道密度曲线所有峰高的总和)。
所有数据经Excel 2003初步整理后,利用SPSS20.0对数据进行one-way ANOVA分析,采用Duncan法进行多重比较,结果以平均值±标准差表示。
2 结果与分析
2.1 氧化魔芋葡甘露聚糖酸解物对肠道菌群多样性的影响
2.1.1 齐口裂腹鱼肠道菌群16S rDNA的V3区PCR扩增结果 以提取的微生物DNA为模板,进行PCR扩增,产物通过1.5%琼脂糖凝胶检测后发现,均能得到约200 bp的目的产物,且条带清晰明亮,满足DGGE分析的要求(见图1)。
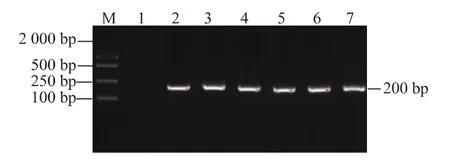
图1 齐口裂腹鱼肠道菌群16S rDNA V3区片段PCR扩增结果Fig.1 Amplification results of 16S rDNA V3 region of intestinal microflor of Schizothorax prenanti
2.1.2 DGGE图谱的多样性及相似性分析 DGGE图谱上的条带反映了齐口裂腹鱼肠道中的优势菌群,条带数量和位置的复杂性说明了菌群的多样性。齐口裂腹鱼饲喂OKGM酸解物后后肠道菌群的DGGE图谱(见图2)中,以UPGAM进行聚类分析可知,LOKGM-1.6%、LOKGM-3.2%与基础组聚为一类,而LOKGM-0.8%单独为一类,说明LOKGM-0.8%组后肠菌群结构较为不同。
添加OKGM酸解物使齐口裂腹鱼后肠菌群的多样性发生了显著的变化 (见图 3)。对照组、LOKGM-0.8%、LOKGM-1.6%、及LOKGM-3.2%组的多样性指数分别为 1.76、1.79、1.96、1.92。 与对照组相比,LOKGM-1.6%与LOKGM-3.2%组后肠肠道菌群多样性显著增加(P<0.05),而 LOKGM-0.8%组却无显著影响,说明OKGM酸解物对齐口裂腹鱼后肠肠道菌群结构有影响,影响程度可能与添加剂量有关。
肠道菌群是肠道的重要组成部分,是肠道微生物与宿主以及所处的环境形成的相互依赖、相互制约的微生态体系。它能够帮助宿主更好地消化吸收营养物质,还能调节机体的免疫功能,维持宿主健康[10]。菌群多样性以多样性指数来表示,菌群多样性指数是反映菌群平衡的重要指标,通常该数值越高,菌群平衡就越难被破坏[11]。本实验结果表明,实验组多样性指数均高于基础组,且中剂量和高剂量组显著高于基础组,说明饲料中添加LOKGM有利于保持齐口裂腹鱼后肠菌群结构的平衡。Zheng等[12]的结果也证明OKGM能够增加齐口裂腹鱼肠道菌群多样性,这与本实验结果一致。Dimitroglou等[13]的研究证明饲料中添加甘露寡糖增加了金头鲷肠道菌群多样性以及物种丰富度,降低了各组之间的肠道菌群组成的相似性,且影响程度与添加剂量有关。
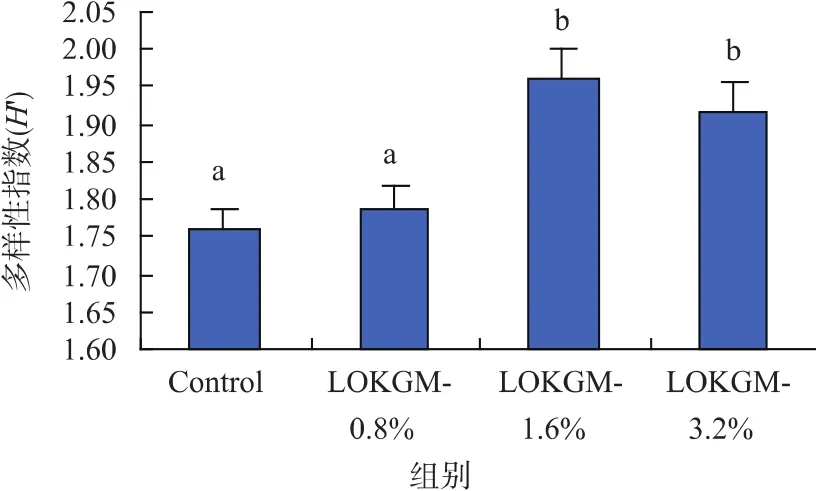
图3 齐口裂腹鱼后肠菌群的多样性Fig.3 Diversity of posterior intestinal microflora of Schizothorax prenanti
实验组与基础对照组肠道菌群的相似性(见表4),LOKGM-3.2%与LOKGM-1.6%组为中等相似,相似性系数达到69.4;而LOKGM-3.2%与LOKGM-0.8%、基础组相似性较低,相似性系数分别为55.1和58.1。LOKGM-1.6%与LOKGM-0.8%、基础组以及LOKGM-0.8%与基础组也是中等相似水平,相似性系数分别为 67.8、67.7、65.0。
2.2 氧化魔芋葡甘露聚糖酸解物对几种肠道微生物数量的影响
根据实时定量PCR标准曲线7个浓度的Ct值和标准嗜水气单胞菌的菌落数计算,得出标准曲线(见图4、图5)分别为:嗜水气单胞菌y=-2.593 6x+41.143,R2=0.996 2;芽孢杆菌 y=-3.147 4x+45.394,R2=0.991 6。各浓度梯度与Ct值的相关系数均达到0.99以上。重复性好,符合作为标准曲线的要求。

图4 嗜水气单胞菌的标准曲线图Fig.4 Standard curve of Aeromonas hydrophila
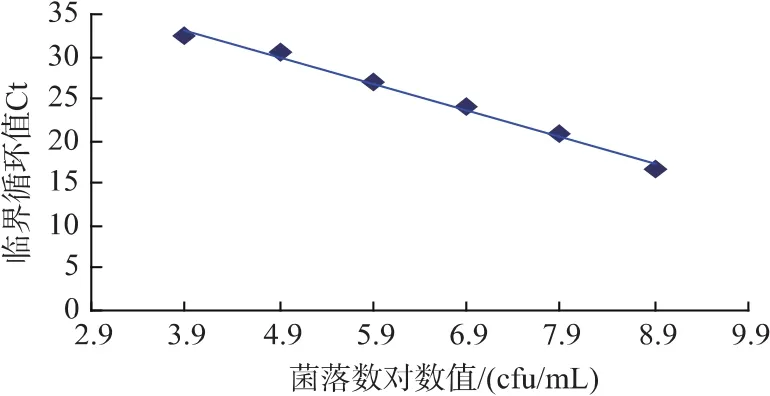
图5 芽孢杆菌的标准曲线图Fig.5 Standard curve of Bacillus
对齐口裂腹鱼肠道总菌以及嗜水气单胞菌和芽孢杆菌进行定量分析(见表5)。由表5可知,饲料中添加LOKGM对嗜水气单胞菌以及芽孢杆菌均有显著影响。与对照组相比,LOKGM显著降低了齐口裂腹鱼前肠嗜水气单胞菌的数量(P<0.05);中肠除LOKGM-3.2%组无显著影响,LOKGM-0.8%、LOKGM-1.6%组嗜水气单胞菌数量均显著降低(P<0.05);后肠中只有LOKGM-3.2%组嗜水气单胞菌的数量显著降低(P<0.05),另外两组则无显著影响。LOKGM-0.8%组前肠和中肠嗜水气单胞菌的数量显著减少(P<0.05),对后肠则无显著影响;LOKGM-1.6%组前中后肠的影响相同,均显著减少(P<0.05);LOKGM-3.2%组前肠和后肠嗜水气单胞菌的数量显著减少(P<0.05),中肠则无显著影响。与对照组相比,饲料中添加LOKGM能使前肠芽孢杆菌的数量显著增加(P<0.05);而中肠除 LOKGM-0.8%组无显著影响,其他两组芽孢杆菌的数量均显著增加(P<0.05);后肠中,除 LOKGM-0.8%组芽孢杆菌的数量显著降低(P<0.05),另两组芽孢杆菌的数量均显著增加(P<0.05)。LOKGM-0.8%组齐口裂腹鱼前肠芽孢杆菌的数量显著增加(P<0.05),对中肠和后肠无显著影响;LOKGM-1.6%组中肠与后肠芽孢杆菌的数量显著增加(P<0.05),对前肠则无显著影响;LOKGM-3.2%组前肠和中肠芽孢杆菌的数量显著增加(P<0.05),对后肠则无显著影响。
嗜水气单胞菌是鱼类条件致病菌,芽孢杆菌在水产养殖方面是一种益生菌,并且对嗜水气单胞菌有一定的抑制作用[14]。Daniels等[15]研究了饲料中添加MOS与芽孢杆菌对欧洲龙虾幼虾肠道菌群的影响,发现单独添加MOS和芽孢杆菌对龙虾肠道菌群多样性及物种丰富度均无显著影响,同时添加MOS与芽孢杆菌则能够降低欧洲龙虾幼虾肠道菌群物种丰富度及多样性。研究中应用实时荧光定量PCR分析了齐口裂腹鱼肠道中嗜水气单胞菌和芽孢杆菌的数量,结果发现OKGM酸解物能够降低肠道中嗜水气单胞菌的数量,增加芽孢杆菌的数量。分析原因可能是OKGM酸解物在肠道中被厌氧菌发酵产生短链脂肪酸(SCFA),降低肠道环境pH,促进乳酸菌等有益菌的生长,从而使有害菌数量减少。Connolly等[16]的研究证实魔芋葡甘聚糖水解物增加了短链脂肪酸的含量及双歧杆菌的数量。Kühlwein 等[17]在饲料中添加 β-(1,3)(1,6)-D-葡聚糖饲喂镜鲤 2周,PCR-DGGE结果显示 β-(1,3)(1,6)-D-葡聚糖添加量为 0.1%、2%时,显著降低了镜鲤肠道的可操作单元(OTUs)数量,同时显著降低了所有剂量组的物种丰富度,但对物种多样性及均匀度无显著影响;研究还证实 β-(1,3)(1,6)-D-葡聚糖的添加能够降低肠道中嗜水气单胞菌的数量。这与本研究结果一致。Dimitroglou等[18]的研究也发现MOS显著降低了虹鳟肠道存活菌群数量,与对照组相比,虹鳟幼鱼MOS组微球菌属、气单胞菌属以及弧菌属数量显著降低。
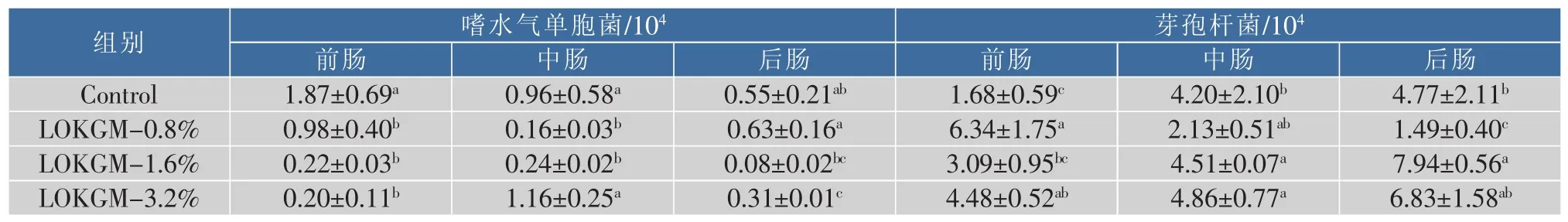
表5 齐口裂腹鱼肠道细菌的数量Table 5 Number of bacterium in intestinal of Schizothorax prenanti
3 结语
综上所述,饲喂氧化魔芋葡甘露聚糖酸解物可以通过增加齐口裂腹鱼肠道菌群多样性来保持菌群平衡的稳态不被破坏;促进肠道益生菌芽孢杆菌的增殖,抑制有害菌嗜水气单胞菌的生长;并且,此添加物对齐口裂腹鱼肠道微生物的影响在添加量为1.6%时效果最佳。

