明日叶中4-羟基德里辛和黄色当归醇的提取纯化及鉴定
王 磊, 张连富
(江南大学 食品学院,江苏 无锡214122)
明日叶(Angelica keiskei),是伞形科多年生草本植物,可药食两用[1]。嫩茎和叶可作为蔬菜用于炒、炸、凉拌或做汤,而全植物可入药。研究表明,明日叶含有人体所需要的多种矿物质、氨基酸、维生素以及微量元素,是一种营养较全面、均衡的蔬菜[2]。此外明日叶还含有查尔酮类、香豆素类、类黄酮类、天然有机锗等天然功能性成分[3],具有抗氧化、抗肿瘤、降血压、降血脂、降血糖、改善睡眠、提高免疫力等保健功能[4]。均衡全面的营养以及优良的保健作用,赋予了明日叶很大的利用价值,以明日叶为原料开发出的产品也多种多样,有保健茶[5]、保健酒[6]、固体饮料[7]、保健胶囊[8]、咀嚼片[9]、营养保健面条[10]、黑番茄酱[11]等。
其中 4-羟基德里辛(4-Hydroxyderricin,4-HD)和黄色当归醇(Xanthoangelol,XAG)是明日叶中主要的功能性保健成分[12]。因此为了更好地开发和利用4-HD、XAG、明日叶及其相关的产品,需要对4-HD和 XAG进行深入的研究探讨。然而,近年来对明日叶的研究主要集中在4-HD和XAG的功能保健作用上,明日叶中4-HD和XAG的提取工艺尚未见报道。因此本文以明日叶为原料,以4-HD和XAG的得率为评价指标,研究提取工艺参数(提取溶剂、温度、时间、次数以及料液比)对提取得率的影响。在此基础之上,采用正交试验法优化提取工艺。此外,本文还采用硅胶柱层析和半制备高效液相分离纯化得到高纯度的4-HD和XAG,并通过液质联用仪(HPLC-MS)及核磁共振仪(NMR)对 4-HD及XAG的分子结构及纯度进行鉴定。为4-HD、XAG及明日叶的利用奠定了基础。
1 材料与方法
1.1 材料与仪器
明日叶根:江苏百代兰花股份有限公司;硅胶(200~300目):国药集团化学试剂有限公司;甲醇、乙醇、丙酮、乙酸乙酯、乙醚:均为分析纯,国药集团化学试剂有限公司;液相甲醇:色谱纯,百灵威科技有限公司。
Waters1525液 相 色 谱 仪 (PDA检 测 器Waters2998,自动进样器 Waters2707):美国 Waters公司;Aduance III 400 MHz核磁共振波谱仪:德国布鲁克AXS有限公司;MALDI SYNAPT MS液相色谱串联质谱联用仪:美国Waters公司;Waters1525半制备高效液相色谱仪 (PDA检测器Waters 2998和自动进样器 Waters 2707):美国 Waters公司;CHRIST冷冻干燥机 ALPHA1-2LD PLUS:德国Marin Christ公司;RV06-ML1B旋转蒸发仪 (倾斜式):德国 IKA。
1.2 4-HD和XAG含量的测定
1.2.1 混合标准溶液配置 精确称取4-HD和XAG各5.0 mg,用甲醇溶解并定容于5 mL容量瓶中,得质量浓度为1 mg/mL的混合对照品储备液。按梯度稀释成质量浓度分别为 0.6、0.3、0.15、0.12、0.09、0.06及0.03 mg/mL的混合标准溶液。
1.2.2 HPLC色谱条件 色谱柱Phenomenex(C18,4.6 mm×l50 mm,5 μm);柱温 30 ℃;流动相甲醇∶水=8∶2;流速 1 mL/min,进样量 20 μL;检测波长330 nm[13]。
1.3 4-HD和XAG提取条件优化
1.3.1 原料的预处理 新鲜的明日叶根,清水洗涤,除去泥土等杂质,于50℃的电热恒温鼓风干燥箱中干燥,粉碎过60目筛,备用。
1.3.2 提取试剂的选择 准确称取5.0 g明日叶根粉于圆底烧瓶中,置于水浴锅中提取,研究提取试剂(乙醚、乙酸乙酯、丙酮、乙醇、甲醇和水)对4-HD和XAG提取得率的影响。
1.3.3 提取单因素试验 准确称取5.0 g明日叶根粉于圆底烧瓶中,置于水浴锅中回流提取,研究乙醇体积分数、温度、时间、料液比和提取次数对4-HD和XAG提取得率的影响。粗提液旋转蒸发除去溶剂后,冷冻干燥。将冻干的粗提物用甲醇定容于250 mL的容量瓶中,HPLC分析,以4-HD和XAG的得率为评价指标,确定提取工艺条件。
1.3.4 正交试验设计 以上讨论了各单因素的影响,但实际操作中各因素相互交叉影响。根据单因素试验结果,选取影响较大的水平进行正交试验,以确定最佳提取条件。
采用 L9(34)正交表,以提取温度(A)、乙醇体积分数(B)、料液比(C)、 提取时间(D)作为 4 个考察因素,选取其最佳条件范围内的3个水平进行试验。正交设计试验因素水平见表1。
1.4 4-HD和XAG的纯化
称取明日叶根粉50 g,在最佳条件(料液比1∶10、80%乙醇、提取温度55℃、提取时间90 min、提取2次)下进行试验,收集粗提液,减压浓缩得到深黄绿色浸膏。

表1 试验设计因素水平表Table 1 Actors and levels of orthogonal test
往浸膏中加入200 mL去离子水,使其充分溶解,用2倍体积乙酸乙酯萃取4次,合并乙酸乙酯相,减压浓缩除去乙酸乙酯,得到萃取液浸膏。
浸膏用少量的洗脱剂 (正己烷∶乙酸乙酯=3∶7)溶解,上样硅胶柱。调节硅胶柱层析的洗脱速度,使其每秒钟流出1~2滴,每5 min接一管。流出液经HPLC-MS检测,分别合并含有4-HD和XAG的组分流出液。减压浓缩除去洗脱剂,得到硅胶柱层析样品。
用半制备高效液相纯化硅胶柱层析样品。色谱条件如下:半制备 C18柱(10 mm×250 mm,5 μm);柱温 30 ℃;流动相甲醇∶水=8∶2;流速 4 mL/min,进样量1 mL;检测波长330 nm。根据出峰情况分别收集相应组分的流出液。减压浓缩除去甲醇后冷冻干燥。
1.5 4-HD和XAG的鉴定
对冷冻干燥的样品进行HPLC-MS及NMR鉴定。其中 HPLC-MS的条件为 CSHC18(2.1mm×100mm,1.7 μm);流动相甲醇∶水=8∶2;柱温:30 ℃;流速:0.3 mL/min;进样量:5 μL。质谱条件为离子方式:ESI;毛细管电压:3.0 kV;锥孔电压:30 V;离子源温度:100℃;脱溶剂气温度:400℃;脱溶剂气流速:500 L/h;锥孔气流速度:50 L/h;碰撞能量(eV):6 V;质量范围:100~1 500 m/z;检测器电压:1 800 V。样品溶于CDCl3。四甲基硅烷作为化学位移标准品。
2 结果与分析
2.1 4-HD和XAG的混合标准曲线
根据HPLC结果可以得出4-HD和XAG的质量浓度X (μg/mL)与峰面积Y的线性关系拟合标准曲线公式分别为:Y=69 398.19X+136 486.68(R2=0.999 6)、Y=85 102.85X+138 820.79 (R2=0.999 1),线性范围为0.03~1 mg/mL。混合标准品与样品的高效液相色谱图如图1所示。

图1 混合标准品及明日叶根粗提液的HPLC色谱图Fig.1 HPLC analysis of mixed standard samples and crude extract sample solution
2.2 4-HD和XAG提取条件优化
2.2.1 提取试剂的选择 试验结果如图2所示。从图中看出,提取试剂对4-HD与XAG得率的影响是一致的。这可能是由于两种物质具有相似的结构,相似的极性[14]。但不同溶剂对这两种物质的提取效果差异显著,乙醇和丙酮的效果较好,甲醇、乙酸乙酯、乙醚次之,水的提取效果最差。这可能是因为乙醇和丙酮的渗透性较大,且与4-HD与XAG的极性较相似,所以乙醇和丙酮的提取效果较好。但是丙酮毒性及挥发性较大,而乙醇较安全,故选择乙醇作为提取溶剂。

图2 提取试剂对4-HD和XAG得率的影响Fig.2 Effect of solvent on 4-HD and XAG yield
2.2.2 提取温度对提取效果的影响 由图3看出,随着温度上升,两个物质得率逐渐增大,当温度达到55℃时,这两物质提取效果最佳。当温度高于55℃时,这两物质得率逐渐下降。4-HD和XAG的提取属于固-液间进行物质传递的过程。体系的温度会影响到原料微粒在溶剂中的运动特性。温度低时溶剂分子运动慢,不能很好地溶解出4-HD和XAG,温度升高4-HD和XAG溶出量增加,提取量增大;但对4-HD和XAG的稳定性研究表明,当环境温度过高时,4-HD和XAG等查尔酮化合物会不可避免地降解[15]。当两者的作用达到平衡时提取量将不再增加,但当后者的作用占主导地位时提取量就会降低。故提取温度应选择55℃左右为宜。

图3 提取温度对4-HD和XAG得率的影响Fig.3 Effect of extraction temperature on 4-HD and XAG yield
2.2.3 乙醇体积分数对提取效果的影响 由图4可知,以乙醇为提取溶剂,体积分数在60%~80%范围内,得率随乙醇体积分数的增加而增大,80%乙醇溶液的提取效果最好。80%~100%范围内,得率随乙醇体积分数的增加而减小。4-HD和XAG均含有酚羟基,在植物体内会与蛋白质、多糖等以氢键及疏水键形式结合,而有机试剂具有断裂氢键的作用。但是纯的有机试剂不足以破坏氢键,故可采用有机试剂和水的复合体系作为提取溶剂。但是4-HD和XAG的极性较低,由“相似相溶”原理知,当提取剂中水的比例过高,使得提取剂极性偏大时,得率会下降。所以乙醇体积分数应选择80%左右为宜。
2.2.4 料液比对提取效果的影响 料液比增大,传质动力增加,使原料中更多目标物质进入到溶液中[16]。当浸提剂用量增加到一定程度,传质达到平衡后,再增加溶剂用量,4-HD和XAG的溶出总量不再增加,而仅仅是更加均匀地分布在溶剂中。考虑到成本,料液比应选择1∶10左右为宜(图5)。

图4 乙醇体积分数对4-HD和XAG提取效果的影响Fig.4 Effect of ethanol concentration on 4-HD and XAG yield
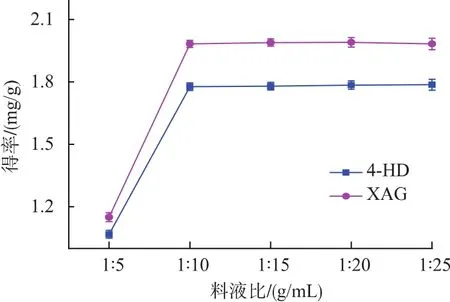
图5 料液比对4-HD和XAG提取效果的影响Fig.5 Effect of ratio of solid to liquid on 4-HD and XAG yield
2.2.5 提取时间对提取效果的影响 由图6可知,随着提取时间的延长,得率先增高,后略微下降。在90 min时,两物质得率达到最大。提取的传质过程要有足够的时间达到平衡,时间太短,提取还没有达到平衡,提取量就较低;但是如果提取时间过长,4-HD和XAG在较高温长时间作用下会受到破坏。故提取时间应选择90 min左右为宜。
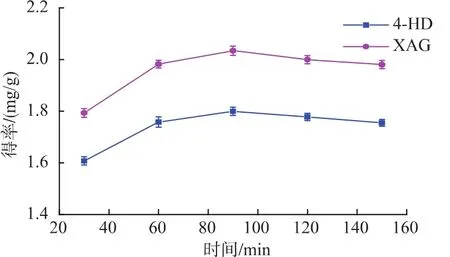
图6 提取时间对4-HD和XAG提取效果的影响Fig.6 Effect of extraction time on 4-HD and XAG yield
2.2.6 提取次数对提取效果的影响 从图7可以看出,对4-HD第1次和第2次提取量分别占总提取量的75.21%和22.87%,第3次及第4次提取量分别占总提取量的1.69%和0.23%。对XAG第1次和第2次提取量分别占总提取量的77.80%和19.81%,第3次及第4次提取量分别占总提取量的1.78%和0.61%。总的来说,4-HD和XAG前两次的提取量分别已达到总提取量的98.08%及97.61%。提取的次数越多,目标产物得率也越多,但同时提取剂消耗量也越多。故提取次数应选择提取2次为宜。
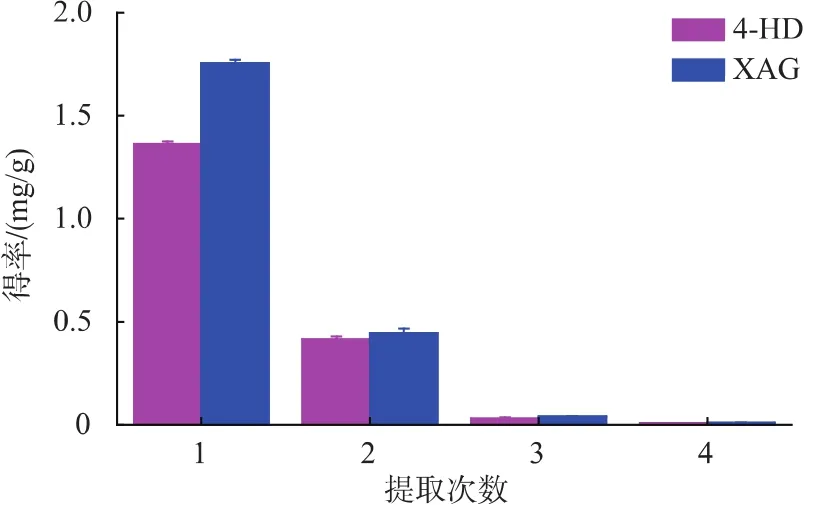
图7 提取次数对4-HD和XAG提取效果的影响Fig.7 Effect of times of extraction on 4-HD and XAG yield
2.2.7 正交试验结果与分析 由单因素试验得,各因素对4-HD与XAG得率的影响是一致的,所以为了方便,在正交试验中只需考察各因素对4-HD得率的影响情况。正交试验设计及结果如表2所示。

表2 正交试验设计及结果Table 2 Orthogonal test and results
根据表2中K值可知,最佳提取工艺为A2B2C1D2,即提取温度55℃,乙醇体积分数80%,料液比1∶10,提取时间90 min。由极差R的大小,可判断出影响得率的因素顺序依次为B>A>D>C,即乙醇体积分数>提取温度>提取时间>料液比。
2.2.8 验证试验 按提取温度55℃,80%乙醇,料液比 1∶10,提取时间90 min,提取2次进行3次平行试验,4-HD得率均值为1.82 mg/g,XAG得率均值为2.12 mg/g,高于表2每一项试验结果,故A2B2C1D2为最佳提取工艺。
2.3 4-HD和XAG的纯化
50 g明日叶根粉在最优条件下提取,粗提液冷冻干燥得到13.79 g粗提物,经测定,其中含有91 mg 4-HD、106 mg XAG。考虑到4-HD和XAG极性较低,经乙酸乙酯萃取可进入到乙酸乙酯相中[13],籍此可以初步除去极性较强的杂质,如类黄酮、极性色素、多糖、无机离子等。减压浓缩除去乙酸乙酯,得到1.03 g萃取物。经萃取后,4-HD的纯度由粗提取中的0.66%提高到8.83%;XAG的纯度由0.77%提高到10.29%。
萃取物过硅胶柱层析,经洗脱剂(正己烷∶乙酸乙酯=3∶7)洗脱,用HPLC-MS检测各收集管4-HD和XAG。结果表明,34-41管主要含有4-HD,50-75管主要含有XAG组分(如图8所示),纯度分别为70.63%和67.94%。合并洗脱组分,浓缩除去洗脱剂,得到硅胶柱层析样品。
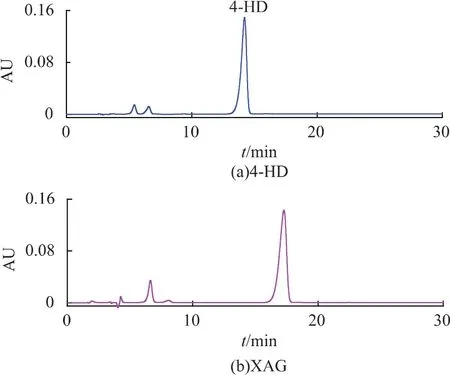
图8 萃取物经硅胶柱层析洗脱HPLC谱图Fig.8 HPLC analysis of different fractions purified by silica gel column chromatography
硅胶柱层析样品用半制备高效液相进行纯化。根据出峰情况分别收集相应组分的流出液,分别在22.306和 28.202 min收集到化合物1和化合物2。减压浓缩除去收集液中的甲醇后冷冻干燥。
2.4 4-HD和XAG的鉴定
对用制备型高效液相纯化得到的化合物1和化合物2进行HPLC-MS及NMR结构及纯度鉴定。质谱图如图9所示。
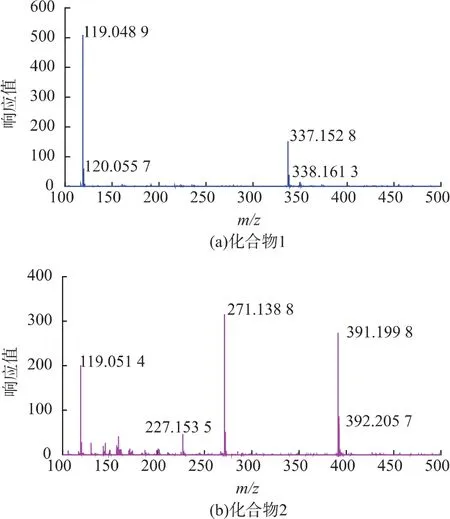
图9 化合物1和化合物2的ESI-MS图谱Fig.9 Results of ESI-MS chromatogram of compound 1 and 2
化合物 1质谱数据(图 9(a)),碎片 m/z 337.152 8是[M-H]-分子离子峰,338.1613是母离子峰,所以其分子量为338。化合物2质谱数据(图9(b)),碎片m/z 391.199 8是[M-H]-分子离子峰,392.205 7是母离子峰,所以化合物2的分子质量为392。
化合物 1 的 NMR 数据:1H-NMR δ1.71(3H,s,H-5″),1.82 (3H,s,H-4″),3.41 (2H,d,3J(H,H) =7.13 Hz,H-1″),3.93 (3H,s,4′-OCH3),5.26(1H,m,3J(H,H) =7.16 Hz,H-2″),6.52(1H,d,3J(H,H) =9.12 Hz,H-5′) 6.90(2H,d,3J(H,H) =8.44 Hz,H-3,5),7.48(1H,d,3J(H,H) =15.45 Hz,H-α),7.56(2H,d,3J (H,H) =8.35 Hz,H-2,6),7.81(1H,d,3J(H,H) =9.29 Hz,H-6′),7.84(1H,d,3J(H,H)=16.60 Hz,H-β),13.48 (1H,s,2′-OH)。13C-NMR δ 17.84 (C-4″),21.75 (C-1″) 25.81 (C-5″),55.80(OCH3),102.21(C-5′),114.67(C-1′),116.08(C-3,5),117.62(C-3′),118.08(C-α),122.05(C-4′),127.63(C-1),129.25(C-5′),130.58(C-3″),131.97(C-2,6),144.19 (C-β),158.24 (C-4),162.99 (C-2′),163.35(C-4′),192.53(C=O)。
化合物 2 的 NMR 数据:1H-NMR δ1.59(3H,s,H-9″),1.67(3H,s,H-8″),1.83(3H,s,H-10″),2.10(4H,m,H-4″,5″),3.49(2H,d,3J(H,H) =7.14 Hz,H-1″),5.06(1H,t,3J(H,H)=6.09 Hz,H-6″),5.30(1H,dd,3J (H,H) =7.20 Hz,H-2″),6.43(1H,d,3J(H,H) =8.90 Hz,H-5′),6.88 (2H,d,3J (H,H) =8.46 Hz,H-3,5),7.46(1H,d,3J(H,H) =15.44 Hz,H-α),7.57(1H,d,3J(H,H)=8.58 Hz,H-2,6),7.57(1H,d,3J (H,H) =8.90 Hz,H-6′),7.86(1H,d,3J(H,H)=15.37 Hz,H-β),13.88(1H,s,2′-OH).13CNMR δ 16.31(C-10″),17.70(C-9″),21.81(C-1″),25.63(C-8″),26.48(C-5″),39.77(C-4″),114.20(C-1′,3′),116.11(C-3,5),118.38(C-α),121.11(C-2″),123.83 (C-6″),127.99 (C-1),129.29 (C-6′),130.56 (C-2,6),132.07 (C-7″),139.73 (C-3″),144.09(C-β),158.08(C-4),161.86(C-4′),163.95(C-2′),192.36(C=O)。
所以由此确定化合物1和化合物2的分子分别为C21H22O4、C25H28O4。结构式见图10。即化合物1为4-HD,化合物2为XAG。
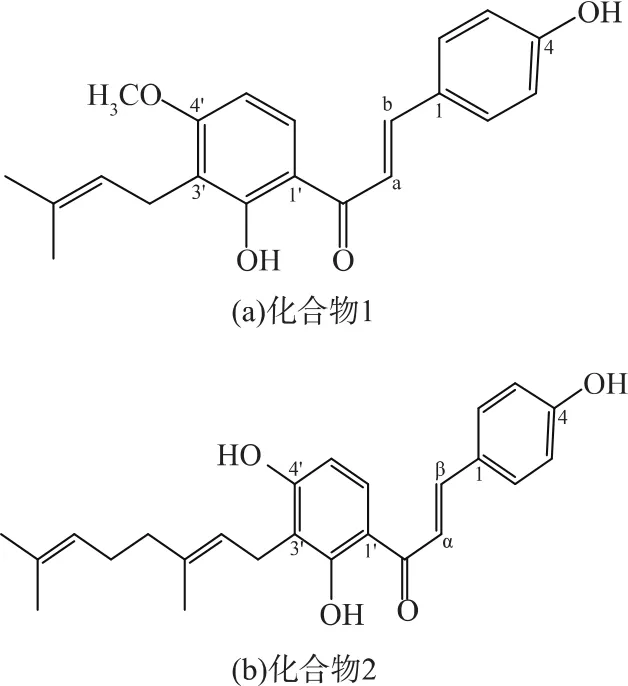
图10 化合物1和化合物2的结构式Fig.10 Chemical structures of compound 1 and 2
3 结 语
本文以明日叶为原料,首次对4-羟基德里辛和黄色当归醇的提取工艺进行探讨。通过单因素以及正交试验得出4-羟基德里辛和黄色当归醇最佳提取工艺,条件为:提取次数2次、提取溶剂80%乙醇、提取温度55℃、提取时间90 min、料液比 1∶10。在此条件下,4-HD得率为1.82 mg/g,XAG得率为2.12 mg/g。这为明日叶以及4-羟基德里辛和黄色当归醇的利用奠定了基础。采用乙酸乙酯萃取、硅胶柱层析以及半制备液相相结合的方法对粗提液进行纯化,经HPLC-MS及NMR分析表明,纯化得到的两种物质为4-羟基德里辛和黄色当归醇,纯度分别为99.08%和98.92%。

